
- •Сольваттану энергиясы
- •15. Дебай - Хюккельдің күшті электролиттер теориясы
- •- Кеуекті диафрагмма; 2 - цилиндр тєрізді мырыш электроды; 3 - мыс электроды.
- •29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
- •30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
- •39. Ион тасымалдау саны
- •40. Гитторф әдісімен ион тасымалдау санын аныќтау
40. Гитторф әдісімен ион тасымалдау санын аныќтау
Бұл єдіс электролит ерітіндісініњ электролизге ұшыра-ѓан кездегі концентрациясыныњ µзгерісіне негізделген. Мысалы, тұз ќышќылын электролиздеген кезде иондары-ныњ ќозѓалу баѓыттары (электр тасымалдауы) сызбанұсќа түрінде суретте кµрсетілген.
-
A+
І
ІІ
ІІІ
-K
+ + + + + +
- - - - - -
+ + + + + +
- - - - - -
+ + + + + +
- - - - - -
A
+
- - - - - - -
+ + + + + +
- - - - - -
+ + + + + +
+ + + + +
- - - - -
B
- - -
- - -CA + -
+ + + + + + + + +
- - - - - - CA + + +
C
Сурет. HCl ерітіндісіндегі H+ жєне Cl- иондарыныњ тасымалдау санын аныќтау кезіндегі электролиз сызбан±сќасы
HCl ерітіндісі ќ±йылѓан электролиттік ваннаны ойша үш бµлікке бµліп ќарастырайыќ: І - анод бµлігі (анолит); ІІ - орталыќ бµлік; ІІІ - катод бµлігі (католит). Ортадаѓы бµлікте электролиз кезінде концентрация µзгермейді, ал І жєне ІІІ бµліктерде µзгереді.
Электролиз басталмай тұрѓанда үш бµлікте де электролиттіњ концентрациясы бірдей (А ќатары), яѓни үш бµлікте де катиондар мен аниондардыњ сандары бірдей .Сутек ионыныњ абсолюттік жылдамдыѓы хлор ионынан 5 есе жоѓары, сондыќтан электролиз басталѓанда катодќа ќарай ќозѓалатын хлор Cl- иондары санынан 5 есе кµп болады. Соныњ нєтижесінде катод бµлігінде 5 анион, 11 катион, ал анод бµлігінде 1 катион, 7 анион болады (В ќатары). Катодта 6 сутек ионы, анодта 6 хлор ионы ж±псыз (бейтараптанбай) ќалатындыќтан, олар электродта зарядсызданып сутегі мен хлор газдарына айналады (С ќатары), сµйтіп
катодтыќ
реакция:
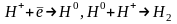
анодтыќ
реакция:
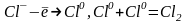
Электролиз аяќталѓанда анод бµлігінде бір катион мен бір анион, катод бµлігінде бес катион мен бес анион ќалады. Демек, электролиз нєтижесінде HCl-дыњ концентрациясы катодќа ќараѓанда анодта 5 есе азаяды. Анодтаѓы концентрация азаюын (СА, катодтаѓы азаюын (СК деп белгілесек, олардыњ ќатынасы катион мен анионныњ абсолюттік жылдамдыќтарыныњ немесе ќозѓалѓыштыќтарыныњ (электр µткізгіштіктерініњ) ќатынасына тењ болады:
Тасымалдау санын аныќтаудыњ Гитторф єдісінде иондардыњ сольваттануы ескерілмейді. Сондыќтан б±л єдіспен тасымалдау саныныњ дєл (шын) мєндері емес тек байќалмалы мєндері аныќталады.
Жылжымалы шекара єдісімен тасымалдау санын анықтау
Б±л єдіспен тасымалдау саны дєл аныќталады. Тасымалдау саны аныќталатын электролиттіњ (МА) белгілі бір концентрациялы (С моль-экв) ерітіндісін электролиздерге ќ±йып, оѓан аттас ионы бар екінші бір электролит (ДА - индикатор электролит) ерітіндісін ќосады (сурет). Осы екі ерітінді арасындаѓы шекара кµзге кµрінетіндей болуы ќажет (ол ‰шін ерітінділердіњ т‰стері немесе тыѓыздыќтары єр т‰рлі болуы керек). Ерітінділерге q кулон электр жіберілген кезде белгілі бір ( уаќыт ішінде аб шекарасы вг дейін жылжиды. Осы уаќыт ішінде ав шекарасыныњ жоѓарѓы жаѓындаѓы абгв кµлемін (V см3) М+ иондары µтеді (жіберілген тоќтыњ баѓыты катиондардыњ тµменнен жоѓары жылжуына сєйкес). Сонда М+ катионыныњ тасымалдау саны
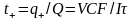 ,
,
м±нда q+ - катионыныњ, Q - катион мен анионныњ тасымалдаѓан (Фарадеймен алынѓан) электр мµлшері; V. C - катионныњ V - кµлеміндегі эквиваленті; І - тоќ к‰ші; F - Фарадей саны; А; - уаќыт, с.
