
- •Сольваттану энергиясы
- •15. Дебай - Хюккельдің күшті электролиттер теориясы
- •- Кеуекті диафрагмма; 2 - цилиндр тєрізді мырыш электроды; 3 - мыс электроды.
- •29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
- •30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
- •39. Ион тасымалдау саны
- •40. Гитторф әдісімен ион тасымалдау санын аныќтау
Гротгус, Фарадей және Аррениустің элетролит ерітінділерінің иондық өткізгіштік табиғатына көз қарасын салыстыр және сипаттама бер
Аррениус теориясының оң және теріс жақтарына баға бер, жауаптарыңызды электролит ерітінділерінің электр өткізгіштігі көз қарасы тұрғысынан негіздеңіз.
Курнаков теориясының көз қарасы тұрғысынан электролит ерітінділерінің түзілу механизіміне сипаттама беріңіз, жауаптарыңызды негіздеңіз.
Элетролит ерітінділеріндегі иондық өткізгіштіктің табиғатын қалай түсінесіз және олардың электр өткізгіштігін қалай түсіндіресіз.
Электролит ерітінділерінде Кулон заңы орындаладыма және электролит ерітінділеріндегі ион зарядының болмауын қалай түсіндіруге болады.
Кристаллдық тор энергиясын есептеу үшін қолданылатын Борн моделіне сипаттама беріңіз.
Кристаллдық тор энергиясына сипаттама беріңіз және оны есептеу үшін Борн әдісін түсіндіріңіз.
Сольваттану энергиясының энергиясын есептеу үшін ұсынылған Борн моделіне сипаттама беріңіз.
Сольваттану энергиясына сипаттама беріңіз және оны есептеу үшін Борн әдісін түсіндіріңіз.
Кристаллдық тор энергиясын есептеу үшін Борн теңдеуін шығарыңыз және талдау жасаңыз.
Сольваттану энергиясын және сольваттану жылуын есептеу үшін Борн теңдеуін шығарыңыз және талдау жасаңыз.
Сольваттану энергиясын және сольватттанудың жылу эффектісін Борна-Бьеррум теңдеуіне сәйкес салыстырыңыз және сипаттама беріңіз.
Күшті электролиттерді түсіндіру үшін неге Аррениус теориясын қолдануға болмайды, жауабын негіздеңіз.
Аррениус теориясымен салыстырғанда Льюистің термодинамикалық теориясының артықшылығын түсіндіріңіз.
Күшті электролит ерітініділері үшін Дебая-Хюккель теориясының қолданбалы бағытына сипаттама беріңіз.
Льюистің термодинамикалық теориясының активтену коэффициентін, активтену ұғымын енгізу мағынасын түсінді, жауабын негізде.
Салыстырмалы электр өткізгіштікке сипаттама беріңіз және оның әлсіз және күшті элетролиттер үшін концентрацияға тәуелділігін түсіндіріңіз.
Эквивалентті электр өткізгіштікке сипаттама беріңіз және оның әлсіз және күшті элетролиттер үшін концентрацияға тәуелділігін түсіндіріңіз.
Күшті қышқылды күшті негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабын негізде.
Әлсіз қышқылды күшті негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабыңызды негіздеңіз.
Күшті қышқылдың әлсіз негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабын негіздеңіз.
Металл-электролит ерітіндісі шекарасында жүретін процесстерді сипаттаңыз, металл пластинкасы бетінде зарядтың пайда болу себебін түсіндіріңіз.
Металл-электролит шекарасында гальвани-потенциалының пайда болу себебін түсіндіріңіз. Неліктен беттік қабат теріс немесе оң зарядқа ие болады. Бұл құбылыс немен байланысты.
Қосэлектірлік қабат құрылысын сипаттаңыз. Қосэлектірлік қабат құрылысы жөнінде қандай ұсыныстарды білесіз, оларды бір-бірімен салыстырыңыз.
Қосэлектірлік қабат құрылысы жөніндегі Гельмгольц моделі мен Гуи-Чапмен моделін салыстырыңыз. Бірінші екі модельден Штерн моделі қандай айырмашылық жасайды.
Даниэль-Якоби элементі негізінде гальваникалық элементтің құрылысын жазыңыз, Электр тоғының пайда болу себебін түсіндіріңіз.
Тоқ көзі ретінде гальваникалық элементтің физикалық мағынасын түсіндіріңіз. Белгілі бір мысал үшін электродта жүретін жартылай реакциясы мен гальваникалық элементте жүретін толық реакцияны көрсетіңіз.
Нақты бір мысал негізінде элетродтық потенциалдың таңбасы неге тәуелді екенін түсіндіріңіз, электродтың теріс және оң мәнге ие болуын дәлелдеңіз, схема келтіріңіз.
Гальваникалық тізбектерге қолданатын Нернст теңдеуін талдаңыз. Элементтің стандартты электрқозғаушы күші мен гальваникалық элементтің электрқозғаушы күшінің физикалық мағынасын түсіндіріңіз. Мысал келтіріңіз.
Электродтарға қолданылатын Нернст теңдеуін талдаңыз. Стандартты электродты потенциал мен тепе-теңдік электродты потенциалының физикалық мағынасын түсіндіріңіз. Мысал келтіріңіз.
Гальваникалық элементтің схемасын қалай жазу керектігін сипаттаңыз. Катодта және анодта қандай реакциялар жүретіндігіне мысал келтіріңіз. Тізбекте электр тоғының пайда болу себебін түсіндіріңіз.
Электролиздің бірінші және екінші заңына сипаттама беріңіз. Ток бойынша шығым дегеніміз не, неліктен электролиз заңдарынан ауытқу процесі байқалады.
Бірінші текті элекродтар екінші текті электродтар бір-бірімен қандай айырмашылық жасайды. Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Газды және тотығу-тотықсыздану электродтарының ерекшеліктерін көрсетіңіз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Химиялық тізбектердің ерекшеліктерін сипаттаңыз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Концентрациялық тізбекті сипаттаңыз (тасымалдану жоқ), реакцияның схемасын жазыңыз.
Концентрациялық тізбекті сипаттаңыз (тасымалдану бар), реакцияның схемасын жазыңыз.
Диффузионды потенциалдың пайда болу себебін түсіндіріңіз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Ионның қозғалғыштығын, абсолютті жылдамдығын, тасымалдану санын сипаттаңыз, Тасымалдану санын анықтау әдістері.
Тасымалдану санын анықтайтын Гитторф әдісі мен қозғалмалы шекара әдісін сипаттаңыз.
1-2.Гротгус, Фарадей және Аррениустің элетролит ерітінділерінің иондық өткізгіштік табиғатына көз қарасын салыстыр және сипаттама бер
Электролиттік диссоциация теориясын 1887 ж. швед ѓалымы, 25 жасар Сванте Аррениус ±сынѓан, теорияда электролит ерітінділерініњ электр µткізгіштігі туралы жања кµзќарастар айтылды. Аррениус теориясыныњ негізгі ќаѓидалары мынадай:
Бейорганикалыќ жєне органикалыќ ќышќылдар, негіздер жєне т±здар ерітіндіде зарядталѓан бµлшектер - иондарѓа ыдырайды.
Иондар идеал газ молекулаларындай бір-бірімен єрекеттеспейді.
Электролиттер к‰шті жєне єлсіз электролит болып екіге бµлінеді. Сол себепті электролиттік диссоциация дєрежесі () деген ±ѓым енгізілді:
= ионѓа ыдыраѓан молекулалар саны
ерітіндідегі жалпы молекулалар саны
Электролиттіњ
(МА) бір молекуласы (
ионѓа ыдырайды дейік, сонда ерітіндініњ
кµлем бірлігінде т‰зілген иондардыњ
саны (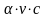 ),
ионѓа ыдырамай ќалѓан молекулалардыњ
саны
),
ионѓа ыдырамай ќалѓан молекулалардыњ
саны
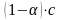 болады, с - электролит ерітіндісініњ
концентрациясы.
болады, с - электролит ерітіндісініњ
концентрациясы.
Сонда ерітіндідегі бµлшектердіњ жалпы саны

і= ,
м±ндаѓы і - Вант-Гоффтыњ изотондыќ
коэффициенті, ол диссоциация нєтижесінде
бµлшектердіњ саны ќанша есе µсетінін
кµрсетеді.
,
м±ндаѓы і - Вант-Гоффтыњ изотондыќ
коэффициенті, ол диссоциация нєтижесінде
бµлшектердіњ саны ќанша есе µсетінін
кµрсетеді.
Егер
=
1
болса к‰шті электролит, =0
болса электролит емес, ал
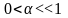 болса єлсіз электролит болады.
болса єлсіз электролит болады.
4. Әлсіз электролиттердіњ диссоциациясы ќайтымды процесс болатындыќтан, процестіњ тепе - тењдік константасын диссоциация константасы деп атайды (Kдис).
Егер MA электролитініњ диссоциациясын келесі т‰рде беретін болсаќ: МАMn++An-, онда массалар єрекеттесу зањын ќолданып диссоциациялану константасын былай жазуѓа болады:

Аррениус теориясыныњ кемшіліктері
Аррениус еріткіш пен еріген зат арасындаѓы ион-диполдыќ єрекеттесуді ескермеді. Электролиттердіњ диссоциалануына ќажетті жылу ќайдан алынатыны Аррениус теориясында т‰сіндірілмейді.
Аррениус теориясында ион-иондыќ єрекеттесу де (иондар арасындаѓы тартылыс не тебіліс к‰штері) ескерілмейді.
6-7-8-9-10-11-12.Кристалдық тор және Сольваттану энергиясындағы Борнның теңдеуі.
Кристалдыќ тор энергиясы кристалл ќ±рамындаѓы иондарды бір-бірінен шексіз ‰лкен ќашыќтыќќа ажыратуѓа ж±мсалатын ж±мыс.
Кристалдық тор энергиясын есептеу үшін Борн келесі теңдеулерді ұсынды:
 (Борнныњ
1 - тењдеуі),
(Борнныњ
1 - тењдеуі),
 (Борнныњ
2 - тењдеуі),
(Борнныњ
2 - тењдеуі),
м±нда Z1, Z2 – иондардың зарядтары; r - иондар арасындағы қашықтық; - ортаныњ диэлектрлік т±раќтысы; NА - Авагадро саны; А - Моделунг т±раќтысы, ол кристалдыњ энергиясы мен иондардыњ µзара єсерлерін ескеретін шама; n - заттыњ табиѓатына жєне сыѓылу коэффициентіне тєуелді шама; А жєне r0 - ді рентгенструктуралыќ анализден, ал n-ді кристалл сыѓылуы туралы мєліметтерден аныќтайды; U - екі бµлшектіњ єрекеттесуініњ потенциалдыќ энергиясы, ал 1 моль үшін Борнның ІІ теңдеуі орындалады.
Габер-Борн термодинамикалық циклі
Г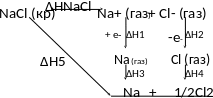 абер-Борн
термодинамикалық циклі кµмегімен
электролиттердіњ кристалдыќ тор
энергиясын есептеуге болады және оны
мына сызба-нұсқа арқылы көрсетуге
болады:
абер-Борн
термодинамикалық циклі кµмегімен
электролиттердіњ кристалдыќ тор
энергиясын есептеуге болады және оны
мына сызба-нұсқа арқылы көрсетуге
болады:
м±нда NaCl - NaCl кристалл торыныњ ыдырау жылу эффектісі;
1 - натрийдіњ иондану ж±мысы;
2 - электронныњ хлор атомымына ынтыќтылыќ энергиясы;
3 - натрий буыныњ конденсация кезіндегі жылу эффектісі;
4 - хлор атомыныњ рекомбинация (ќайта ќосылу) реакциясыныњ жылу эффектісі;
5 - натрийдыњ хлорда жану реакциясыныњ жылу эффектісі.
Гесс
зањын ќолданып жазсаќ: NaCl
= -│1+2+3+4+5│.Содан
соњ кристалдыќ тор энергиясын мына
тењдеуден аныќтаймыз:
 .
.
Сольваттану энергиясы
Сольваттану энергиясы - 1 моль ионныњ вакуумнан еріткішке кµшу процесініњ энергиясы немесе басќа сµзбен айтќанда, 1 моль ионды бір ортадан екінші бір ортаѓа кµшіру ж±мысы. Сольваттану энергиясын аныќтау ‰шін Борн єдісі ќолданылады, онда мына тењдеу пайдаланылады:
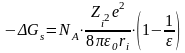 ,
,
м±нда 0 - бірінші ортаныњ диэлектрлік т±раќтысы; - екінші ортаныњ диэлектрлік т±раќтысы; Zіe - ион заряды; rі- ион радиусы.
15. Дебай - Хюккельдің күшті электролиттер теориясы
1925 ж. Дебай жєне Хюккель (физиктер) к‰шті электролиттердіњ электростатикалыќ теориясын ±сынды.
Дебай-Хюккель теориясыныњ негіздері:
Дебай - Хюккель теориясында электролит толыѓымен диссоциацияланѓан (=1) деп ќарастырылады (сондыќтан б±л теория к‰шті электролиттерге ѓана ќолданылады).
Иондар ерітіндіде иондыќ атмосфера т‰зеді, олардыњ таралуы Больцман зањына баѓынады жєне иондар арасында тек электростатикалыќ к‰штер єсер етеді.
Иондыќ атмосферада иондардыњ заряды ‰здіксіз жєне оѓан Пуассон тењдеуі ќолданылады, б±л тењдеу ионныњ заряд тыѓыздыѓы () мен оныњ потенциалыныњ () байланысын кµрсетеді.
Еріткіштіњ ион жанындаѓы диэлектрлік т±раќтысы (ер-ш) оныњ ерітіндідегі диэлектрлік т±раќтысымен (ер-ді) бірдей.
Ион материалдыќ н‰кте, ол тек зарядымен ѓана сипатталады.
Дебай-Хюккель теориясыныњ ќаѓидалары

Б±л
тењдеу Дебай - Хюккель теориясыныњ
бірінші
жуыќтауы
деп аталады, м±ндаѓы
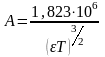 ;
электролиттіњ судаѓы ерітіндісі ‰шін
298К-де жєне
= 78,4
болѓанда А=0,508.
;
электролиттіњ судаѓы ерітіндісі ‰шін
298К-де жєне
= 78,4
болѓанда А=0,508.
1:1 зарядты электролиттер ‰шін жоғарыда берілген тењдеудіњ ќолданылатын концентрация мєндері 0,001-0,01m дейін, иондыќ к‰штіњ мєндері де 0,001-0,01 дейін.
Дебай-Хюккель теориясыныњ ќолданылу шењберін кењейту ‰шін теория авторлары екінші жуыќтауын ±сынды, екінші жуыќтауында ион размерініњ єсері ескеріледі:
 ,
,
м±нда а - ионныњ размері, ол єрекеттесетін екі ионныњ ара ќашыќтыѓы (екі ион радиустарыныњ ќосындысы); В - т±раќты шама, ол сулы ерітінділер ‰шін 0,33 . 108 тењ.
Екінші жуыќтаудыњ ќолданылу концентрациясы m=0,01-0,1, иондыќ к‰ш І= 0,01-0,1.
Кейінірек, екінші жуыќтаудан кейін теорияныњ ‰шінші жуыќтауы ±сынылды. ‡шінші жуыќтауда иондардыњ поляризациясы жєне ерітіндініњ диэлектрлік т±раќтысы ескерілді:
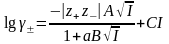 ,
,
м±нда С - т±раќты шама.
‡шінші жуыќтау б±рынѓылардан да кењірек концентрация аралыѓына ќолданылды: m= 0,1 - 1,0, иондыќ к‰ш І= 0,1-1,0.
26. Гальваникалыќ элемент деп электролит ерітіндісіне батырылѓан екі электродтан т±ратын, электродтар электролиттен тыс (сыртќы тізбекте) металл µткізгіші арќылы бір-бірімен жалѓасќан кезде сол сыртќы тізбекте электр тогы пайда болатын ж‰йені айтады.
Гальваникалыќ элементтіњ схемасын шартты т‰рде жазѓанда алдымен бір электродтыњ материалы жєне сол электрод батырылѓан электролит ерітіндісі, содан соњ екінші электрод батырылѓан электролит ерітіндісі мен электродтыњ өзі жазылады. Электродтар ерітіндіден бір вертикал сызыќпен, ал егер ерітінділер арасында потенциал тумаса екі ерітінді бір-бірінен екі вертикал сызыќпен, ал егер туатын болса бір пунктир сызыќпен бµлініп жазылады. Мысалы, мыс-мырыш элементініњ схемасы былай жазылады:
(-)ZnZnSO4CuSO4Cu(+),
c1 c2
