
- •1. Общие указания
- •Принятые обозначения
- •2. Контрольная работа №1
- •2.1. Пример выполнения систематического качественного анализа смеси катионов в растворе неизвестного состава
- •Последовательность выполнения операций:
- •Общая схема анализа
- •2.2. Примеры расчёта параметров равновесных гомогенных систем
- •2.3. Примеры расчёта параметров равновесных гетерогенных систем
- •2.4. Задания контрольной работы № 1.
- •Варианты задания № 3
- •3. Контрольная работа № 2
- •3.1. Примеры расчётов в гравиметрическом методе
- •3.2. Примеры расчётов в титриметрическом методе
- •В 100 г раствора содержится 30 г
- •3.3. Задания контрольной работы n 2
- •Литература
3.2. Примеры расчётов в титриметрическом методе
Расчёты результатов титриметрического анализа основаны на законе эквивалентов, согласно которому вещества реагируют между собой в эквивалентных количествах, которые рассчитываются по формуле :
![]() (15)
(15)
При решении задач рекомендуется придерживаться следующего плана:
1) выяснить метод анализа и составить соответствующую реакцию;
2) обратить внимание на достаточность данных в условии задачи (недостающие величины следует найти в справочной литературе);
3) обозначить количество каждого реагирующего вещества числом эквивалентов и составить расчётную формулу;
4) обратите внимание на размерность величин, они должны быть приведены к одной системе единиц;
5) ввести числовые значения в расчётную формулу и произвести вычисления.
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
З а д а ч а 1. Рассчитать навеску тетрабората натрия, необходимую для приготовления 500 см3 раствора с молярной концентрацией эквивалента 0,1500 моль/дм3
Р е ш е н и е. 1) Вычисляют фактор эквивалентности и молярную массу эквивалента Na2B4O7.10H2O
Тетраборат натрия применяется в качестве стандартного вещества в методе кислотно-основного титрования : f(Na2B4O7).10H2O = 1/2.
М(1/2 Na2B4O7.10H2O) = 1/2M(Na2B4O7.10H2O) = 1/2.381,4 = 190,7 г/моль
2) Рассчитывают навеску тетрабората натрия по формуле (15) :
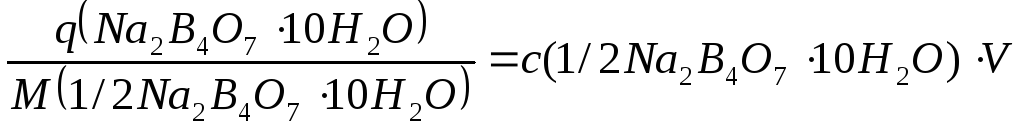
q =0,1500.0,5.190,7 = 14,3025 г.
О т в е т : для приготовления раствора требуется 14,3025 г тетрабората натрия.
З а д а ч а 2. Рассчитать навеску дихромата калия, необходимую для приготовления 250 см3 раствора с молярной концентрацией эквивалента 0,0500 моль/дм3.
Р е ш е н и е. 1) Вычисляют фактор эквивалентности и молярную массу эквивалента К2Cr2O7
Восстановление дихромата калия, являющегося стандартным веществом в методе йодометрии, протекает по реакции :
Cr2O72- + 14H+ + 6е = 2Cr3+ + 7H2O
Поскольку в полуреакции участвует 6 электронов, то f= 1/6 и
M(1/6 К2Cr2O7) = 1/6M(К2Cr2O7) = 1/6.294,18 = 49,03 г/моль.
2) Рассчитаем навеску К2Cr2O7 по формуле (15) :
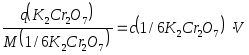
q = 0,0500.0,250.49,03 = 0,6129 г.
О т в е т : для приготовления раствора требуется 0,6129 г дихромата калия.
З а д а ч а 3. Вычислить объём раствора азотной кислоты плотностью р=1,180 г/см3, необходимый для приготовления 3 дм3 раствора с молярной концентрацией эквивалента приблизительно 0,20 моль/дм3.
Р е ш е н и е. 1) Рассчитывают массу безводной азотной кислоты, требующуюся для приготовления 3 дм3 раствора с молярной концентрацией эквивалента 0,20 моль/дм3.
F(HNO3) = 1 , M(1/1HNO3) = M(HNO3) = 63 г/моль.
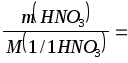 c(1/1HNO
).V(дм3)
c(1/1HNO
).V(дм3)
m(HNO3) = 0,20.3.63 = 37,8 г.
2) По плотности раствора HNO3 находят в справочнике массовую долю азотной кислоты. Раствор с массовой долей 30 % масс. имеет плотность 1,18 г/см3. Это значит, что в 100 г раствора содержится 30 г HNO3.
3) Рассчитывают, в каком количестве 30% масс. раствора содержится 37,8 г безводной азотной кислоты. Для этого составляют пропорцию :
