
- •Раздел IV
- •Тема 4.15
- •III. Литература основная
- •Нормативно-правовые документы
- •IV. Учебно-материальное обеспечение
- •Тема 15. Органическое топливо и его переработка
- •Вопрос № 3. Жидкое топливо. Первичная и вторичная переработка нефти
- •Вопрос № 4. Газовое топливо и его переработка
- •Лист регистрации изменений

|
МЧС России |
Дальневосточная пожарно-спасательная академия – филиал Санкт-Петербургского университета ГПС МЧС России |
|
Учебно-методический комплекс по дисциплине «Химия» |
|

СМК-УМК-4.4.2-67-2014 |
Управление документацией |
УТВЕРЖДАЮ
Начальник кафедры
естественно-научных и
специальных дисциплин
подполковник внутренней службы
Г.А. Михайлова
«_____» ______________ 2014 г.
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
для проведения лекционного занятия
по дисциплине «Химия»
для курсантов 1 курса по специальности 280705.65 –
«Пожарная безопасность»
Раздел IV
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Тема 4.15
ОРГАНИЧЕСКОЕ ТОПЛИВО И ЕГО ПЕРЕРАБОТКА
ЗАНЯТИЕ № 4.15.1
ОРГАНИЧЕСКОЕ ТОПЛИВО И ЕГО ПЕРЕРАБОТКА
Обсуждена на заседании ПМК
протокол №__ от «___»________2014г.
Владивосток
2014 г
I. Цели занятия
Учебная: познакомить с природными источниками получения органических веществ, пожарной опасностью различных видов топлив и особенностями их переработки; Воспитательная: воспитывать у обучаемых чувство ответственности за подготовку к дальнейшей практической деятельности.
II. Расчет учебного времени
Содержание и порядок проведения занятия |
Время, мин |
Примечание |
ВВОДНАЯ ЧАСТЬ |
3 |
|
ОСНОВНАЯ ЧАСТЬ |
|
|
Учебные вопросы |
|
|
1. Классификация топлива и его основные характеристики |
10 |
|
2. Твердое топливо. Переработка угля |
30 |
|
3. Жидкое топливо. Первичная и вторичная переработка нефти |
30 |
|
4. Газовое топливо и его переработка |
15 |
|
ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
2 |
|
III. Литература основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное-М.: Интеграл-Пресс, 2007.-728 с.
2.Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова /СПб.: Санкт-Петербургский университет ГПС МЧС России, 2008 г. – 425 с.
Нормативно-правовые документы
1. ГОСТ 12.1.004 – 89 . Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения.
IV. Учебно-материальное обеспечение
1. Технические средства обучения: телевизор, видеомагнитофон, DVD-проигрыватель, компьютерная техника, интерактивная доска.
2. Периодическая система элементов Д.И. Менделеева, демонстрационные плакаты, схемы.
Тема 15. Органическое топливо и его переработка
В настоящее время основным источником энергии на Земле
является химическая энергия топлива.
Вопрос № 1. Классификация топлива и его основные
характеристики.
1. По агрегатному соотоянию топливо подразделяется на твердое (каменный и бурый угли, горючие сланцы, торф, древесина ), жидкое ( нефть и продукты переработки топлива: бензин, керосин, мазут и т.п.), газообразное или газовое (природный газ и продукты переработки жидкого и твердого топлива).
2. По способу получения различают топливо естественное (например, уголь, нефть) и искусственное (например, керосин, генераторный газ).
Основные характеристики топлива
Важнейшей характеристикой топлива является его энтальпия (теплота сгорания). Из курса химической термодинамики Вы помните, что стандартной энтальпией сгорания Н0сгор. вещества называют тепловой эффект реакции окисления 1 моля вещества кислородом с образованием высших оксидов. Энтальпию (теплоту) сгорания обычно относят к стандартным условиям (Т = 298 К, р = 101,3 кПа). Расчет этой величины проводят в соответствии с законом Гесса, используя табличные значения стандартных энтальпий образования Н0обр. веществ, участвующих в реакции горения.
Например, энтальпию сгорания метана
СН4 + 2О2 = СО2 + 2Н2О(г)
можно подсчитать по уравнению
Н0сгор. (СН4) = Н0 (СО2) + 2 Н0 (Н2О) Н0 (СН4), кДж/моль.
Подставляя значения энтальпий образования продуктов горения и самого метана и принимая Н0 (О2) = 0, получаем
Н0сгор. (СН4) = (393,5 2 241,8) ( 74,5) = 802,4 кДж/моль.
В энергетике свойства топлива обычно характеризуют его удельной теплотой сгорания, которая равна количеству теплоты, выделяющемуся при сгорании 1 кг жидкого или твердого топлива или 1 м3 газообразного топлива до образования высших оксидов. Чем выше теплота сгорания топлива, тем больше ценность этого топлива. Удельная теплота сгорания топлива Q т может быть рассчитана двумя способами.
1. По известному значению энтальпии сгорания
Q т = - Н0сгор 1000 / М, кДж/кг, где
М - молярная масса, г/моль.
Для нашего примера удельная теплота сгорания метана составит
Q
т =
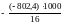 = 50142 кДж/кг.
= 50142 кДж/кг.
2. Значения низшей теплоты сгорания(удельной теплоты сгорания) материалов также могут быть рассчитаны по формуле Д.И.Менделеева
QН = 339,4 [C] + 1257 [H] 108,9 { ([O] + [N]) [S] } 25,1 (9 [H] + [W]),
кДж/кг, где
[C], [H], [O], [N], [S], [W] - содержание (в процентах) углерода, водорода, кислорода, азота, серы и влаги в горючем веществе.
Следует отметить, что ввиду сложности состава природного топлива расчет удельной теплоты его сгорания затруднен, поэтому обычно ее определяют экспериментально.
Вопрос № 2. Твердое топливо. Переработка угля
В твердом топливе можно условно выделить его горючую и негорючую части. Горючая часть в основном состоит из пяти элементов: углерода, водорода, серы, кислорода и азота. К негорючей части топлива относятся неорганические вещества, переходящие после сжигания топлива в золу и влагу. Влага снижает теплоту сгорания топлива, т.к. на ее испарение расходуется теплота. На нагревание золы также расходуется теплота.
Удельная теплота сгорания различных видов твердого топлива колеблется в широких пределах:
каменный уголь 30 60 МДж/кг
бурый уголь 23 31 МДж/кг
торф 20 24 МДж/кг
горючие сланцы 14 17 МДж/кг
древесина 13 18 МДж/кг
Для извлечения ценных компонентов и придания более удобного для использования вида твердое топливо подвергают химической обработке. Используются в основном три способа обработки твердого топлива:
пиролиз (сухая перегонка);
частичное окисление (конверсия);
гидрогенизация.
Мы рассмотрим процессы переработки наиболее распространенного вида твердого топлива – каменного угля.
Сухая перегонка угля (пиролиз)
"Один сумасшедший предлагает осветить Лондон, и чем бы, вы думали? Представьте себе - дымом!" Великий романист Вальтер Скотт, это его слова, ошибся. Оказалось, что в предложении одного из английских ученых У. Мурдока освещать улицы городов газом, образующимся при сухой перегонке каменного угля, нет ничего утопического. Сначала в Англии, а с 1863 года и в Петербурге задымили трубы газовых заводов. Яркие язычки газовых рожков осветили Невский проспект. Так началась история химической переработки каменного угля.
Каменный уголь, как и другое органическое топливо, состоит в основном из углерода и водорода, но углерода в каменном угле в пять-десять раз больше, чем в нефти. Чем старше каменный уголь, тем больше углерода в нем содержится. Наиболее богат им антрацит.
Пиролиз (от греч. "огонь" + "разложение, распад") разложение и другие химические превращения химических соединений при нагревании без доступа воздуха.
Пиролиз каменного угля или коксование это переработка каменного угля при 900 - 11000 С без доступа воздуха с целью получения каменноугольного кокса, коксового газа, каменноугольной смолы и других продуктов. На коксование отправляется в среднем 1/4 мировой добычи угля.
Основные виды коксохимической продукции (в % по массе): каменноугольный кокс 76 78, коксовый газ 14 15, различные химические продукты 5 6.
Предварительно обогащенные (отделенные от минеральных примесей), измельченные до зерен размером менее 3 мм и тщательно перемешанные угли (шихту) нагревают до высокой температуры без доступа воздуха. Происходит разрыв некоторых химических связей и соответственно распад макромолекул, в результате чего образуется твердый остаток - кокс, жидкие и газообразные продукты.
Коксованию можно подвергать лишь некоторые типы каменных углей, так называемых коксующихся. Многие виды ископаемых углей, в том числе бурые, не коксуются, не образуют прочного кокса, нужного металлургии. Их обрабатывают методом полукоксования, отличающимся более низкой температурой нагрева (500-6000 С).
Первая и наиболее легкая фракция, образующаяся при коксовании – летучие продукты – представляют собой коксовый газ. Основными компонентами коксового газа являются (в объемных %):
водород Н2 58 62;
метан СН4 24,5 26,5;
оксид углерода (II) СО 5 6,7;
оксид уклерода (IV) СО2 1,6 3,0;
азот N2 2,0 3,5;
кислород О2 0,4 0,8;
прочие 2 2,5.
Из 1 тонны сухой угольной шихты получают 140-150 кг или 340-350 м3 газа. Поскольку в состав кокосового газа входит значительное количество горючих компонентов, он газ взрывоопасен (КПР от 6 до 30 %), а, кроме того, и токсичен.
Полученные газообразные продукты в дальнейшем используются как топливо для промышленных печей, и как источник ценных продуктов химической промышленности (водорода для получения аммиака, синтезгаза, метана и др.).
Часть летучих продуктов, образующихся при коксовании угля, при охлаждении превращаются в жидкую фракцию. Жидкая фракция состоит из двух основных частей – водной и органической.
Водная часть, помимо самой воды, включает в себя значительное количество аммиака. До внедрения в промышленность метода получения аммиака по Габеру из водорода и азота, переработка угля была основным источником получения аммиака.
Органическая часть жидкой фракции представляет собой каменноугольную смолу или каменноугольный деготь. Долгое время его считали нежелательным отбросом. Но в середине прошлого века точка зрения на каменноугольный деготь резко изменилась.
В 1825 году М. Фарадей открыл в каменноугольном дегте бензол. Позднее немецкий химик Митчерлих синтезировал нитробензол C6H5NO2 из бензола, а вслед за этим выдающийся русский химик Зинин осуществил восстановление нитробензола в анилин C6H5NH2 . Анилин – основной продукт для получения многих красителей. Открытие Зинина оказало решающее влияние на судьбу каменноугольного дегтя – единственного тогда источника бензола.
Выход каменноугольной смолы составляет 3,5 % от массы угольной шихты. В состав смолы, которая представляет собой вязкую черную жидкость с характерным фенольным запахом, входит около 10 тысяч соединений, из которых выделено и идентифицировано более 450 (50 % от общей массы). Наиболее важными компонентами являются бензол, толуол, нафталин, антрацен, фенол, пиридин и другие ценные вещества.
Тяжелые фракции каменноугольной смолы представляют собой каменноугольные масла. Это вязкие жидкости от светло-желтого до темно-коричневого цвета с характерным фенольным запахом. Выход их примерно 30 % от массы каменноугольной смолы. Каменноугольные масла используют для дальнейшей химической переработки с целью получения различных веществ (фенола, нафталина, лаков и др.). Кроме этого на основе этих масел получают так называемые технические каменноугольные масла: для производства технического углерода (сажи) и дорожных покрытий; обмасливания углей (для предотвращения их смерзания); для консервирования древесины (масла - антисептики, например, креозотовое, применяются при пропитке шпал ); для приготовления технического мыла (применяются в дезинсекции, дезинфекции и в ветеринарной практике).
Каменноугольный кокс – твердый пористый продукт серого цвета, состоит на 85-98 % из углерода С, остальное приходится на золу. Кокс необходим в металлургии, с его помощью в доменных печах железная руда превращаетсяв чугун.
Газификация угля
Газификация твердых топлив - превращение углей, торфа, сланцев в горючий газ, состоящий главным образом из СО и Н2, при высокой температуре в присутствии окислителя (газифицирующего агента). Процесс проводится в газогенераторах, поэтому получаемые газы называются генераторными.
Газификацию твердых топлив можно рассматривать как неполное окисление углерода. Наиболее часто окислителями служат кислород, углекислый газ и водяной пар:
С + 0,5 О2 СО
С + СО2 2СО
С + Н2О СО + Н2
Наряду с основными реакциями осуществляются следующие:
С + О2 СО2
СО + Н2О СО2 + Н2
С + 2Н2 СН4
СО + 3Н2 СН4 + Н2О
СО + Н2 0,5СН4 + 0,5 СО2 .
Таким образом, прямой продукт газификации (так называемый сырой газ) помимо основных компонентов СО и Н2 всегда содержит некоторые количества СО2, СН4 и Н2О, а при использовании воздуха - еще и N2.
Газ, который получают по реакции С + Н2О СО + Н2,
называют также водяным газом. Водяной газ применяется в производстве углеводородов, метанола и др. (в этих случаях он называется синтез-газом или сигазом). Теплота сгорания водяного газа достаточно высока - до 12 МДж/м3.
В 1888 году Д.И. Менделеевым была предложена идея подземной газификации угля. "...Настанет, вероятно, со временем даже такая эпоха, что угля из земли вынимать не будут, а там в земле его сумеют превращать в горючие газы", - писал Менделеев. Позднее, в 1912 году эту идею высказал и У. Рамзай.
Подземная газификация твердых топлив - это превращение угля, сланцев, торфа непосредственно на месте их залегания в недрах земной коры в горючий газ, который выводят на поверхность через буровые скважины. Разработано несколько методов подземной газификации угля, однако по ряду экономических и других причин широкой практической реализации они пока не получили.
Гидрогенизация угля
При гидрогенизации (каталитическом гидрировании ) измельченное твердое топливо реагирует с водородом в присутствии катализаторов при температуре около 5000 С и высоком давлении. В результате реакции образуются жидкие и газообразные продукты: бензин, минеральные масла, метан и др.
Научные основы процесса были разработаны в начале 20 века В.Н. Ипатьевым, Н.Д.Зелинским, Ф. Бергиусом, Ф. Фишером и др.
Сравнение химического состава угля и нефти показывает, что нефть содержит гораздо больше связанного водорода, чем уголь. Зато в угле имеются связанный кислород, сера и углекислый газ, которые представляют собой "нежелательные примеси". Их особенно много в буром угле. Если нужно превратить такое сырье в бензин, дизельное топливо и т.п., от этих примесей избавляются путем гидрирования под давлением. При этом примеси восстанавливаются, переходят в летучие водородные соединения и отгоняются.
S + H2 H2S
0,5O2 + H2 H2O
Для такого процесса необходимо значительное количество водорода, который вместе с оставшимся углеродом образует углеводородные смеси, подобные нефтяным фракциям.
В 30-х годах в некоторых странах, в частности в Германии и Великобритании, были построены первые промышленные предприятия для получения из угля бензина, дизельного топлива, фенолов, смазочных масел. Гидрогенизация угля в промышленном масштабе в нашей стране была освоена в 50-х годах. В это же время, в 50-х годах, производство синтетического жидкого топлива во всем мире практически прекратилось. Это было связано с открытием в этот время богатых нефтяных месторождений и СССР, на Ближнем востоке и других районах. Цена синтетического топлива была в 5-7 раз выше моторного топлива, получаемого из нефти.
Однако в 70-х годах цена на нефть резко повысилась. Кроме того, стало очевидным, что при существующих масштабах потребления нефти ( 3 млрд. т/год) запасы ее, пригодные для добычи экономичными методами, будут истощены в начале 21 века. Запасы же угля по расчетам будут истощены только к 27 веку. Проблема вовлечения твердого топлива, главным образом угля, в переработку для получения жидких продуктов - заменителей нефти стала вновь актуальной.
В общем виде процесс получения синтетического жидкого топлива можно представить в следующем виде:
nCO + 2nH2 = (CH2)n + nH2O
2nCO + nH2 = (CH2)n + nCO2
В свою очередь смесь водорода и окиси углерода получают методом газификации угля.
Первичным продуктом синтеза является смесь насыщенных углеводородов и алкенов с различной длиной цепи атомов углерода. При разгонке получают газы типа пропана и бутана, а также бензин, дизельное масло. Однако качество такого бензина из-за низкого октанового числа невелико и в дальнейшем его подвергают дополнительной обработке.
