
Правило фаз Гиббса
закон термодинамики многофазных многокомпонентных систем, согласно которому число фаз, сосуществующих в равновесии, не превосходит числа независимых компонентов более чем на 2.
Правило фаз Гиббса определяет соотношение между числом фаз (Ф), компонентов (К), внешних переменных (П) и числом степеней свободы или вариантности (С) термодинамической системы, находящейся в равновесии и записывается следующим образом:
С = К + 2 – Ф;
Цифра 2 в правиле фаз связана с существованием 2-х переменных (температуры и давления), одинаковых для всех фаз. Например, правило фаз Гиббса для постоянного давления запишется как:
С = К +1 – Ф
2Свойства
Когда луч света направлен на золь сбоку, то его путь
обнаруживается на темном фоне в виде светящегося конуса ––конуса
Тиндаля.
Основа появления конуса Тиндаля –– рассеяние света
коллоидными частицами.
Если размер частицы меньше длины полуволны падающего
света, то наблюдается дифракционное рассеяние света. Свет
огибает частицы и рассеивается в виде волн, расходящихся во все
стороны.
Это явление –– опалесценция, свойственно золям, проявляется
как свечение матового цвета, чаще голубоватых оттенков. Уравнение Рэлея
Рэлей
вывел уравнение, связывающее интенсивность
опалесценции с размером частиц и
концентрацией частиц в системе:
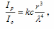 где
I0 –
интенсивность падающего света, Ip –
интенсивность опалесценции,
Ip/I0 –
мутность системы, k –константа, с
–концентрация (кг/м3),
где
I0 –
интенсивность падающего света, Ip –
интенсивность опалесценции,
Ip/I0 –
мутность системы, k –константа, с
–концентрация (кг/м3),
r – радиус частицы (м), λ –длина волны падающего света (м).
Ультрамикроскопия
При рассматривании в ультрамикроскопе золя видны
беспрерывно движущиеся, разного цвета частицы, из которых
наиболее мелкие выглядят как светящиеся точки. Интенсивность
рассеяния света зависит от концентрации частиц, от их размера и
формы.
Ультрамикроскопия позволяет косвенно судить о массе,
размерах и форме коллоидных частиц.
БИЛЕТ №8
Однокомпонентные системы. Диаграмма состояния однокомпо-
нентной системы (вода).
Электрокинетические свойства коллоидных систем. Строение
двойного электрического слоя. Электротермодинамический и
электрокинетический ( ) потенциал коллоидной частицы.
1.Для однокомпонентной системы (К=1) правило фаз записывается в виде
С = 3-Ф . (9)
Если Ф = 1, то С =2 , говорят, что система бивариантна;
Ф = 2, то С =1 , система моновариантна;
Ф = 3, то С =0 , система нонвариантна.
Вариантность системы (число степеней свободы) равная двум соответ-ствует такому геометрическому образу на фазовой диаграмме однокомпо-нентной системы, при котором можно произвольно (в определенных преде-лах) изменять значения двух переменных. В случае однокомпонентной сис-темы эти переменные ? давление и температура. При этом число равновес-ных фаз не изменится, это будет одна фаза. Следовательно, на плоской диа-грамме этому состоянию соответствует образ ? плоскость.
Фазовая диаграмма воды
Фазовая диаграмма воды в координатах р - Т представлена на рис.1. Она составлена из 3 фазовых полей - областей различных (р,Т)-значений, при которых вода существует в виде определенной фазы - льда, жидкой воды или пара ( обозначены на рис.1 буквами Л, Ж и П, соответственно). Эти фазовые поля разделены 3 граничными кривыми.
Кривая АВ - кривая испарения, выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию (жидкая вода) D (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1. Такое равновесие называютмоновариантным. Это означает, что для полного описания системы достаточно определить только одну переменную - либо температуру, либо давление, т.к. для данной температуры существует только одно равновесное давление и для данного давления - только одна равновесная температура.
При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две независимые переменные (С = 3 - 1 = 2): температура и давление.
При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар), поэтому Ф=1.
Линия АС - эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствуетмоновариантному равновесию (лед) D (пар) (С=1). Выше линии АС лежит область льда, ниже - область пара.
Линия АD -кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) D (жидкая вода).
2.Существование двойного электрического слоя (ДЭС) ионов и скачка потенциала на границе раздела двух фаз играет важную, а иногда – основную роль во многих явлениях важных для теории и практики. К ним относятся: электродные процессы, электрокапиллярные и электрокинетические явления, явления связанные с электростатическим взаимодействием коллоидных частиц, в значительной степени определяющие устойчивость дисперсной системы. Все эти явления, взаимосвязанные посредством ДЭС, называются электроповерхностными.
Различают три возможных механизма образования ДЭС:
в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация);
в результате избирательной адсорбции в межфазном слое ионов электролитов;
в результате ориентирования полярных молекул сопряженных фаз при их взаимодействии.
По современным представлениям (теория Штерна) строение ДЭС представляется следующим образом: ионы входящие в состав твердой фазы, образуют внутреннюю обкладку двойного слоя; ионы противоположного знака, т.е. противоионы образуют внешнюю обкладку, при этом часть противоионов находится в непосредственном соприкосновении с ионами твердой фазы, образуя плотный слой (слой Гельмгольца, адсорбционный слой), другая часть противоионов составляет диффузный слой (слой Гуи).
Система в целом всегда является электронейтральной, то есть число зарядов внутренней обкладки должно быть равно числу зарядов противоионов (плотный слой + избыток в диффузном слое).
Электрокинетический потенциал.
Потенциал на поверхности - φ называется термодинамическим потенциалом и характеризует скачок потенциала на поверхности раздела между фазами.
Потенциал на поверхности раздела φ и потенциал так называемой плоскости максимального приближения (расположенной на расстоянии Δ порядка молекулярных размеров) φ0 принадлежат к разряду практически неизмеримых величин.
Для характеристики электрических свойств поверхности используют ζ-потенциал – потенциал границы скольжения фаз, определяемый экспериментально различными методами (метод потенциала протекания, электрофоретический метод и др.).
ζ-потенциал можно представить как работу, необходимую для переноса единичного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжения.
ζ-потенциал по знаку совпадает с φ-потенциалом.
БИЛЕТ №9
Уравнение Клапейрона-Клаузиуса и его применение к процессам
испарения и плавления.
Влияние различных факторов на величину дзета-потенциала.
Потенциалы оседания, течения.
1.КЛАПЕЙРОНА-КЛАУЗИУСА УРАВНЕНИЕ, устанавливает связь между изменениями равновесных значений т-ры Т и давления р однокомпонентной системы (чистого в-ва) при фазовых переходах первого рода (плавлении, испарении, сублимации, полиморфных превращениях). Имеет вид: dp/dT=L/ТV
где V - изменение объема системы при фазовом переходе, L - теплота перехода. При равновесном переходе 1 моля в-ва из фазы 1 в фазу 2 при постоянных T и p (процесс изотермо-изобарический) L=H2-Н1 и V=V2-Vl, где Н2, Hl, V2 и Vl - молярные энтальпии и объемы фаз 1 и 2 соответственно. Производная dp/dT рассчитывается как тангенс угла наклона касательной к кривой сосуществования фаз на фазовой р-Т диаграмме.При рассмотрении испарения и сублимации Клапейрона - Клаузиуса уравнение обычно используют для изучения влияния т-ры на равновесное давление пара над жидкостью или твердым в-вом (определяют dp/dT); обратная величина dT/dp описывает влияние давления на т-ру кипения или сублимации.При рассмотрении плавления и полиморфных превращений производная dT/dp характеризует влияние внеш. давления на т-ру перехода. При плавлении энтальпиясистемы увеличивается (L>0), а объем может как увеличиваться, так и уменьшаться. Чаще всего V>0 и dT/dp>0, т.е. т-ра плавления повышается с ростом давления. В-ва, для к-рых V<0, т.е. плотность жидкости при т-ре плавления больше плотности твердой фазы, немногочисленны (вода, Bi, Ga и др.). Для них dT/dp<0, т. е. при увеличении давления т-ра плавления понижается.
