
- •Основные понятия химии и законы стехиометрии Учебное пособие
- •1. Основные понятия2 химии
- •1.1. Химия и её разделы
- •Разделы химии
- •Уровни организации вещества
- •1.2. Химические элементы и химические соединения
- •1.3. Классификация27 веществ
- •Основные классы неорганических соединений
- •Классы органических соединений
- •1.4. Символы, формулы, уравнения
- •Виды химических формул
- •Алгоритмы составления химических формул
- •Написание химических формул
- •Уравнение химической реакции
- •1.5. Важнейшие величины и единицы в химии
- •2. Стехиометрические законы54
- •2.1. Закон сохранения массы и энергии55
- •Закон сохранения массы
- •Закон сохранения энергии
- •2.2. Закон постоянства состава60
- •2.3. Закон кратных64 отношений
- •2.4. Законы газового состояния
- •2.4.4. Объединённый газовый закон Бойля-Мариотта и Гей-Люссака
- •2.4.5. Закон объёмных отношений
- •2.4.6. Закон Авогадро
- •Следствия из закона Авогадро
- •2.4.7. Закон Дальтóна (закон парциальных давлений)
- •2.5. Закон эквивалентов
- •1.1. Химия и её разделы 3
1.3. Классификация27 веществ
Обзор веществ
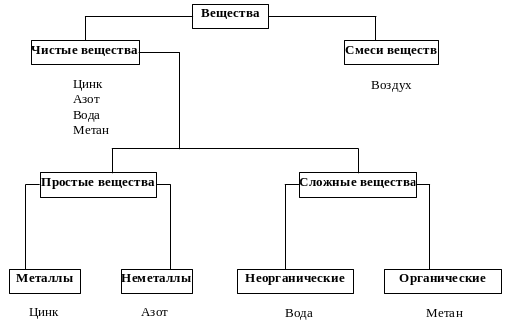
Чистое (индивидуальное) вещество – вещество, состоящее из одинаковых частиц (формульных единиц) (см. с. 26).
Вещество представляет собой однородный вид материи, каждая частица которого имеет одинаковые физические свойства.
Вещества в чистом виде в природе не встречаются.
Природные вещества представляют собой смеси, состоящие иногда из очень большого числа разнообразных веществ.
Смесь веществ – тело, которое состоит из частиц различных веществ.
Например, водный раствор глюкозы состоит из молекул глюкозы и воды; воздух состоит из молекул азота, кислорода и частиц других веществ.
Когда одно из веществ содержится в смеси в преобладающем количестве, то вся смесь обычно носит его название. Например, природную воду, которая содержит растворённые соли, газы и другие вещества, называют просто водой.
Чистое (индивидуальное) вещество всегда однородно, смеси же могут быть однородными или неоднородными.
Однородными называют смеси, в которых ни непосредственно, ни при помощи микроскопа нельзя обнаружить частиц веществ вследствие ничтожно малой их величины. Такими смесями являются смеси газов, многие жидкости, некоторые сплавы.
Неоднородные смеси не всегда удаётся распознать сразу.
Например, кровь кажется однородной жидкостью красного цвета, но при рассматривании её в микроскоп видно, что она состоит из бесцветной жидкости, в которой плавают красные и белые тельца.
Простое, или элементарное вещество, образовано атомами какого-либо одного элемента, и поэтому является формой его существования в свободном состоянии.
Например, гелий He, кислород O2, озон O3, сера S8, железо Fе, графит С, алмаз С, водород Н2, белый фосфор Р4.
Металл28 – простое вещество, характерными свойствами которого являются высокая теплопроводность, высокая электропроводимость, металлический блеск и пластичность (поддаётся обработке посредством прокатки, прессования, ковки, волочения).
Основное отличительное свойство металла – отрицательный температурный коэффициент электрической проводимости.
Сплавы – металлические, макроскопические однородные системы, состоящие из двух или более металлов (реже металлов и неметаллов), с характерными металлическими свойствами. В широком смысле сплавами называют любые однородные системы, получаемые сплавлением металлов, неметаллов, оксидов, органических веществ и т.д.
Сплав – твёрдый раствор металлов: феррохром (Fe–Cr), бронза (Cu–Pb или Sn), латунь (Cu–Zn), мельхиор (Cu–Ni), амальгама29 (Na–Hg), дюраль (дюралюмин) (Al–Сu), силумин (Al–Si).
Классификация металлов
Свойство |
Виды |
|
Плотность |
Лёгкие металлы (ρ < 5 г/см3) Натрий, ρ = 0,97 г/см3 |
Тяжёлые металлы (ρ > 5 г/см3) Железо, ρ = 7,86 г/см3 |
Температура плавления |
Легкоплавкие металлы (tпл. < 1000 °С) Олово, tпл. = 232 °С |
Тугоплавкие металлы (tпл. > 1000 °С) Медь, tпл. = 1083 °С |
Химическая стойкость |
Благородные металлы (не реагируют с разбавленными кислотами) Серебро Ag, золото Au |
Неблагородные металлы (реагируют с разбав-ленными кислотами с выделением водорода) Цинк Zn, железо Fe |
Технические названия |
Чёрные металлы (Чугун, сталь) |
Цветные металлы [Медь Cu, олово Sn, латунь (Cu–Sn)]. |
Неметалл – простое вещество, которое не проявляет свойства, являющиеся характерными для металлов.
Водород H2, азот N2, кислород O2, хлор Cl2, фосфор P, сера S.
Неметаллы по большей части имеют плохую теплопроводность и слабую электропроводимость.
Амфиген30 – простое вещество, которое по своим свойствам занимает промежуточное положение между металлами и неметаллами; иногда образует металлические и неметаллические модификации.
Германий Ge, мышьяк As, сурьма Sb.
Сложные вещества (или химические соединения) образованы атомами разных элементов и могут иметь состав постоянный (стехиометрические соединения, или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения, или бертоллиды31).
Хлорид водорода HCl, оксид водорода (вода) H2O, гидроксид алюминия Al(OН)3, метанол СН3ОН.
Диоксид углерода (углекислый газ) состоит из молекул СО2.
Хлорид натрия NaCl состоит из формульных единиц, которые образованы катионом натрия и анионом хлора.
Соединение первого порядка – соединение из атомов двух или более элементов, которое образуется по правилам стехиометрической валентности32.
Например, хлор Cl2, хлорид натрия NaCl, оксид натрия Na2O, пероксид натрия Na2O2, гидроксид натрия NaOH, метан СН4.
Соединение второго порядка – соединение, которое возникает в результате взаимодействия соединений первого порядка.
Например: двойные соли – K2SO4∙Al2(SO4)3, двойные оксиды – FeO∙Fe2O3 (Fe3O4), гидраты – H2SO4 ∙ nH2O (n = 1–3), кристаллогидраты – CuSO4∙5H2O, комплексные соединения – [Ag(NH3)2]OH.
Комплексное соединение – соединение второго порядка, в котором определённая группировка может рассматриваться в качестве единого целого.
Соединение с комплексным катионом:
[Cu(NH3)4](OH)2 – гидроксид тетраамминмеди(II).
Нейтральный комплекс:
[Pt(NH3)2Cl2] дихлородиамминплатина(II).
Соединение с комплексным анионом:
K3[Fe(CN)6] – гексацианоферрат(III) калия (турнбулева синь).
K4[Fe(CN)6] – гексацианоферрат(II) калия (берлинская лазурь).
