
- •2.5 Седиментация.
- •2.6 Коагуляция и коагуляторы.
- •3. Электрокинетические и оптические свойства коллоидных систем.
- •Структура темы:
- •Понятия об окислительно-восстановительных процессах.
- •Классификация окислительно-восстановительных процессов.
- •Зависимость окислительно-восстановительных свойств веществ в зависимости от положения атомов элементов в периодической системе д.И.Менделеева.
- •Важнейшие восстановители и окислители:
Окончание лекции
Стойкость коллоидных систем объясняется взаимодействием межмолекулярных сил притягивания и сил электростатического отталкивания. Поэтому важным фактором устойчивости коллоидов есть наличие электрического заряда гранулы и сольватных (гидратных) оболочек из ионов диффузного слоя. Последние препятствуют приближению ионов диффузного слоя с гранулой. И чем толще диффузный слой, тем более устойчивые коллоиды, и меньше вероятность слипания коллоидных частиц в большие агрегаты - коагуляция, и осаждение коллоидного вещества в осадок - седиментация.
2.5 Седиментация.
Частицы дисперсной фазы одновременно испытывают действие силы земного притяжения и архимедовои силы; в зависимости от соотношения плотностей дисперсионной среды и дисперсной фазы равнодеиствующая этих сил будет вынуждать частицы к оседанию либо всплытию. Процесс оседания либо всплытия коллоидных частиц в зале называется седиметацией. Однако седиментации всегда противодействует другой процесс, стремящиися к равномерному распределению коллоидных частиц по всему объему раствора — дпффузия осуществляемая под действием броуновского движения частиц. Соотношение между этими двумя процессами определяет кинетическую устойчивость золей (9.9).
Седиментация(9.10) – оседание или всплывание частиц под действием силы тяжести или центробежной силы с образованием осадка или сливок. |
2.6 Коагуляция и коагуляторы.
Коагуляция – явление слипания частиц дисперсной фазы в дисперсной системе под влиянием внешних или внутренних сил, в результате чего дисперсная система разделяется на две непрерывные фазы.
Коагуляция (9.11) - явление слипания частиц дисперсной фазы в дисперсной системе под влиянием внешних или внутренних сил, в результате чего дисперсная система разделяется на две непрерывные фазы. |
Коагуляция может происходить при нагревании, замораживании, интенсивном перемешивании, пропускании электрического тока, добавлении электролитов. В любом случае коагуляция связана с нарушением стабилизирующего двойного электрического слоя или адсорбционно сольватного слоя.
Коагулятор - вещество, которое вызывает процесс коагуляции. Наиболее часто электролит.
Коагулятор (9.12) - вещество, которое вызывает процесс коагуляции. |
При прибавление электролита ионы электролита десольватируют ионы диффузного слоя и помогают перейти им в адсорбционный слой. При прибавлении маленького количества электролита слипание частичек происходит незаметно для невооруженного глаза. Начальная стадия коагуляции называется скрытой коагуляцией.
Увеличение концентрации электролита ведет к дальнейшему развитию коагуляции, повышению ее скорости, появлению более крупных частиц. При этом золь становится мутным. Эта ступень называется явной коагуляцией.
И наименьшее количество электролита, который вызовет начало явной (заметной) коагуляции называется порогом коагуляции золя.
Порог коагуляции золя (9.13) - наименьшее количество электролита, который вызовет начало явной (заметной) коагуляции. |
У золей порог коагуляции обычно маленький и определяется в единицах миллимолей электролита (коагулятора(9.12)) на литр золя.
Величина обратная порогу коагуляции называется коагулирующей способностью электролитов (ионов).
Коагулирующая способность (9.14) - величина обратная порогу коагуляции. |
Коагуляцию вызовет главным образом, один из ионов добавленного электролита - ион противоположный по знаку потенциалопределяющим ионам.
Запомните!!! Чем больше заряд коагулирующего иона, тем сильнее проявляется его коагулирующая способность (9.14) и ниже порог коагуляции (9.13) (правило Шульце-Гарди).
Например, для отрицательно заряженного золя As2S3 коагулирующие способности относятся:

 :
: :
:
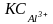 = 1:64 : 729
= 1:64 : 729
Коагуляцию можно вызвать и если к одному золю прибавить другой с противоположным зарядом. Происходит взаимная коагуляция и выпадают в осадок оба золя.
Так, при очищении питьевой воды от зависших высокодисперсных частичек песка, глины и др. (отрицательно заряженные золи) прибавляют небольшое количество Al2(SO4)3, что при гидролизе дает положительный золь
{ [mAl(OH)3] * 2nAl3+(3n - x)SO42-}х+ xSO42-
Происходит взаимная коагуляция (9.11).
Стойкость коллоидного раствора можно повысить, если прибавить к нему небольшое количество раствора высокомолекулярного вещества. Это явление называется коллоидной защитой. Его суть сводится к образованию вокруг коллоидной частицы адсорбционной оболочки из высокомолекулярного вещества, которое препятствует слипанию частиц.
