
Сравнение ркэ и Pt
Чешский электрохимик Ярослав Гейровский, открывший метод (1922 г.) и получивший за него Нобелевскую премию (1958 г.), использовал в качестве ИЭ ртутнокапельный электрод (РКЭ). РКЭ представляет собой капилляр, соединенный шлангом с грушей, заполненной ртутью. Под действием силы тяжести ртуть каплями вытекает из капилляра. Скорость вытекания (прокапывания) ртути определяется высотой подвески груши на штативе. Вариант вольтамперометрии с РКЭ носит авторское название - полярография. В полярографии РКЭ является индикаторным электродом (ИЭ), а донная ртуть – электродом сравнения (ЭС). В ходе анализа на электродную пару накладывается поляризующее напряжение, но поляризации повергается только РКЭ, имеющий значительно меньшую поверхность по сравнению с ЭС.
Для РКЭ зависимость Iпр. от концентрации С определяемого вещества в растворе передается уравнением Д. Ильковича:
Id = 607 n C D1/2 m 2/3 t 1/6
РКЭ громоздок, неудобен (например, в полевых условиях) и вреден, вследствие применения ртути, поэтому вместо него чаще используют различные твердые ИЭ из платины, графита и др.
Твердые иэ отличаются от ркэ:
1) компактностью;
2) технологичностью изготовления;
3) безопасностью применения;
4) интервалом поляризации;
5) загрязнением поверхности во время анализа, поэтому между анализами требуется механическая или химическая очистка.
Однако
и донная ртуть в РКЭ тоже требует
периодической очистки. Область поляризации
любого электрода, доступная для изучения
электрохимической реакции, ограничивается
потенциалами электрохимической реакции
с участием компонентов фонового
электролита и материала электрода.
Рабочая область РКЭ ограничена диапазоном
потенциалов от +0,3 до -2,0 В, поскольку при
потенциале больше +0,3 В происходит
анодное растворение ртути. Основным
достоинством твердых электродов, кроме
безопасности, является возможность их
применения в более положительной области
потенциалов (до +1,3 В), чем РКЭ. Поэтому
твердые электроды можно использовать
в качестве анодов до потенциалов меньше
+1,3 В. При более высоких потенциалах
происходит выделение кислорода,
искажающего вольтамперные кривые.
Практическому применению твердых
электродов в качестве катодов мешает
восстановление водорода, которое на
твердых электродах происходит при
значительно меньших потенциалах, чем
на РКЭ.
Например, из кислых растворов на платине
водород выделяется при -0,1 В, на графите
при -0,6 В и на РКЭ при -1,1 В, а из щелочных
при -0,8, -1,4 и -2,0 В, соответственно. Отсюда
следует, что на ртутном электроде
процессу восстановления многих
электроотрицательных ионов не мешает
водород. С другой стороны на платиновом
электроде могут протекать такие реакции,
какие не могут быть проведены на ртути.
Платина обладает высоким положительным
потенциалам, она индифферентна к
большинству окислителей: при использовании
платины в качестве анода она практически
в большинстве случаев анодно не
растворяется. Однако стационарные
твердые электроды не нашли широкого
применения из-за медленности установления
предельного тока, невысокой чувствительности
и других недостатков. Большее применение
имеют вращающиеся и вибрирующие
платиновые микроэлектроды, у которых
предельный ток устанавливается быстро
за счет непрерывного перемешивания
раствора. Благодаря этому ионы к
поверхности электрода доставляются не
только за счет диффузии, но и перемешивания.
Это в 10-20 раз увеличивает предельный
ток по сравнению с диффузионным.
Для твердых вращающихся электродов предельный диффузионный ток рассчитывают по уравнению:
Iпр.диф= 0,62zSFD2/3γ1/6ω1/2C
где z – число электронов; S – площадь поверхности электрода; F – число Фарадея; D – коэффициент диффузии; ω - скорость вращения электрода; γ - вязкость раствора; С – концентрация.
КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ АНАЛИЗ
Качественный анализ
Качественными характеристиками определяемых веществ в вольтамперометрии является потенциал полуволны (условия стационарной диффузии) и потенциал максимума тока (условия нестационарной диффузии). Эти величины обусловлены природой веществ, подвергающихся электропревращению в условиях анализа. Определив эти величины, можно судить о составе исследуемого раствора.
Зависимость между приложенным напряжением и силой тока в любой точке волны описывается уравнением Гейровского-Ильковича:
где E и I соответственно
потенциал и сила тока в любой точке
волны;![]()
n - число электронов;
Id - предельный диффузионный ток;
E1/2 - потенциал полуволны.
Потенциал полуволны не зависит от величины диффузионного тока и является качественной характеристикой иона. Если в растворе присутствует несколько ионов, потенциалы полуволн которых различаются более чем на 100 мВ, то на полярограмме наблюдается несколько волн.
Величина потенциала полуволны обычно отличается от нормального окислительно-восстановительному потенциала вследствие:
-
кинетической поляризации электрода;
-
влияния адсорбционных явлений;
-
влияния реакций комплексообразования и осаждения.
Определение E1/2 описано выше на странице 6.
Качественный анализ методом инверсионной вольтамперометрии
Природу
деполяризатора отражает потенциал пика
его окисления (восстановления), таким
образом, зная потенциалы пиков веществ
в данных условиях можно идентифицировать
качественный состав анализируемого
объекта. Метод инверсионной вольтамперометрии
пригоден для определения нескольких
веществ при совместном присутствии. В
этом случае электролиз ведут при
потенциале предельного тока наиболее
трудно восстанавливающегося вещества.
При правильном выборе фонового электролита
на инверсионной вольтамперограмме
можно наблюдать раздельные пики
компонентов смеси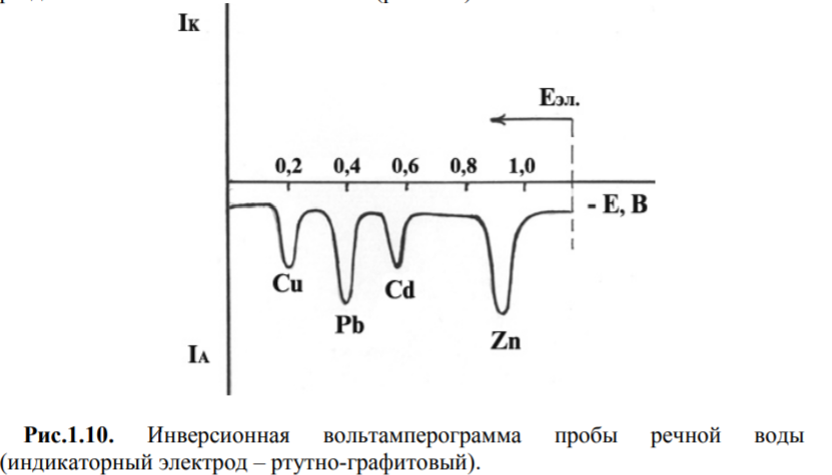
Количественный анализ.
Основан на уравнении Ильковича (для ртутной капли), мкА:
Iд 706nC D1/ 2 m2/3 1/6 , где С – концентрация, моль/л; D1/ 2 – коэффициент диффузии, см2 /с; m2/ 3 – масса ртутной капли, г; 1/ 6 – время жизни одной капли, с.
Количественный анализ основан на прямой зависимости диффузионного тока I (или высоты волны h) от концентрации анализируемого вещества:
I = k ∙ c , где k – постоянная, зависящая от природы электрода и определяемого вещества; c – концентрация исследуемого вещества, моль/ дм3 .
Способы количественного определения концентрации вещества:
1) метод градуировочного графика;
2) метод стандартов;
3) метод добавок.
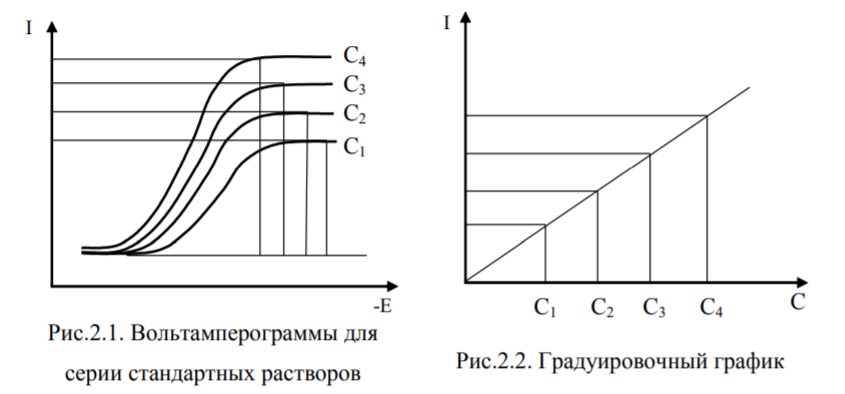
Метод калибровочного графика. Прежде чем приступить к снятию вольтамперограмм раствора с неизвестной концентрацией определяемого вещества, снимают вольтамперограммы ряда растворов с точно известной концентрацией данного вещества. Строят калибровочный график, откладывая по оси ординат высоты пиков эталонных растворов, а по оси абсцисс – соответствующие концентрации. Затем снимают вольтамперограмму исследуемого раствора и, определив высоту пика (при той же чувствительности), находят по графику концентрацию анализируемого вещества. Вольтамперограмма определяемого вещества должна быть снята в тех же условиях, что и вольтамперограммы эталонных растворов. Состав эталонных растворов должен быть по возможности близок к составу анализируемого раствора.
Метод
стандарта. Метод стандарта отличается
от метода калибровочного графика тем,
что здесь готовят только один эталонный
раствор, снимают его вольтамперограмму
и вольтамперограмму анализируемого
раствора и рассчитывают концентрацию
определяемого вещества по формуле,
приведенной ниже. В отличие от условий,
принятых в методе калибровочных кривых,
в этом случае эталонный раствор готовят
каждый раз. Применение метода стандарта
возможно лишь тогда, когда строго
соблюдается пропорциональность между
диффузионным током и концентрацией в
широком диапазоне концентраций. Если
концентрация определяемого иона
приблизительно известна, то готовят
стандартный раствор этого иона более
или менее близкой концентрации, причем
состав и концентрация фона должны быть
такими же как в анализируемом растворе.
Преимущество метода стандарта перед
методом калибровочных кривых в том, что
здесь легче создать одинаковые условия
при съемке вольтамперограмм стандартного
(эталонного) и анализируемого растворов,
так как вольтамперограммы снимают почти
одновременно (друг за другом). Обычно
снимают вольтамперограмму стандартного
раствора, затем при той же чувствительности
- вольтамперограмму анализируемого
раствора. Зная концентрацию стандартного
раствора (Сст) и определив высоту пиков
стандартного (hст) и анализируемого (hх)
растворов, можно рассчитать концентрацию
определяемого вещества по формуле:
![]()
Метод добавок. Сначала снимают вольтамперограмму анализируемого раствора, затем в этот же электролизер добавляют стандартный раствор определяемого иона с точно известной концентрацией с таким расчетом, чтобы пик вырос примерно вдвое. Снимают вольтамперограмму в тех же условиях и делают расчет по формулам:
где
hобщ – суммарная высота пика
определяемого вещества в анализируемом
и добавляемом растворах, СЭ - концентрация
стандартного раствора добавляемого
иона, возникающая в электролизере.
Концентрацию определяемого иона,
введенного в электролизер в виде
стандартного раствора, вычисляют по
формуле:
![]() где
Vст – объем стандартного раствора,
добавленного в электролизер, Vх - объем
анализируемого раствора в электролизере,
Сст – первоначальная концентрация
стандартного раствора. Суммарная формула
для расчета неизвестной концентрации
имеет вид:
где
Vст – объем стандартного раствора,
добавленного в электролизер, Vх - объем
анализируемого раствора в электролизере,
Сст – первоначальная концентрация
стандартного раствора. Суммарная формула
для расчета неизвестной концентрации
имеет вид:
![]() Преимущество
метода добавок перед методом стандарта
и методом калибровочных кривых в том,
что он позволяет наиболее полно учесть
влияние примесей при анализе реальных
объектов.
Преимущество
метода добавок перед методом стандарта
и методом калибровочных кривых в том,
что он позволяет наиболее полно учесть
влияние примесей при анализе реальных
объектов. 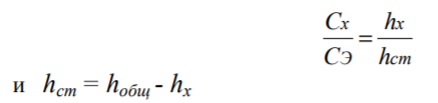
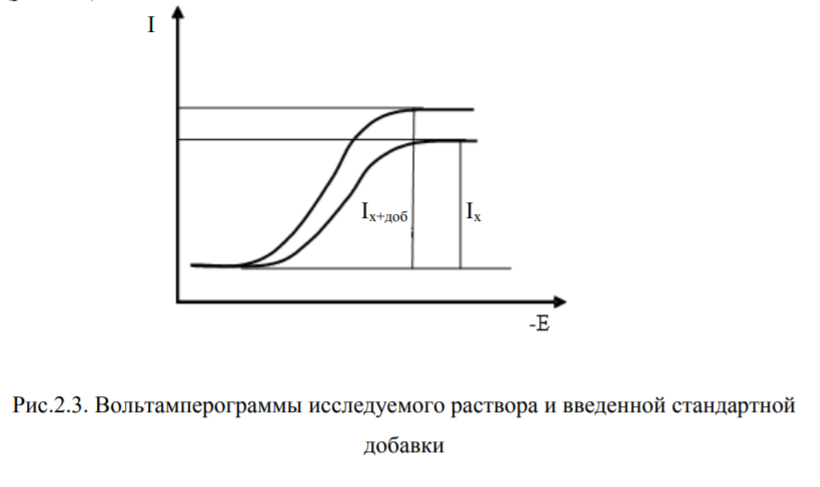
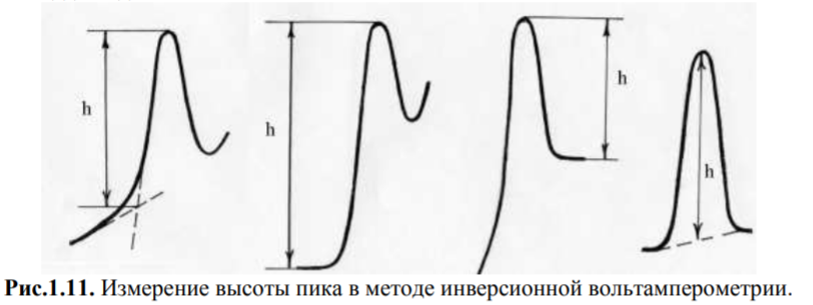
Способы измерения высоты пика. Большинство зависимостей в инверсионной вольтамперометрии регистрируются в форме пиков. Измерение высоты пика можно проводить любым из способов, изображенных на рис. 1.11, однако в каждой серии опытов способ измерения должен быть одним и тем же. Точность способов замера, изображенных на рисунке, очень близка, однако выбор конкретного способа зависит от формы кривой. Поскольку пики при растворении осадка имеют различную форму (они несимметричны) и прямая пропорциональность строго выполняется в основном между количеством вещества на электроде и площадью пика, то расшифровка пика путем измерения его высоты является приближенной. Более точные результаты, особенно в случае искаженных, широких и плоских пиков, дает измерение площади под пиком.

Классификация по способу проведения электрохимических измерений Выделяют прямую и инверсионную вольтамперометрию. Главными отличиями ИВ от прямой вольтамперометрии являются: 1) наличие стадии накопления (электроконцентрирования) определяемого вещества; 2) применение стационарных (обычно твердых) электродов вместо ртутно-капельных.
Классификация по способу представления вольтамперограмм
Выделяют интегральную и дифференциальную вольтамперометрию
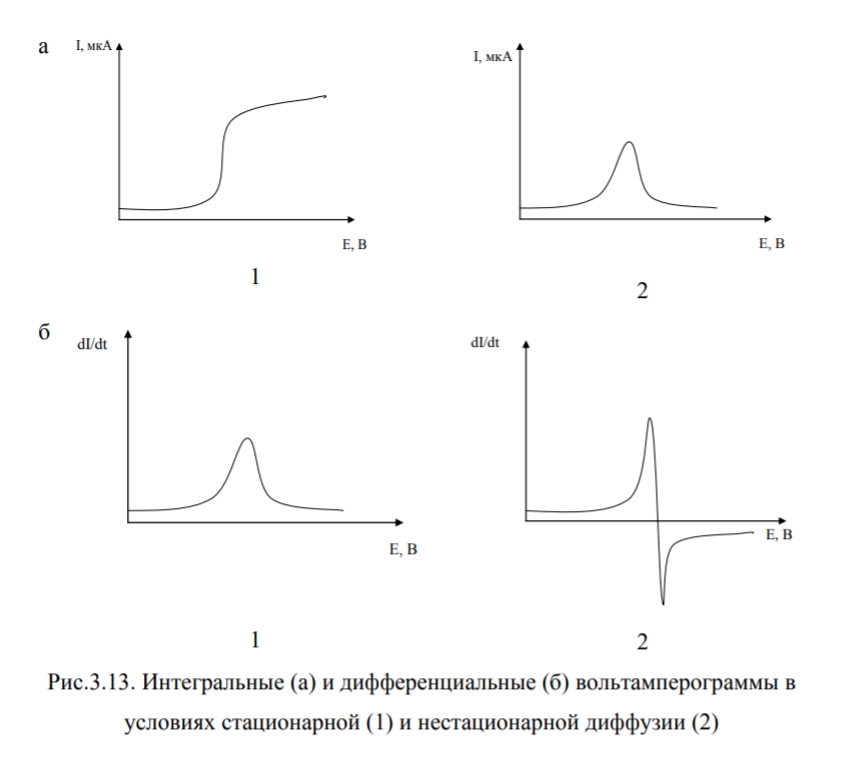
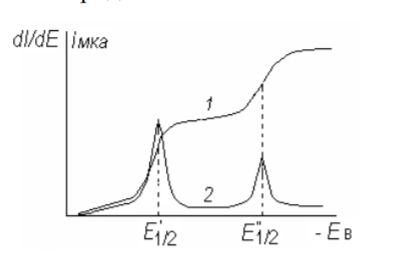
Если в анализируемом растворе присутствует несколько компонентов, дающих электрохимическую реакцию на электроде при потенциалах полуволн, отличающихся менее чем на 150 мВ, то на обычных вольтамперограммах эти волны сливаются. Большего разрешения достигают, используя метод дифференциальной вольтамперометрии, в которой регистрируют производные кривые в координатах dI /dЕ – E. В этом случае наличие двух разряжающихся ионов можно определить, если потенциалы их полуволн отличаются не более чем на 40 мВ. Потенциал, соответствующий максимальному значению dI/dE, является потенциалом полуволны, и на его основе можно определить природу вещества. Высота максимума dI/dE пропорциональна Id, а следовательно, концентрации вещества. При дифференцировании вольтамперограммы также нивелируется мешающее влияние кислорода.
Полярограмма,
записанная в обычной (1) и дифференциальной
(2) форме при восстановлении двух ионов
Амперометрическое титрование является вариантом титриметрического анализа с физико-химическим установлением конечной точки титрования. Оно основано на титровании анализируемого раствора в ячейке при подаче на ее электроды напряжения, отвечающего предельному диффузионному току электроактивного вещества на данном фоне, которое предварительно устанавливают. В качестве интенсивности аналитического сигнала регистрируют при каждом добавлении порции титранта ток восстановления (окисления) определяемого вещества или титранта (в зависимости от того, какое из веществ является электроактивным). В результате химической реакции (окислительно-восстановительной, комплексообразования или осаждения) в титруемом растворе меняется концентрация электроактивного вещества, а значит и величина предельного диффузионного тока. Построенная по результатам титрования кривая зависимости предельного диффузионного тока от объема титранта позволяет установить значение эквивалентного объема титранта, а по нему рассчитать содержание определяемого вещества в анализируемом растворе.
Таким образом, амперометрическое титрование более универсально, чем прямая вольтамперометрия, так как определяемое вещество не обязательно должно быть электроактивным. Стремление повысить чувствительность метода вольтамперометрии привело к созданию так называемой инверсионной вольтамперометрии (ИВА).
