
Ионное произведение воды Вода - очень слабый электролит:
Н2О + Н2О Н3О+ + ОН (самоионизация) Н2О Н+ + ОН H0298дисс=55,9 кДж;
S0298дисс =-80,48 Дж/К
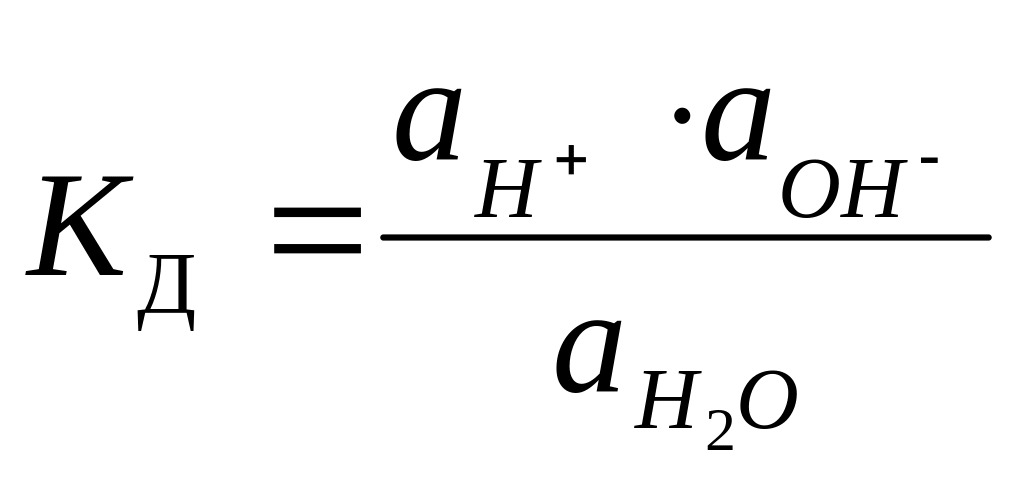 =1,810-16
при
25оС
=1,810-16
при
25оС
ɑН2О = const = 1000/18 ≈ 55,5моль/л Кд • ɑН2О = const= Кw (при T= const)
Ионное
произведение Н2О:
![]() ;
;
![]() (*)
Kw
398
= 6,210-13
Кw
растет
с ростом температуры,
т.к. H0диссН2О
>0
(*)
Kw
398
= 6,210-13
Кw
растет
с ростом температуры,
т.к. H0диссН2О
>0
Расчет Кw из термодинамических данных: ∆Goдис = H0298дисс-ТS0298дисс=-RTlnKw
lnKw=-55900/(8,31.298)-80,48/8,31 = -32,57 Kw=10-14
![]() при
комнатной Т в нейтральной среде
при
комнатной Т в нейтральной среде
Ионы Н+ - носители кислотных свойств, а ОН - основных свойств.
Прологарифмируем: lgKw = lgaH+ + lgaOH- = 14 Н2О: рН=рОН=7
-lgaH+ = рН - водородный показатель; -lgaOH- = рОН - показатель ионов ОН-
логарифмическая форма ионного произведения Н2О: рН + рОН = 14 (298К)
при 298 К Н2О: рН=рОН=7
среда |
сН+,моль/л |
сОН-,моль/л |
рН |
нейтральная сН=сон |
10-7 |
10-7 |
7 |
кислая сНсон |
10-7 |
10-7 |
7 |
щелочная сНсон |
10-7 |
10-7 |
7 |
Индикаторы – вещества изменяющие свою окраску при изменении рН (IndOH – либо HInd)
Метилоранж HInd H+ + Ind-
красный вкислой среде в щелочной среде желтый
Индикатор
|
Область рH |
Окраска |
|
В кислом растворе |
В щелочном
|
||
Пикриновая кислота Метиловый оранжевый Лакмус Феноловый красный Фенолфталеин Ализариновый желтый
|
0,0-2,0 3,1-4,4 6,0-8,0 6,8-8,4 8,2-10,0 10,1-12,1 |
Бесцветная Красная
Красная Бесцветная Бесцветный Желтый |
Желтая
Желтая Синяя Красная Красный Оранжевая |
Современный способ измерения рН – рН-метрия
Расчет рН слабых кислот и оснований
для кислот: аН+ сН+ рН - lg сН+
![]() ;
;
![]()
![]()
рН = -lg
рН = -lg
![]()
для оснований: аОН- сОН- рОН - lg сОН-
![]() рН
=14 + lgсOH-=
14
+ lg
рН
=14 + lgсOH-=
14
+ lg
Расчет рН сильных кислот и оснований
для кислот: Iр-ра = 0,5 (сi z2i )
Н+ (по таблице или формуле) аН+ = Н+ сН+ рН = -lg аН+ = -lg (Н+ сН+)
для оснований: Iр-ра = 0,5 (сi z2i )
OН- (по таблице или формуле) аОН = ОНсОН- рОН = - lg ОН.сОН-
рН = 14 - рОН =14 + lg аОН = 14 + lg (ОН.сОН-)
