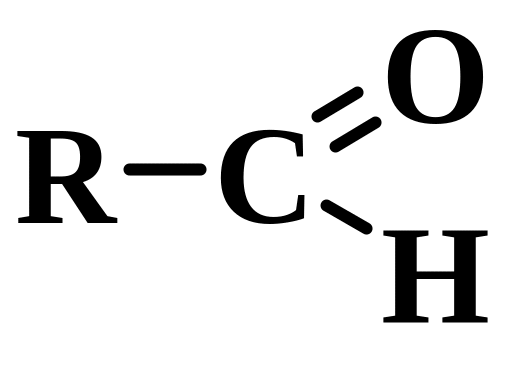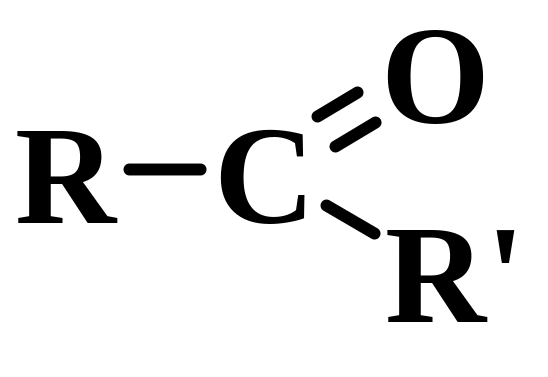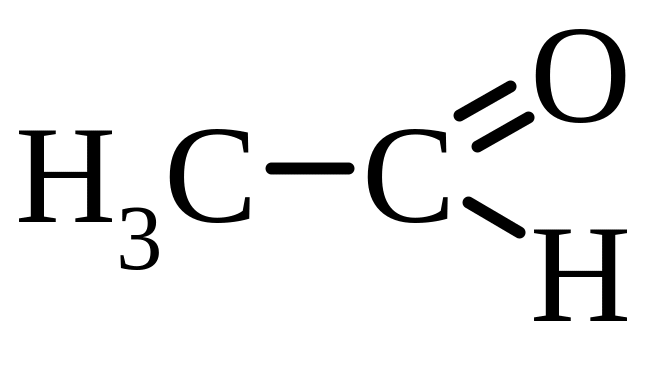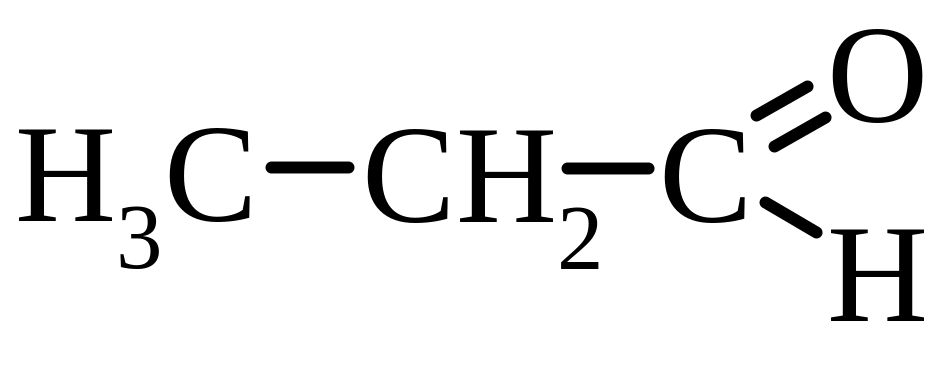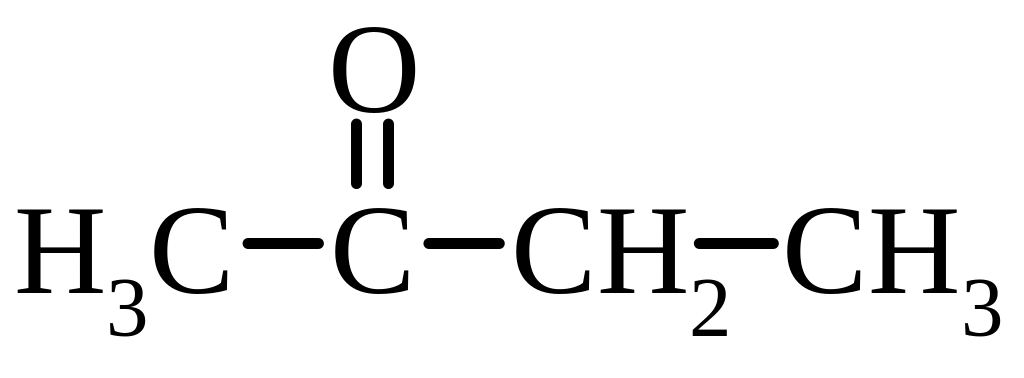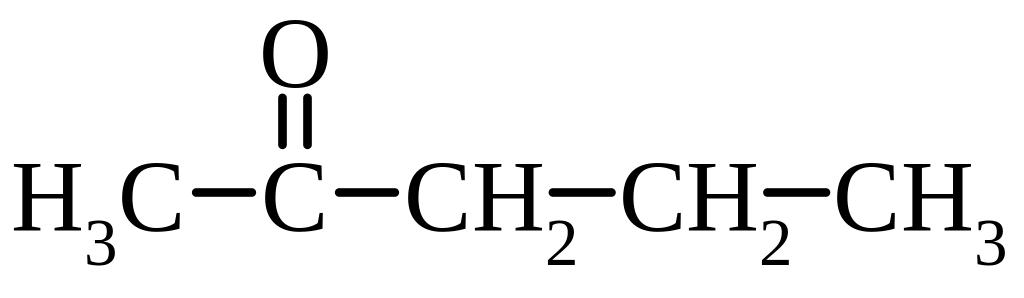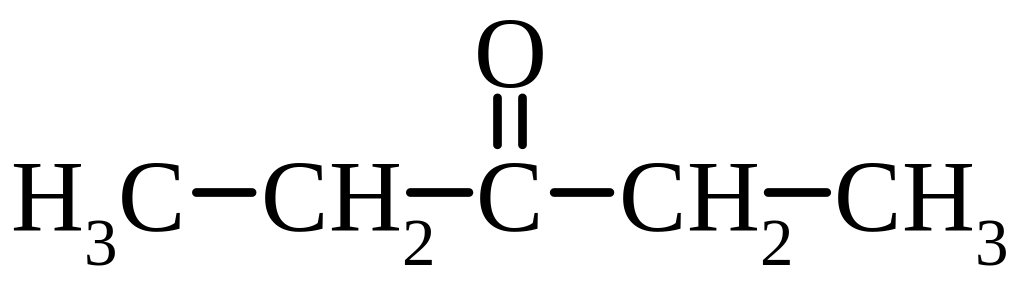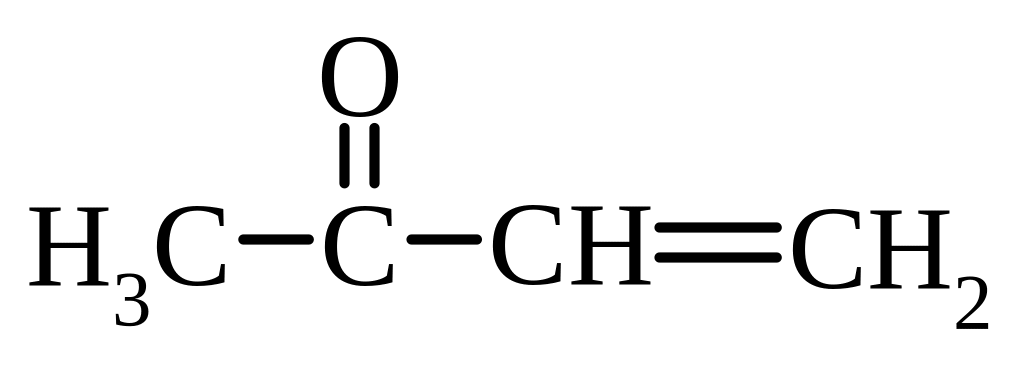- •1. Галогенпохідні вуглеводнів
- •Способи одержання
- •Хімічні властивості
- •Ненасичені галогенопохідні вуглеводнів Класифікація
- •Хлористий вініл
- •1. Одержання хлористого вінілу
- •2. Хімічні властивості хлористого вінілу
- •Хлористий аліл
- •2. Хімічні властивості хлористого алілу
- •Хімічні властивості ароматичних галогеновуглеводнів
- •Реакції галогеналканів та ароматичних галогенопохідних з металами:
- •2. Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи
- •3. Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •Будова спиртів
- •Хімічні властивості спиртів
- •2. Дегідратація
- •Феноли. Хінони
- •Методи одержання фенолів
- •Будова фенолів
- •Хімічні властивості фенолів
- •4. Особливості реакцій електрофільного заміщення
- •Багатоатомні феноли
- •Альдегіди і кетони
- •Класифікація
- •Номенклатура альдегідів та кетонів
- •Способи одержання
- •Хімічні властивості
- •2. Реакції нуклеофільного приєднання
- •Реакції приєднання-відщеплення
- •Б) При нагріванні альдоль відщеплює воду з утворенням ненасиченого альдегіду. Ця реакція має назву кротонової конденсації.
- •6. Окиснення альдегідів і кетонів
- •8. Естерна конденсація (реакція Тіщенко).
- •9. Реакції полімеризації
- •Способи одержання нітросполук Способи одержання аліфатичних нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Будова нітрогрупи
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •2. Ацинітротаутомерія
- •Класифікація
- •2. З кислотами алкіламіни утворюють соли алкіламмонію:
- •7. Реакція окиснення
- •Хімічні властивості ароматичних амінів
- •2. Реація ацилювання
- •Окиснення ароматичних амінів:
- •6.3. Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •7. Карбонові кислоти
- •Назви одноосновних карбонових кислот
- •Методи одержання одноосновних карбонових кислот
- •Хімічні властивості одноосновних карбонових кислот
- •Кислотні властивості
- •Одноосновні ненасичені карбонові кислоти ,-ненасичені кислоти
- •Способи одержання ненасичених карбонових кислот
- •Хімічні властивості ненасичених карбонових кислот
- •1. Реакції приєднання за подвійним зв’язком
- •2. Реакції за карбоксильною групою
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості двохосновних карбонових кислот
- •Ароматичні двохосновні карбонові кислоти
- •Хімічні властивості ароматичних двохосноних карбонових кислот
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Сполуки зі змішаними функціями
- •8.1. Галогенозаміщені кислоти
- •Способи одержання галогенозаміщенних кислот
- •Хімічні властивості галогенозаміщенних кислот
- •1. Кислотні властивості
- •Дисоціація кислот:
- •2. Для галогенозаміщених кислот характерні два типи хімічних перетворень:
- •3. Особливості хімічних властивостей - відношення галогенозаміщених кислот до води при нагріванні.
- •8.2. Амінокислоти
- •Способи одержання амінокислот
- •1. Одержання -амінокислот
- •2. Одержання -амінокислот
- •Хімічні властивості амінокислот
- •1. Реакції за аміногрупою
- •Особливості хімічних властивостей , та -амінокислот Відношення до нагрівання
- •8.3. Гідроксикислоти
- •Способи одержання гідроксикислот
- •Хімічні властивості гідроксикислот
- •1. Реакції за гідроксильною групою (–он).
- •3. Особливості хімічних властивостей
- •Приклади контрольних завдань
- •10. Рекомендована література
Альдегіди і кетони
Альдегіди і кетони – це сполуки, у молекулах яких міститься функціональна група >C=O (карбонільна або оксогрупа). В альдегідах карбонільна група сполучена з карборадикалом і одним атомом Гідрогену, у кетонах вона сполучена з двома карборадикалами:
Класифікація
Загальна формула: |
Альдегіди |
Кетони |
|
|
|
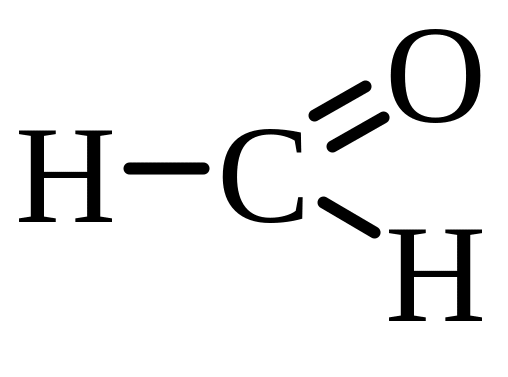
1. Аліфатичні: |
|
|
етаналь (оцтовий) |
пропанон, диметилкетон |
|
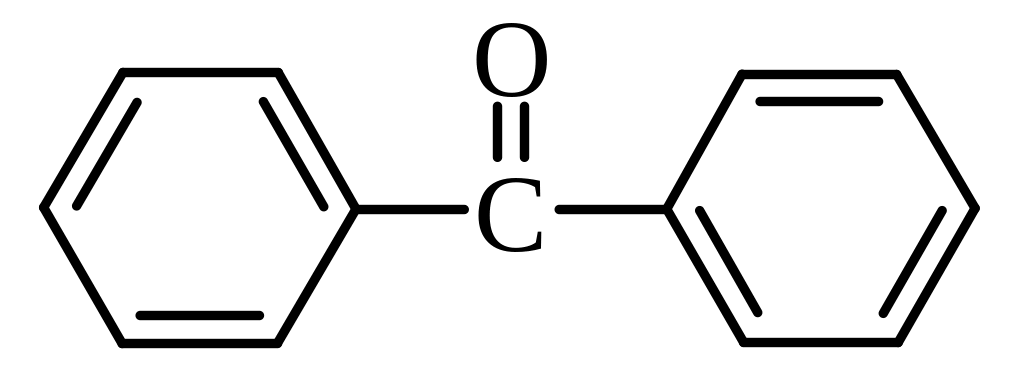
2. Ароматичні: |
|
|
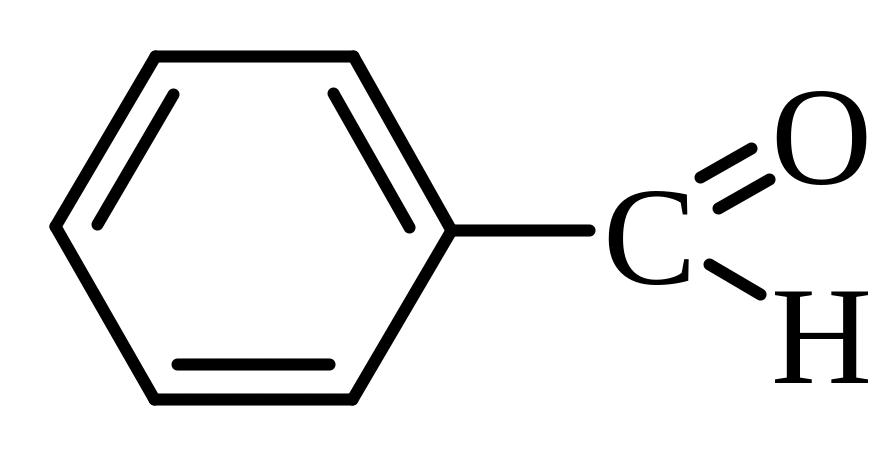
бензойний альдегід |
дифенілкетон, бензофенон |
|
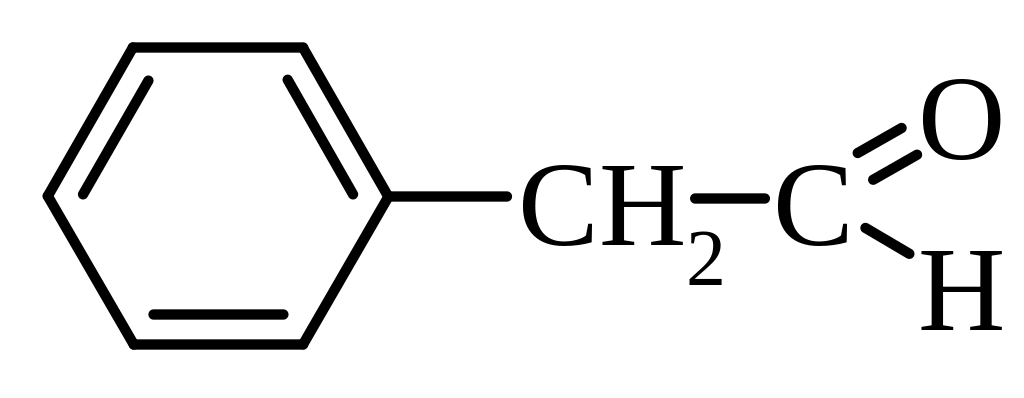
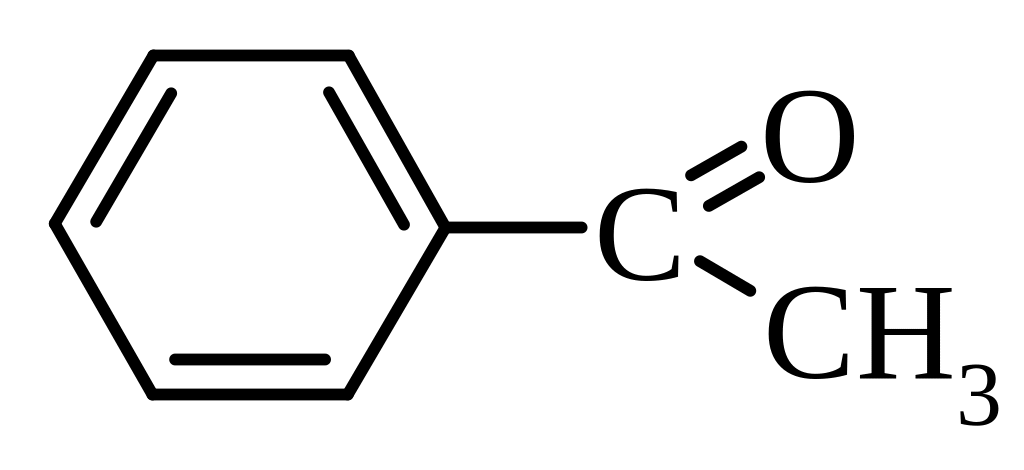
3. Жирно-ароматичні: |
|
|
фенілоцтовий альдегід, фенілетаналь |
метилфенілкетон, ацетофенон |
Номенклатура альдегідів та кетонів
Для альдегідів характерна структурна ізомерія, яка пов’язана з будовою карборадикалу.
Альдегіди |
IUPAC |
раціонально-функціональна (тривіальна) |
|
метаналь |
мурашиний (формальдегід) |
|
етаналь |
оцтовий (ацетальдегід) |
|
попаналь |
пропіоновий |
С4H8 |
|
|
|
бутаналь |
бутиратний (масляний) |
|
2-метилпропаналь |
ізобутиратний (ізомасляний) |
Для кетонів характерна структурна ізомерія, яка пов’язана з будовою карборадикалу та з положенням карбонільної групи (С=О).
Кетони |
IUPAC
|
раціонально-функціональна (тривіальна) |
|
пропанон |
диметилкетон (ацетон) |
|
бутанон |
метилетилкетон |
|
пентанон-2 |
метилпропілкетон |
|
3-метилбутанон-2 |
метилізопропілкетон |
|
3-пентанон |
діетилкетон |
|
3-бутен-2-он |
метилвінілкетон |
Способи одержання
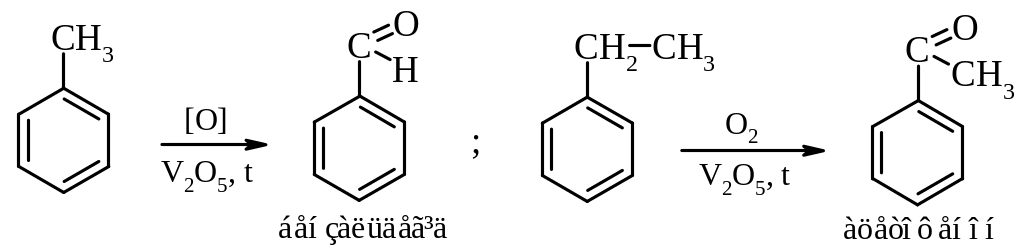
1. Реaкції окиснення
ненасичених вуглеводнів
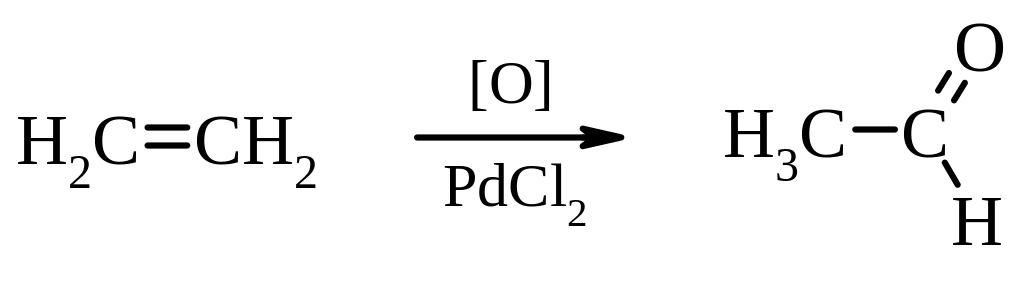
насичених вуглеводнів
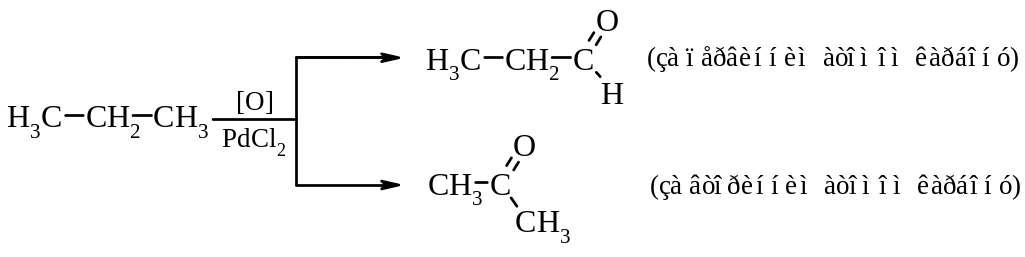
ароматичних вуглеводнів
спиртів
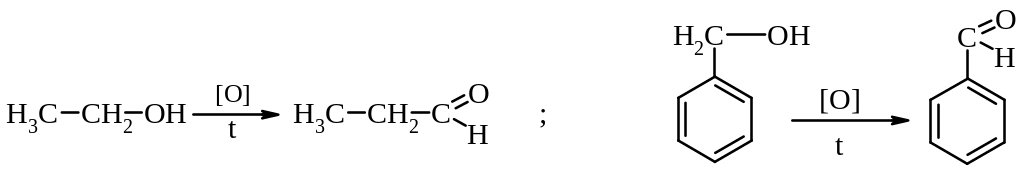
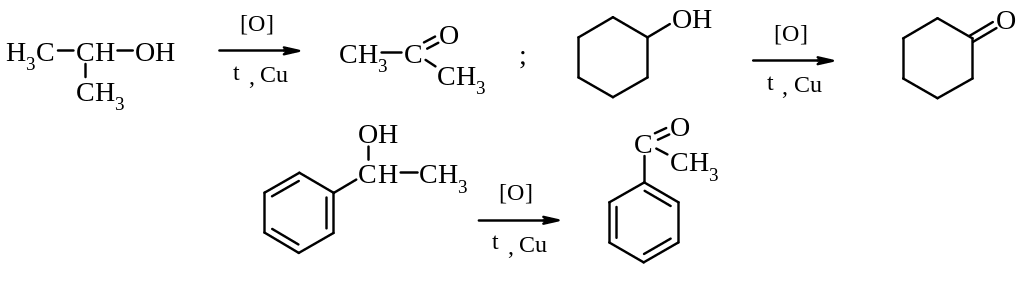 2.
Каталiтичне
дегідрування спиртів
2.
Каталiтичне
дегідрування спиртів
 3.
Гідроліз гемінальних дигалогеналканів
3.
Гідроліз гемінальних дигалогеналканів
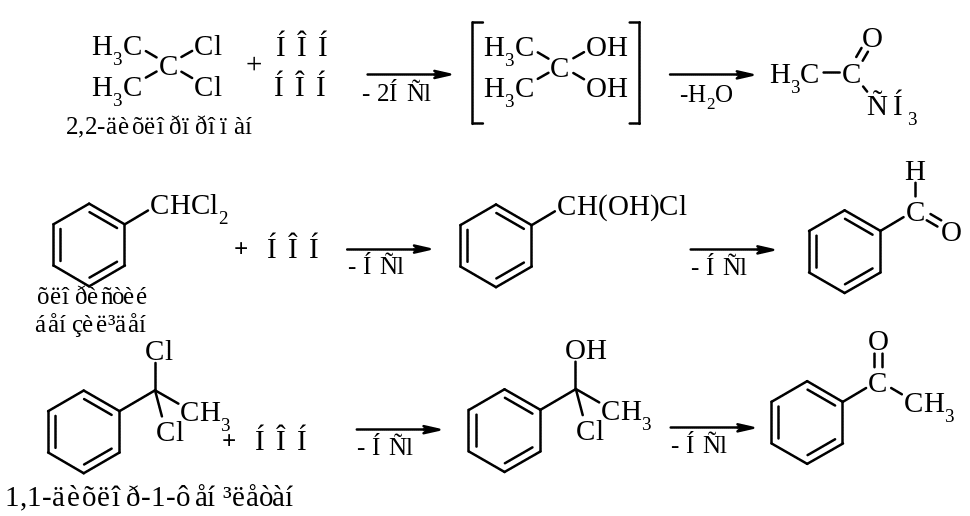
4. Декарбоксилування (піроліз) солей карбонових кислот
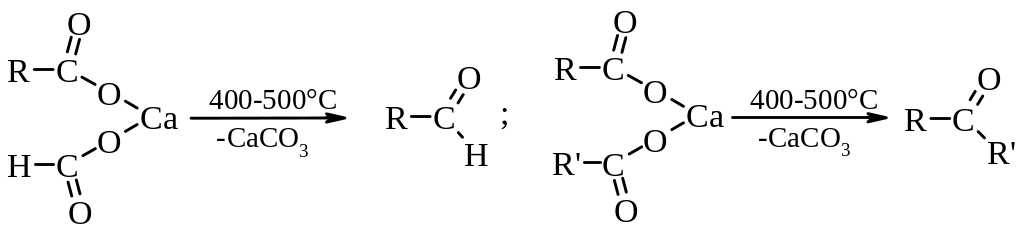
5. Гідратація алкінів (реакція Кучерова)
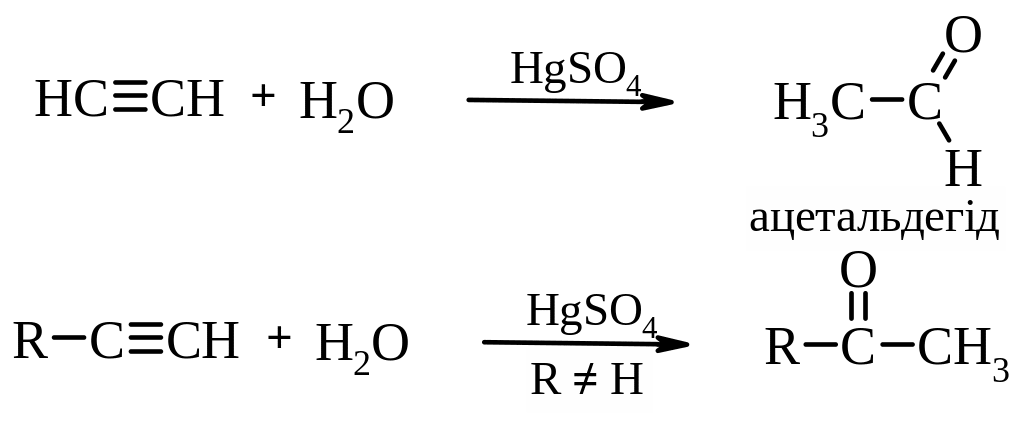
6. В промисловості для одержання аліфатичних альдегідів використовують оксосинтез
7. Окреміі способи одержання ароматичних альдегідів і кетонів
- одержання ароматичних кетонів за реакцією Фріделя-Крафтса:
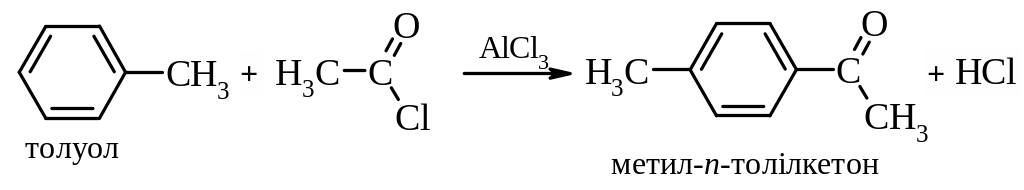
- одержання ароматичних альдегідів за реакцією Гаттермана-Коха:
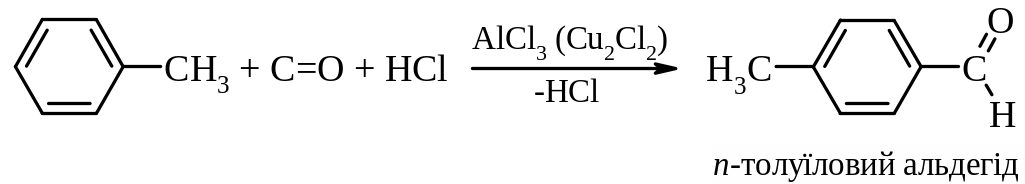
Хімічні властивості
1. Особливості реакцій нуклеофільного приєднання до альдегідів і кетонів
а) Електронні фактори пов'язані з тим, що алкільна група, як донор електронів подає електронну густину на атомі Карбону карбонільної групи, що знижує частково позитивний заряд (δ+) на ньому.
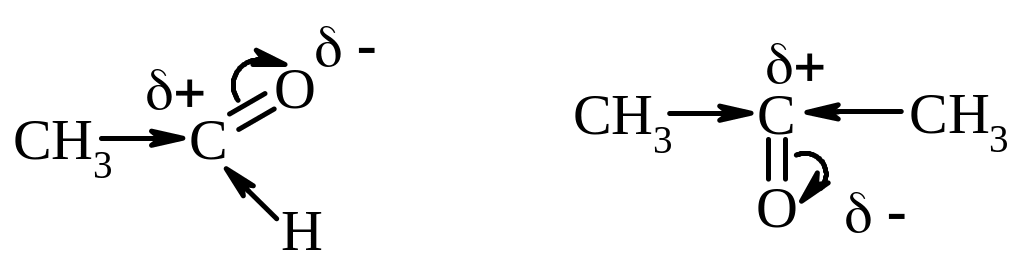
У випадку альдегідів таке зниження δ+ проходить менше, так як тільки одна алкільна група. Для кетону таке зниження δ+ на карбонільному атомі Карбону проходить більше, так як в цьому випадку має місце вплив двох алкільних груп.
б) Просторові фактори. При приєднанні нуклеофілу до карбонільної групи атом Карбону переходить з sp2–гібридного стану до sp3–гібридного стану. Валентні кути змінюються від 120 до 10928'. Тобто проходить зближення замісників зв'язаних з карбонільною групою.
Для альдегідів таке зближення проходить легко, так як один із замісників – це атом Гідрогену. Для кетонів таке зближення проходить трудніше і при наявності особливо об'ємних замісників (наприклад, трет-бутильних) реакційна здатність кетонів знижується настільки, що реакції нуклеофільного приєднання стають неможливими. Тому альдегіди є більш реакційноздатними сполуками ніж кетони.
Здатність альдегідів і кетонів вступати в реакції приєднання, приєднання-відщепленні визначається величиною частково позитивного заряду на атомі карбону карбонільної групи – чим більше δ+ на атомі Карбону тим більшу реакційну здатність мають альдегиди та кетони у вище зазначених реакціях.
Тому, реакційна здатність карбонільних сполук зменшується в такому ряду:
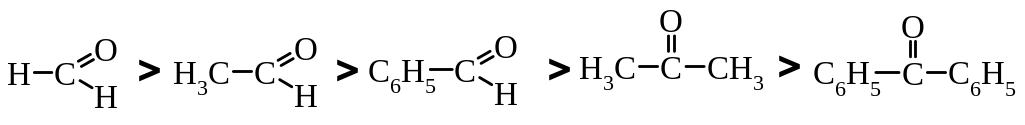
В цілому: а) альдегіди вступають в реакцію легше кетонів; б) аліфатичні сполуки вступають в реакції легше алкілароматичних і тим більше чисто ароматичних.
Ароматичні альдегіди і кетони, які містять в о- і особливо в п-положеннях до карбонільної групи електоноакцепторні замісники мають більш високу реакційну здатність за рахунок збільшення частково позитивного заряду (δ+) на атомі Карбону карбонільної групи і навпаки: введення електронодонорних замісників в тіж положення зменшують реакційну здатність альдегідів і кетонів за рахунок зниження заряду (δ+) на атомі Карбону карбонільної групи.
Головна відзнака альдегідів від кетонів – альдегіди окиснюються дуже легко, особливо ароматичні, а кетони – важко.
Для альдегідів і кетонів характерні реакції нуклеофільного приєднання води, спиртів, синильної кислоти, гідросульфіту натрію, реактиву Гріньяра; реакції з азотовмісними сполуками (амоніаком, гідроксиламіном, гідразином тощо); реакції конденсації (альдольна, кротонова), окиснення.