
- •1. Галогенпохідні вуглеводнів
- •Способи одержання
- •Хімічні властивості
- •Ненасичені галогенопохідні вуглеводнів Класифікація
- •Хлористий вініл
- •1. Одержання хлористого вінілу
- •2. Хімічні властивості хлористого вінілу
- •Хлористий аліл
- •2. Хімічні властивості хлористого алілу
- •Хімічні властивості ароматичних галогеновуглеводнів
- •Реакції галогеналканів та ароматичних галогенопохідних з металами:
- •2. Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи
- •3. Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •Будова спиртів
- •Хімічні властивості спиртів
- •2. Дегідратація
- •Феноли. Хінони
- •Методи одержання фенолів
- •Будова фенолів
- •Хімічні властивості фенолів
- •4. Особливості реакцій електрофільного заміщення
- •Багатоатомні феноли
- •Альдегіди і кетони
- •Класифікація
- •Номенклатура альдегідів та кетонів
- •Способи одержання
- •Хімічні властивості
- •2. Реакції нуклеофільного приєднання
- •Реакції приєднання-відщеплення
- •Б) При нагріванні альдоль відщеплює воду з утворенням ненасиченого альдегіду. Ця реакція має назву кротонової конденсації.
- •6. Окиснення альдегідів і кетонів
- •8. Естерна конденсація (реакція Тіщенко).
- •9. Реакції полімеризації
- •Способи одержання нітросполук Способи одержання аліфатичних нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Будова нітрогрупи
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •2. Ацинітротаутомерія
- •Класифікація
- •2. З кислотами алкіламіни утворюють соли алкіламмонію:
- •7. Реакція окиснення
- •Хімічні властивості ароматичних амінів
- •2. Реація ацилювання
- •Окиснення ароматичних амінів:
- •6.3. Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •7. Карбонові кислоти
- •Назви одноосновних карбонових кислот
- •Методи одержання одноосновних карбонових кислот
- •Хімічні властивості одноосновних карбонових кислот
- •Кислотні властивості
- •Одноосновні ненасичені карбонові кислоти ,-ненасичені кислоти
- •Способи одержання ненасичених карбонових кислот
- •Хімічні властивості ненасичених карбонових кислот
- •1. Реакції приєднання за подвійним зв’язком
- •2. Реакції за карбоксильною групою
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості двохосновних карбонових кислот
- •Ароматичні двохосновні карбонові кислоти
- •Хімічні властивості ароматичних двохосноних карбонових кислот
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Сполуки зі змішаними функціями
- •8.1. Галогенозаміщені кислоти
- •Способи одержання галогенозаміщенних кислот
- •Хімічні властивості галогенозаміщенних кислот
- •1. Кислотні властивості
- •Дисоціація кислот:
- •2. Для галогенозаміщених кислот характерні два типи хімічних перетворень:
- •3. Особливості хімічних властивостей - відношення галогенозаміщених кислот до води при нагріванні.
- •8.2. Амінокислоти
- •Способи одержання амінокислот
- •1. Одержання -амінокислот
- •2. Одержання -амінокислот
- •Хімічні властивості амінокислот
- •1. Реакції за аміногрупою
- •Особливості хімічних властивостей , та -амінокислот Відношення до нагрівання
- •8.3. Гідроксикислоти
- •Способи одержання гідроксикислот
- •Хімічні властивості гідроксикислот
- •1. Реакції за гідроксильною групою (–он).
- •3. Особливості хімічних властивостей
- •Приклади контрольних завдань
- •10. Рекомендована література
Хімічні властивості ароматичних галогеновуглеводнів
Галогеновуглеводні, які містять атом галогену, безпосередньо зв’язаний з бензеновим кільцем, характеризуються низькою реакційною здатністю зв’язку С–Hal. Атом галогену в цих сполуках малорухливий і заміщується дуже важко. Це зумовлено взаємодією неподіленої пари електронів атому галогену з π‑електронною системою бензенового кільця (p,π-коньюгація) і як наслідок зміцнення зв’язку С–Hal.
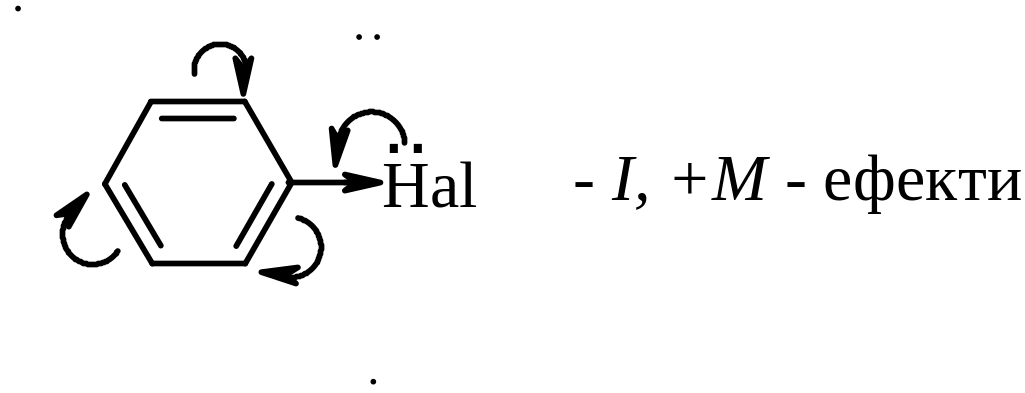
Тому нуклеофільне заміщення атому галогену в галогенаренах відбувається лише за дуже жорстких умов:
До неактивованих арилгалогенідів відносять арилгалогеніди, які не мають замісників в бензеновому ядрі, які мають електронодонорні замісники (замісники І роду), а також частково арилгалогеніди, які мають електроноакцепторні замісники, які знаходяться в м-положеннях відносно до атома галогену.
Активність атома галогену в арилгалогенідах підвищується під впливом електроноакцепторних груп, таких як –NO2; –NO; -SO3H; –CN; -СООН тощо, якщо вони знаходяться в о- або п-положеннях відносно атома галогену. Такі сполуки називають активованими галогенаренами. Підвищення реакційної здатності зв’язку С–Hal в активованих гелогенаренах пов’язане зі збільшенням частково позитивного заряду на атомі Карбону під дією електроноакцепторного замісника.
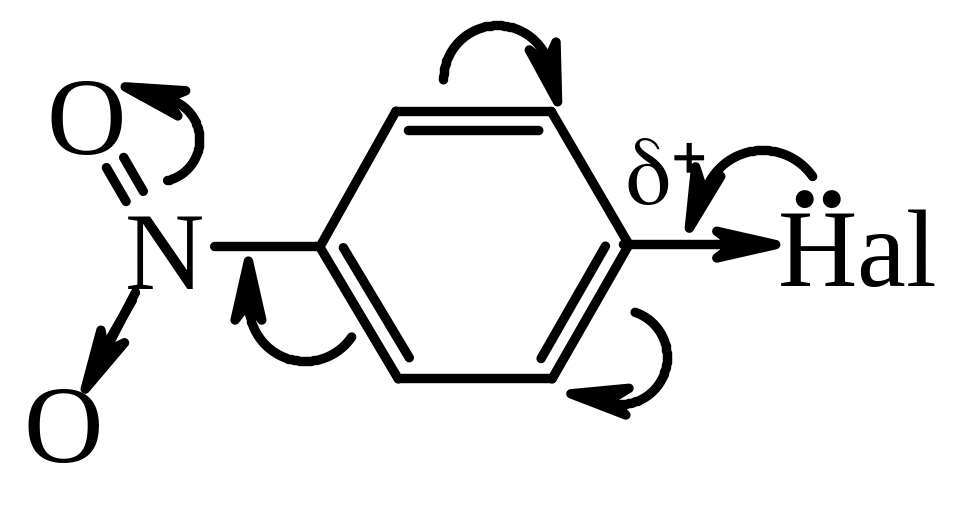
Заміщення відбувається за механізмом SN2Аr через утворення негативно зарядженого σ-комплексу, який стабілізований внаслідок делокалізації негативного заряду електроноакцепторною нітро-групою:
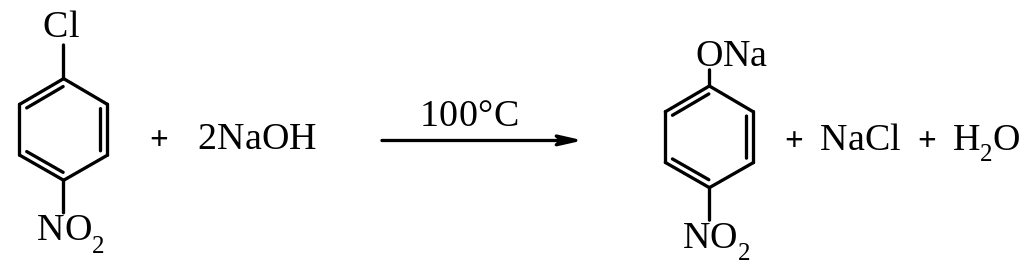
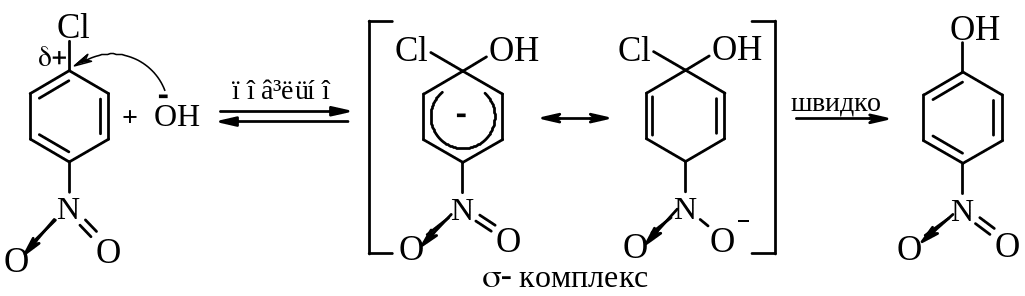 Проміжний
негативно заряджений σ-комплекс
стабілізується за рахунок ефективного
спряження. Саме утворення енергетично
вигідного σ-комплексу під впливом
сильного електроноакцепторного замісника
є вирішальним фактором здійснення
реакції за механізмом SN2Ar.
Проміжний
негативно заряджений σ-комплекс
стабілізується за рахунок ефективного
спряження. Саме утворення енергетично
вигідного σ-комплексу під впливом
сильного електроноакцепторного замісника
є вирішальним фактором здійснення
реакції за механізмом SN2Ar.
Для реакцій SNAr швидкість реакції зростає із зростанням електронегативності атому галогену, тобто зростає позитивний заряд на атомі Карбону, який несе атом галогену. У випадку м-нітрохлорбензену нітрогрупа не бере участі в делокалізації негативного заряду σ-комплексу і тому галоген у цих сполуках менш активний.
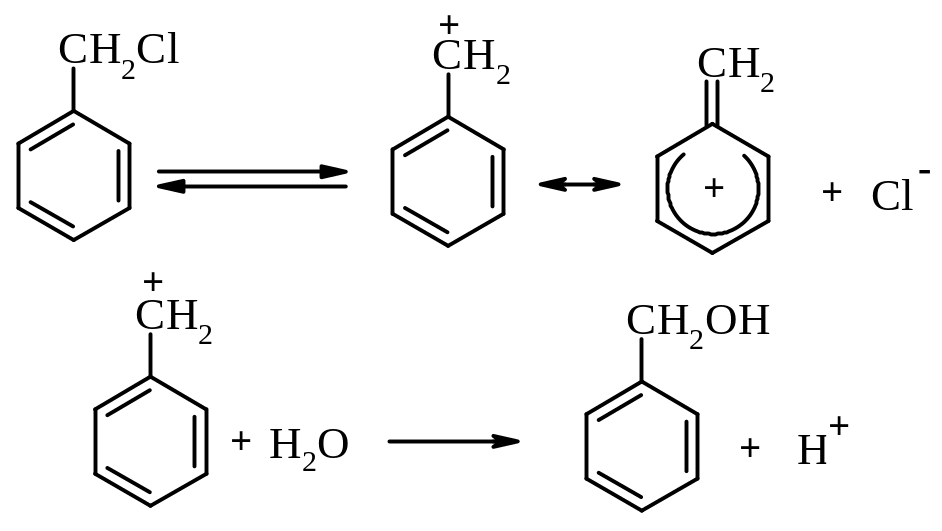
Бензилхлорид дуже легко вступають в реакції нуклеофільного заміщення за механізмом SN1 із-за високої стійкості проміжних карбокатіонів внаслідок ефективної делокалізації позитивного заряду:
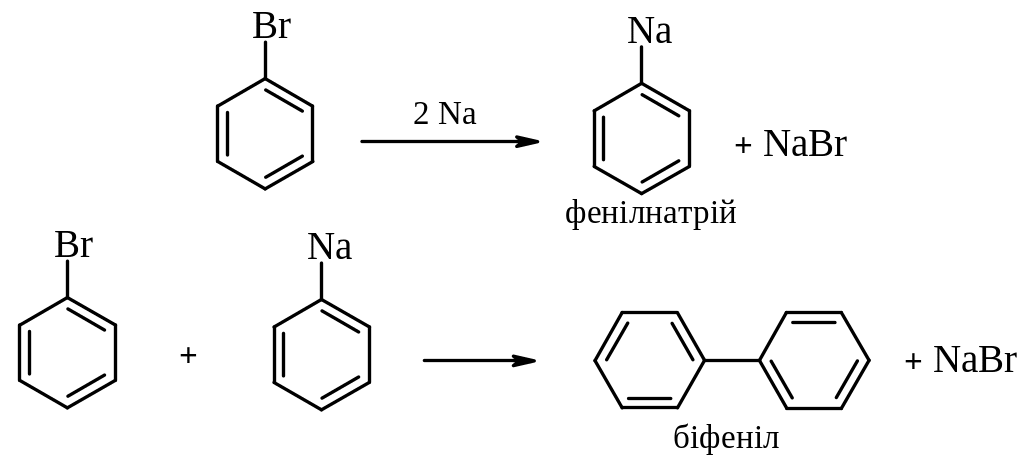
Реакції галогеналканів та ароматичних галогенопохідних з металами:
1. Утворення магнійорганічних сполук (використання для синтезу карбонових кислот:
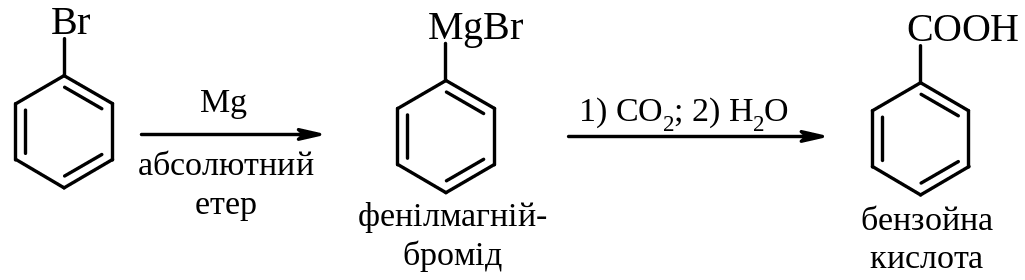
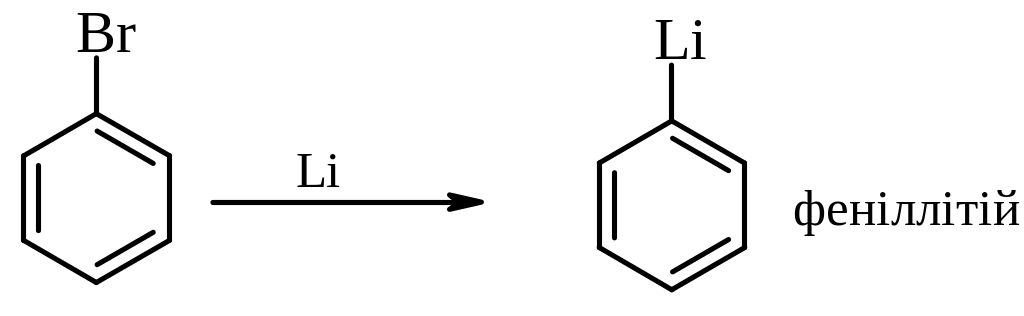
2. Реакції з літієм:
3. Реакції з натрієм:
2. Ароматичні сульфокислоти
Ароматичними сульфокислотами називають сполуки, які містять сульфогрупу SO3H у бензеновому кільці або боковому ланцюзі.
У відповідності до октетної формули сульфогрупа має два ковалентні та два семіполярні зв’язки. Останні утворені за участю тільки електронів атому Сульфуру. Також для сульфокислот може використовуватися формула з шістьма ковалентними зв’язками тому, що атоми Сульфуру мають вільні d‑орбіталі, на яких можуть бути розміщені електрони (з розширенням октету):
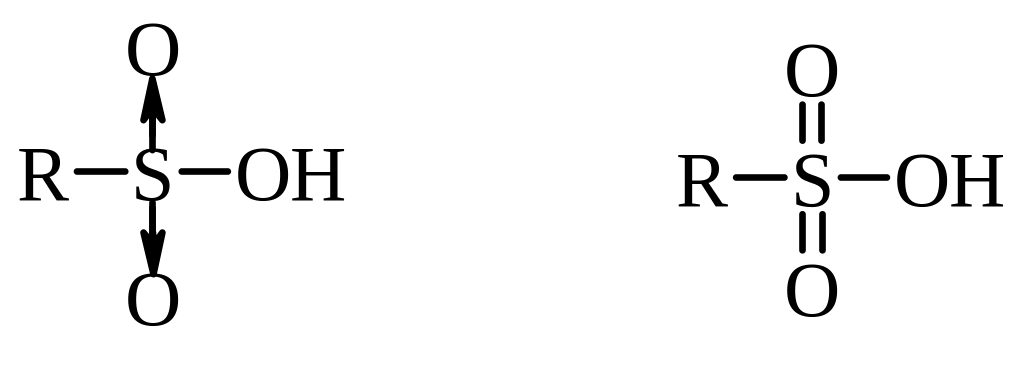
Ароматичні сульфокислоти добувають переважно реакцією сульфування ароматичних сполук сульфуючими реагентами (концентрована H2SO4, олеум: SO3+H2SO4; SO3; піридинсульфотриоксид).
Сульфування – це реакція електрофільного заміщення. При сульфуванні сульфатною кислотою активним електрофільним агентом є перед усім іон H3SO4+, а також H3S2O7+ та інші гідрати SO3, наприклад H3S4O13+:
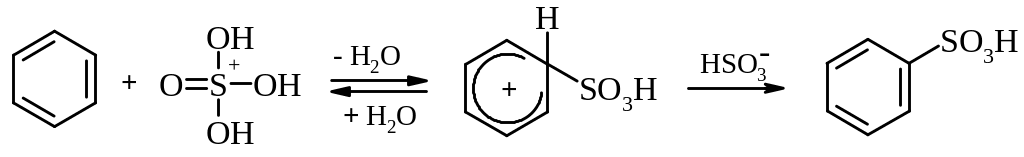
Подібно до сульфатної кислоти сульфокислоти є сильними кислотами.
