
- •1. Галогенпохідні вуглеводнів
- •Способи одержання
- •Хімічні властивості
- •Ненасичені галогенопохідні вуглеводнів Класифікація
- •Хлористий вініл
- •1. Одержання хлористого вінілу
- •2. Хімічні властивості хлористого вінілу
- •Хлористий аліл
- •2. Хімічні властивості хлористого алілу
- •Хімічні властивості ароматичних галогеновуглеводнів
- •Реакції галогеналканів та ароматичних галогенопохідних з металами:
- •2. Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи
- •3. Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •Будова спиртів
- •Хімічні властивості спиртів
- •2. Дегідратація
- •Феноли. Хінони
- •Методи одержання фенолів
- •Будова фенолів
- •Хімічні властивості фенолів
- •4. Особливості реакцій електрофільного заміщення
- •Багатоатомні феноли
- •Альдегіди і кетони
- •Класифікація
- •Номенклатура альдегідів та кетонів
- •Способи одержання
- •Хімічні властивості
- •2. Реакції нуклеофільного приєднання
- •Реакції приєднання-відщеплення
- •Б) При нагріванні альдоль відщеплює воду з утворенням ненасиченого альдегіду. Ця реакція має назву кротонової конденсації.
- •6. Окиснення альдегідів і кетонів
- •8. Естерна конденсація (реакція Тіщенко).
- •9. Реакції полімеризації
- •Способи одержання нітросполук Способи одержання аліфатичних нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Будова нітрогрупи
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •2. Ацинітротаутомерія
- •Класифікація
- •2. З кислотами алкіламіни утворюють соли алкіламмонію:
- •7. Реакція окиснення
- •Хімічні властивості ароматичних амінів
- •2. Реація ацилювання
- •Окиснення ароматичних амінів:
- •6.3. Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •7. Карбонові кислоти
- •Назви одноосновних карбонових кислот
- •Методи одержання одноосновних карбонових кислот
- •Хімічні властивості одноосновних карбонових кислот
- •Кислотні властивості
- •Одноосновні ненасичені карбонові кислоти ,-ненасичені кислоти
- •Способи одержання ненасичених карбонових кислот
- •Хімічні властивості ненасичених карбонових кислот
- •1. Реакції приєднання за подвійним зв’язком
- •2. Реакції за карбоксильною групою
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості двохосновних карбонових кислот
- •Ароматичні двохосновні карбонові кислоти
- •Хімічні властивості ароматичних двохосноних карбонових кислот
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Сполуки зі змішаними функціями
- •8.1. Галогенозаміщені кислоти
- •Способи одержання галогенозаміщенних кислот
- •Хімічні властивості галогенозаміщенних кислот
- •1. Кислотні властивості
- •Дисоціація кислот:
- •2. Для галогенозаміщених кислот характерні два типи хімічних перетворень:
- •3. Особливості хімічних властивостей - відношення галогенозаміщених кислот до води при нагріванні.
- •8.2. Амінокислоти
- •Способи одержання амінокислот
- •1. Одержання -амінокислот
- •2. Одержання -амінокислот
- •Хімічні властивості амінокислот
- •1. Реакції за аміногрупою
- •Особливості хімічних властивостей , та -амінокислот Відношення до нагрівання
- •8.3. Гідроксикислоти
- •Способи одержання гідроксикислот
- •Хімічні властивості гідроксикислот
- •1. Реакції за гідроксильною групою (–он).
- •3. Особливості хімічних властивостей
- •Приклади контрольних завдань
- •10. Рекомендована література
Окиснення ароматичних амінів:
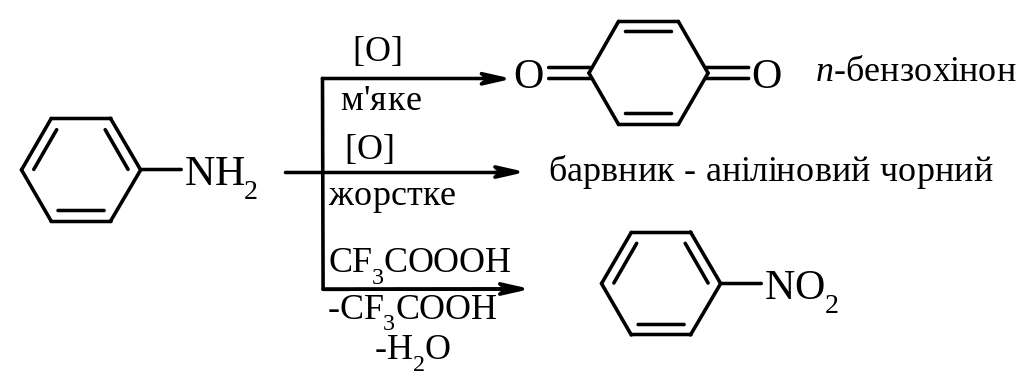
6.3. Ароматичні діазо- і азосполуки
Діазосполуки Ar-N2X це органічні сполуки з функціональною групою, що складається із двох атомів Нітрогену, які сполучені з ароматичним радикалом і неорганічним замісником Х.
Для ароматичних діазосполук характерна наявність діазогрупи, що сполучена з карборадикалом.
Ароматичні діазосполуки існують у вигляді декількох малостійких форм, які легко переходять одна в одну. До них відносяться:
Солі діазонію [Ar–NN]+X, де Х – аніон сильної кислоти (HSO4, Cl та інші).
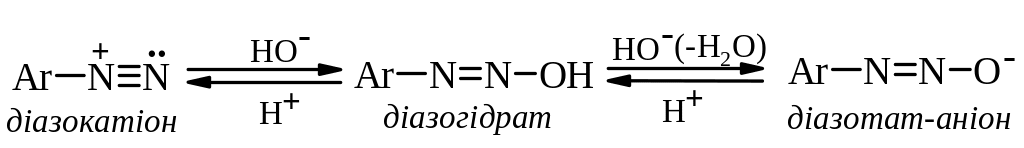
Діазогідрати Ar–N=N–OH, які мають амфотерні властивості: у кислому середовищі вони утворюють діазокатіони [Ar–NN]+, а в лужному – діазотат-аніони Ar–N=N–O.
Діазосполуки Ar–N=N–Х, де Х – залишок слабкої кислоти. Такі сполуки не відносяться до солей діазонію, не мають іонних зв’язків і не дисоціюють. До них належать арилдіазосульфіти Ar‑N=N‑SO3Na, арилдіазоціаніди Ar‑N=N‑CN та інші.
Із всіх діазосполук найбільше значення мають солі арилдіазонію. Одержують їх реакцією діазотування – дією на водний розчин первинного ароматичного аміну нітритом натрію у присутності надлишку мінеральної кислоти при охолодженні:
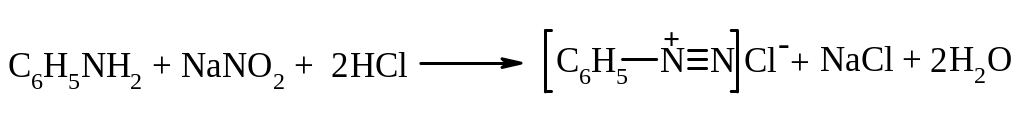
Солі арилдіазонію у водному розчині змінюють свою будову в залежності від значення рН середовища: при нейтралізації кислого середовища вони переходять у форму діазогідрата, який у лужному середовищі утворює діазотат–аніона:
Для діазосполук характерні два типи хімічних перетворень – реакції з виділенням азоту і реакції без виділення азоту. Перший тип хімічних перетворень має велике значення для синтезу різноманітних сполук, другий – є основою цілої галузі промисловості – одержання азобарвників.
Реакції діазосполук з виділенням азоту
Такі реакції використовуються для одержання різних похідних бензену, у тому числі маталоорганічних сполук, а також для вилучення (елімінування) аміногрупи. Механізм таких реакцій SN1 i SR.
А. Гетеролітичний розклад солей діазонію. Такими реакціями без каталізатора можна замінити діазогрупу на гідрокси-групу (–OH), метокси-групу (–OCH3), фтор (–F).
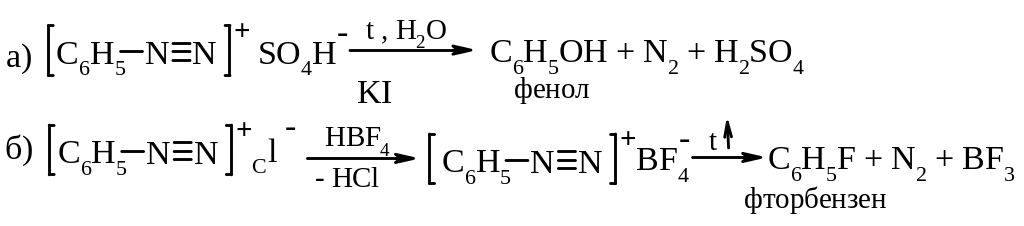
Розкладання гідросульфату фенілдіазонію водою відбувається за механізмом SN1:
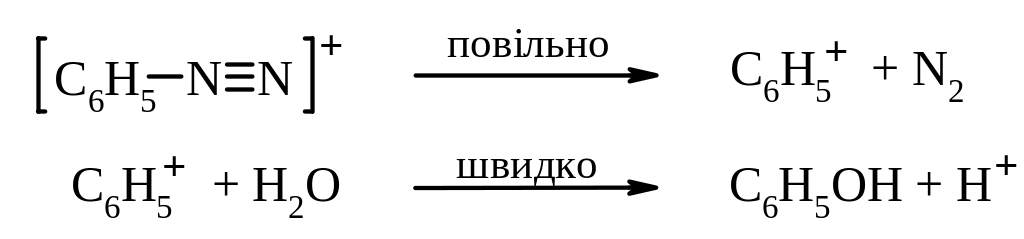
Б. Радикальний некаталітичний розклад солей діазонію. За цим механізмом відбувається заміщення діазогрупи на йод. Загальна схема реакції:
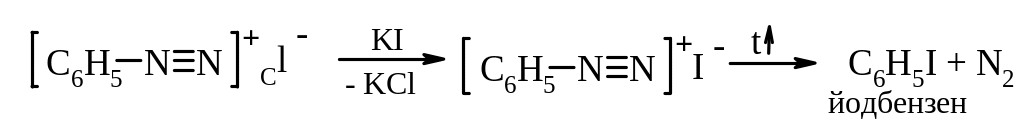
Механізм реакції:
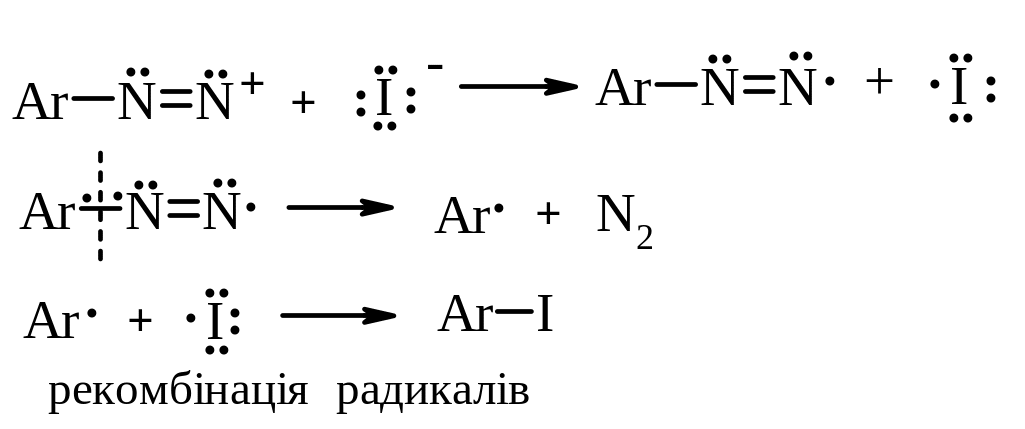
В. Радикальний каталітичний розклад солей діазонію. За такими реакціями діазогрупу можна замінити на Cl, Br, –CN, –SCN, –NO2. Реакції проходять при наявності каталізатору – відповідної солі купруму(І). Це реакція Зандмейєра.
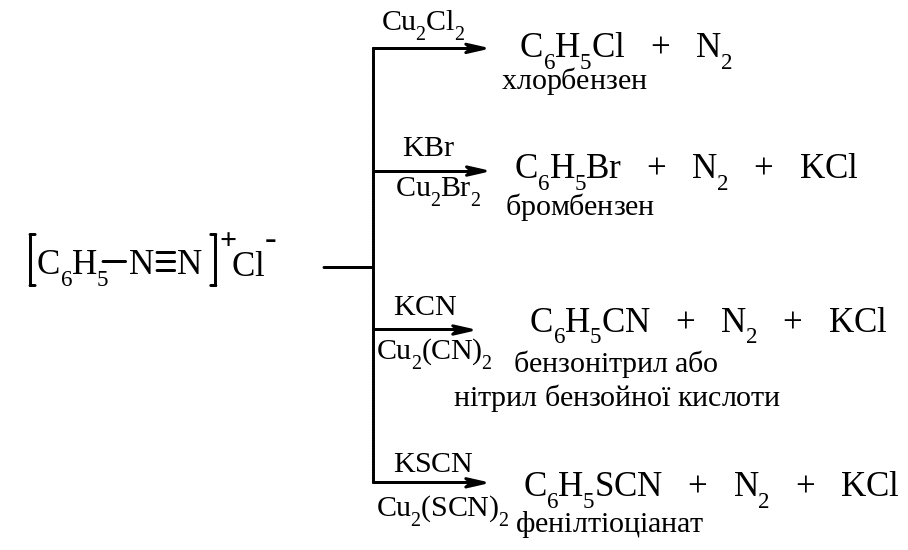
Механізм реакції – радикальний:

Механізм заміщення діазогрупи на Гідроген:

Реакції без виділення азоту
Реакції азосполучення, які призводять до утворення барвників. Азосполучення – це взаємодія солей арилдіазонію з похідними ароматичних вуглеводнів (амінів, фенолів). Азосполучення призводить до утворення азосполук, в молекулах яких присутня азогрупа –N=N– , яка знаходиться в супряженні з ароматичною π-електронною системою. Оскільки діазокатіон достатньо слабкий електрофіл, в реакцію азосполучення вступають вуглеводні, що мають сильні електронодонорі групи, наприклад, –NH2, –OH. Середовище реакційної маси при цьому не повинно бути дуже кислим, так як аміногрупа –NH2 може перейти амонійну –N+H3, яка є акцептором електронів, і не дуже лужним, так як діазокатіон перейде у форму діазотатаніону, який не вступає в реакцію азосполучення, так як це вже не електрофіл, а нуклеофіл.
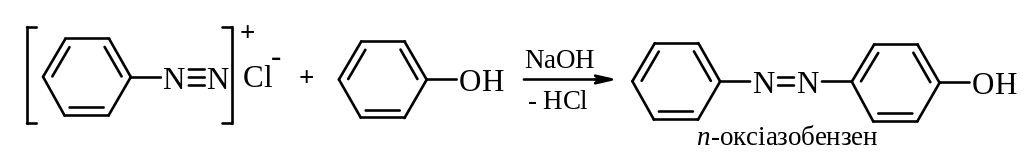
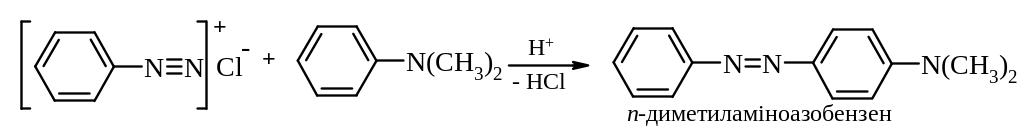
Механізм:
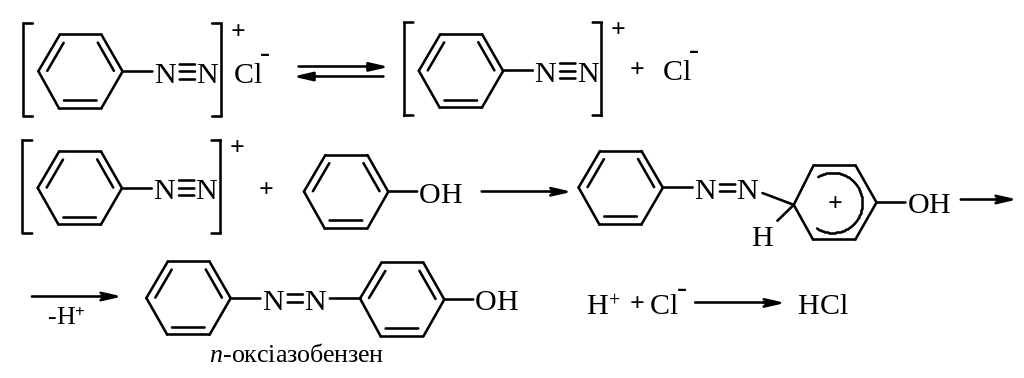 Азобарвники
застосовують для забарвлення самих
різних матеріалів, в першу чергу, волокон
(рослинних, тваринних та штучних) і
тканин; також пластмас, гуми, деревини,
шкіри і харчових продуктів. Вони
використовуються для виготовлення
лаків, покривних і поліграфічних
барвників та як індикатори.
Азобарвники
застосовують для забарвлення самих
різних матеріалів, в першу чергу, волокон
(рослинних, тваринних та штучних) і
тканин; також пластмас, гуми, деревини,
шкіри і харчових продуктів. Вони
використовуються для виготовлення
лаків, покривних і поліграфічних
барвників та як індикатори.
Важлива властивість солей діазонію – це їх здатність вступати в реакції відновлення. Ця властивість солей діазонію використовується при встановленні будови азобарвника. Так при дії лужного розчину гідросульфіту натрію азобарвник легко розщеплюється на два аміни, що дає можливість встановити будову вихідного барвника.

