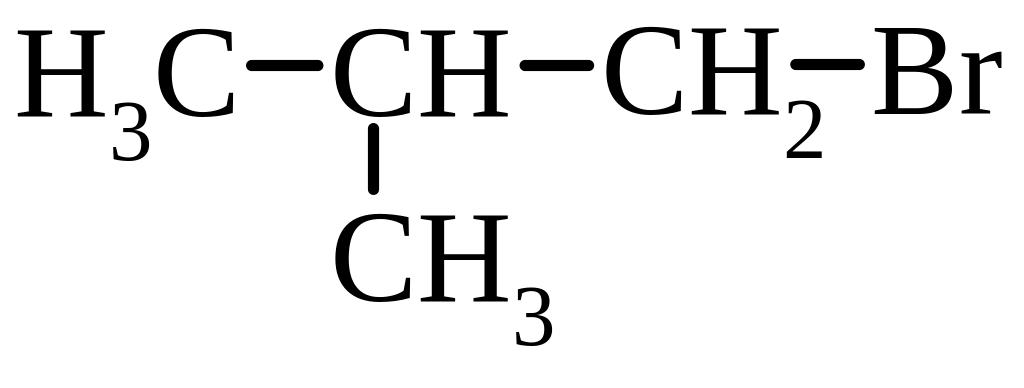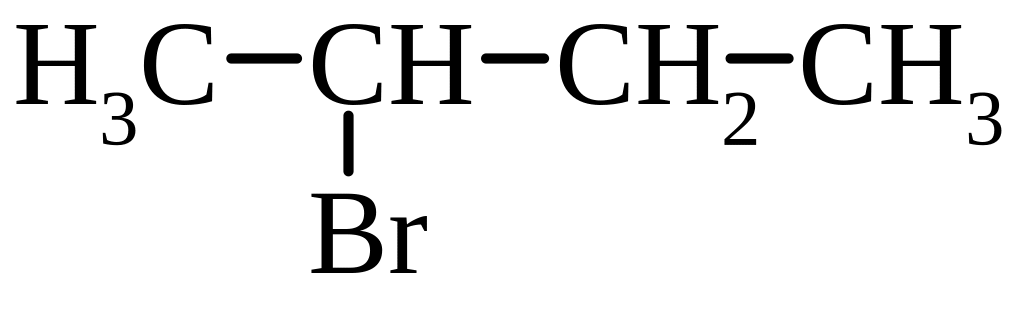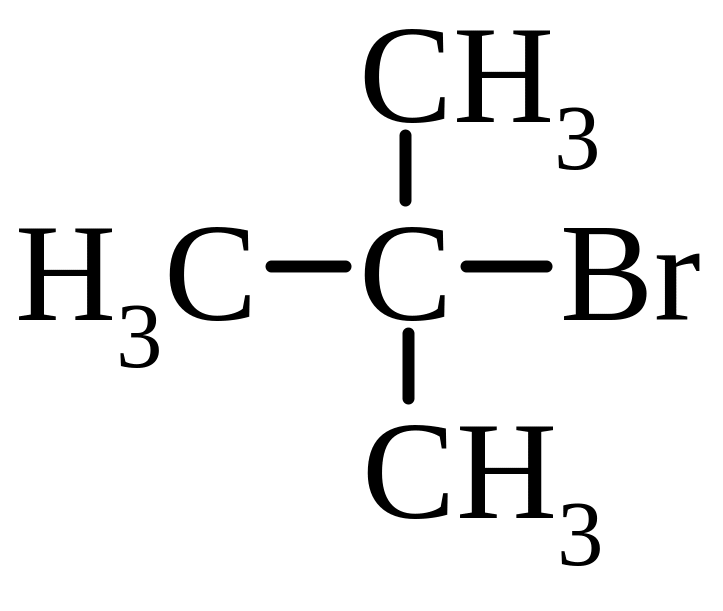- •1. Галогенпохідні вуглеводнів
- •Способи одержання
- •Хімічні властивості
- •Ненасичені галогенопохідні вуглеводнів Класифікація
- •Хлористий вініл
- •1. Одержання хлористого вінілу
- •2. Хімічні властивості хлористого вінілу
- •Хлористий аліл
- •2. Хімічні властивості хлористого алілу
- •Хімічні властивості ароматичних галогеновуглеводнів
- •Реакції галогеналканів та ароматичних галогенопохідних з металами:
- •2. Ароматичні сульфокислоти
- •Хімічні властивості сульфокислот
- •Реакції сульфогрупи
- •Реакції заміщення сульфогрупи
- •3. Одно- і багатоатомні спирти
- •Методи одержання спиртів
- •Будова спиртів
- •Хімічні властивості спиртів
- •2. Дегідратація
- •Феноли. Хінони
- •Методи одержання фенолів
- •Будова фенолів
- •Хімічні властивості фенолів
- •4. Особливості реакцій електрофільного заміщення
- •Багатоатомні феноли
- •Альдегіди і кетони
- •Класифікація
- •Номенклатура альдегідів та кетонів
- •Способи одержання
- •Хімічні властивості
- •2. Реакції нуклеофільного приєднання
- •Реакції приєднання-відщеплення
- •Б) При нагріванні альдоль відщеплює воду з утворенням ненасиченого альдегіду. Ця реакція має назву кротонової конденсації.
- •6. Окиснення альдегідів і кетонів
- •8. Естерна конденсація (реакція Тіщенко).
- •9. Реакції полімеризації
- •Способи одержання нітросполук Способи одержання аліфатичних нітросполук
- •Способи одержання жирно-ароматичних нітросполук
- •Нуклеофільне заміщення галогену на нітрогрупу
- •Одержання ароматичних нітросполук
- •Будова нітрогрупи
- •Хімічні властивості
- •Реакції відновлення з утворенням амінів
- •2. Ацинітротаутомерія
- •Класифікація
- •2. З кислотами алкіламіни утворюють соли алкіламмонію:
- •7. Реакція окиснення
- •Хімічні властивості ароматичних амінів
- •2. Реація ацилювання
- •Окиснення ароматичних амінів:
- •6.3. Ароматичні діазо- і азосполуки
- •Реакції діазосполук з виділенням азоту
- •Реакції без виділення азоту
- •7. Карбонові кислоти
- •Назви одноосновних карбонових кислот
- •Методи одержання одноосновних карбонових кислот
- •Хімічні властивості одноосновних карбонових кислот
- •Кислотні властивості
- •Одноосновні ненасичені карбонові кислоти ,-ненасичені кислоти
- •Способи одержання ненасичених карбонових кислот
- •Хімічні властивості ненасичених карбонових кислот
- •1. Реакції приєднання за подвійним зв’язком
- •2. Реакції за карбоксильною групою
- •Двохосновні карбонові кислоти
- •Способи одержання двохосновних карбонових кислот
- •Хімічні властивості двохосновних карбонових кислот
- •Ароматичні двохосновні карбонові кислоти
- •Хімічні властивості ароматичних двохосноних карбонових кислот
- •Реакції за карбоксильною групою
- •Особливості хімічних властивостей дикарбонових кислот
- •Сполуки зі змішаними функціями
- •8.1. Галогенозаміщені кислоти
- •Способи одержання галогенозаміщенних кислот
- •Хімічні властивості галогенозаміщенних кислот
- •1. Кислотні властивості
- •Дисоціація кислот:
- •2. Для галогенозаміщених кислот характерні два типи хімічних перетворень:
- •3. Особливості хімічних властивостей - відношення галогенозаміщених кислот до води при нагріванні.
- •8.2. Амінокислоти
- •Способи одержання амінокислот
- •1. Одержання -амінокислот
- •2. Одержання -амінокислот
- •Хімічні властивості амінокислот
- •1. Реакції за аміногрупою
- •Особливості хімічних властивостей , та -амінокислот Відношення до нагрівання
- •8.3. Гідроксикислоти
- •Способи одержання гідроксикислот
- •Хімічні властивості гідроксикислот
- •1. Реакції за гідроксильною групою (–он).
- •3. Особливості хімічних властивостей
- •Приклади контрольних завдань
- •10. Рекомендована література
ЗМІСТ
|
|
Галогенпохідні вуглеводнів |
4 |
|
|
Ароматичні сульфокислоти |
15 |
|
|
Одно- і багатоатомні спирти |
17 |
|
|
Феноли. Хінони |
20 |
|
|
Альдегіди і кетони |
27 |
|
|
Нітрогеновмісні органічні сполуки |
36 |
|
6.1. Нітросполуки |
36 |
|
6.2. Аміни |
42 |
|
6.3. Ароматичні діазо- і азосполуки |
50 |
|
|
Карбонові кислоти |
54 |
|
|
Сполуки зі змішаними функціями |
66 |
|
8.1. Галогенозаміщені кислоти |
66 |
|
8.2. Амінокислоти |
68 |
|
8.3. Гідроксикислоти |
71 |
|
|
Приклади контрольних завдань |
74 |
|
|
Рекомендована література |
83 |
1. Галогенпохідні вуглеводнів
Галогенпохідні вуглеводнів – сполуки, в яких один або більше атомів Гідрогену заміщені на атом (чи атоми) галогену (галогенів).
Класифікація
1. Моногалогенопохідні:
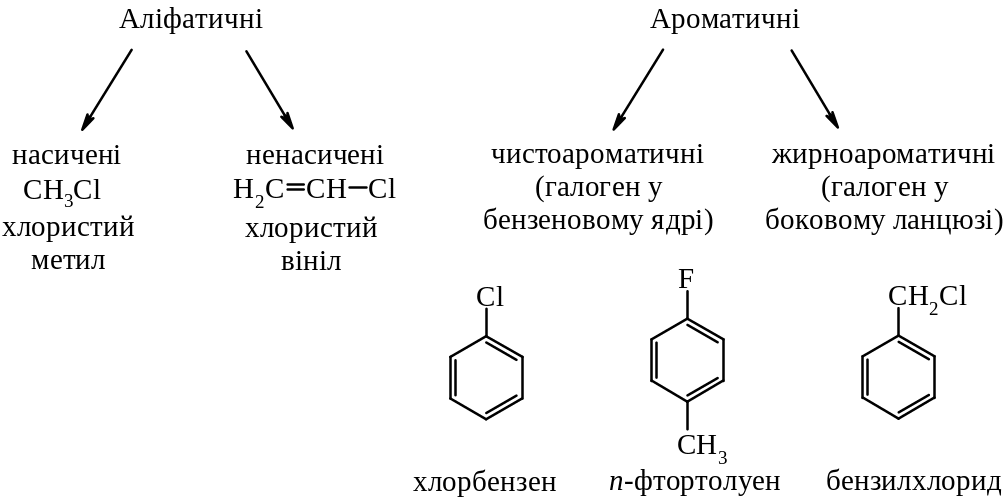
2. Полігалогенопохідні:
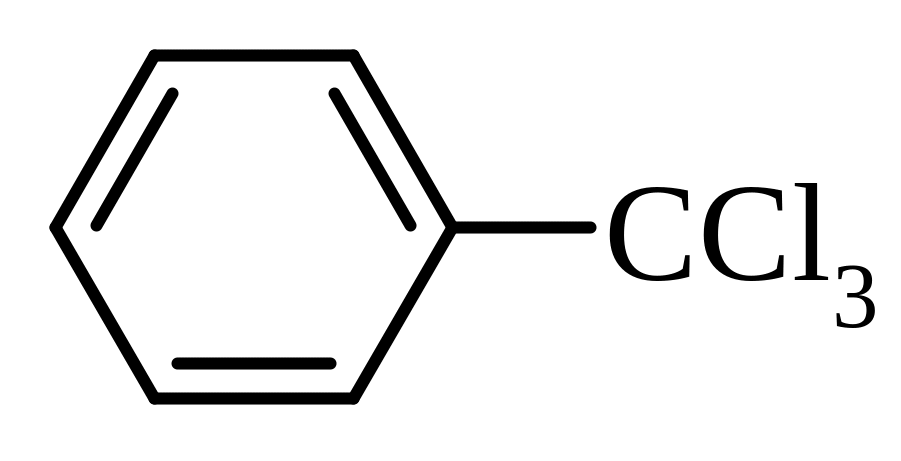
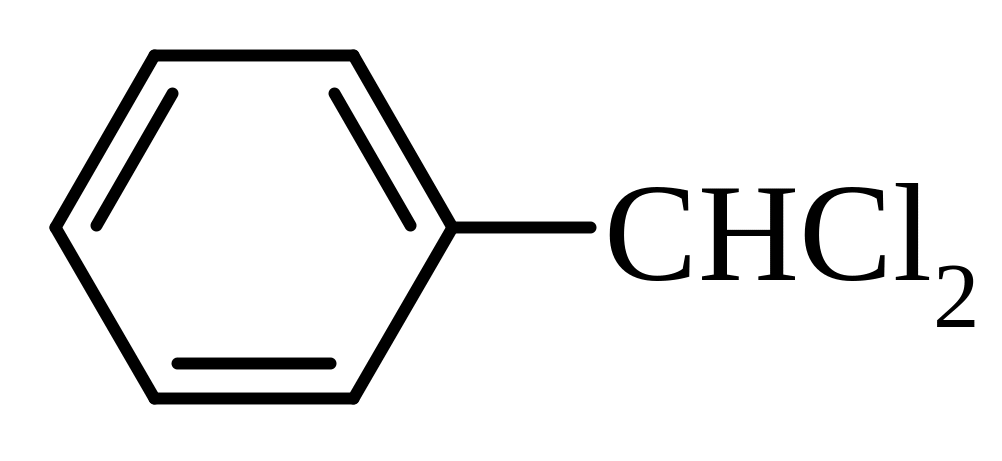
Аліфатичні – |
CHCl3 – трихлорметан (хлороформ); CCl4 – тетрахлорметан (чотирихлористий вуглець) |
|
Ароматичні – |
|
|
бензотрихлорид, бензилідинхлорид |
бензиліденхлорид |
|
НАСИЧЕНІ ГАЛОГЕНОПОХІДНІ ВУГЛЕВОДНІВ
(ГАЛОГЕНАЛКАНИ)
Ізомерія і номенклатура
В залежності від структури атома Карбону, з яким зв’язаний галоген, розрізняють первинні, вторинні і третинні галогенопохідні.
Їх ізомерія залежить від:
а) ізомерії карбонового ланцюга;
б) положення атома галогену в лацюзі.
Номенклатура:
Формула |
IUPAC |
Радикально-функціональна |
СH3Cl |
хлорметан |
метилхлорид |
C2H5Cl |
хлоретан |
етилхлорид |
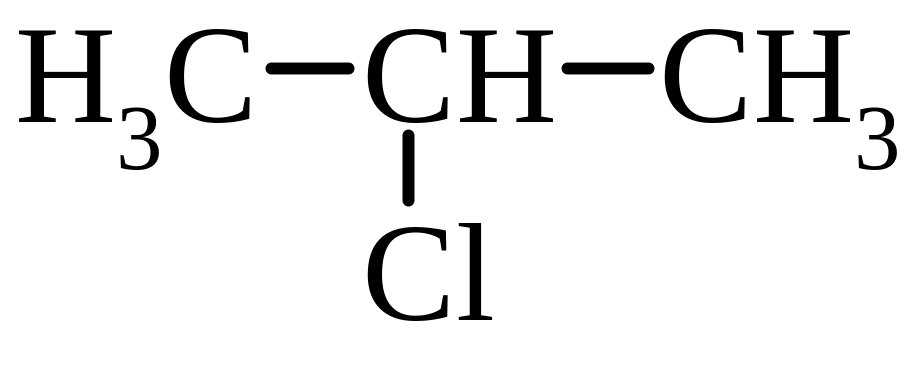
C3H7Cl |
|
|
|
1-хлорпропан (первинне галогенопохідне) |
пропілхлорид |
|
2-хлорпропан (вторинне) |
ізопропілхлорид |
C4H9Cl |
|
|
|
1-бромбутан (первинне) |
бутилбромід |
|
1-бром-2-метилпропан (первинне) |
ізобутилбромід |
|
2-бромбутан (вторинне) |
втор-бутилбромід |
|
2-бром-2-метилпропан (третинне) |
трет-бутилбромід |
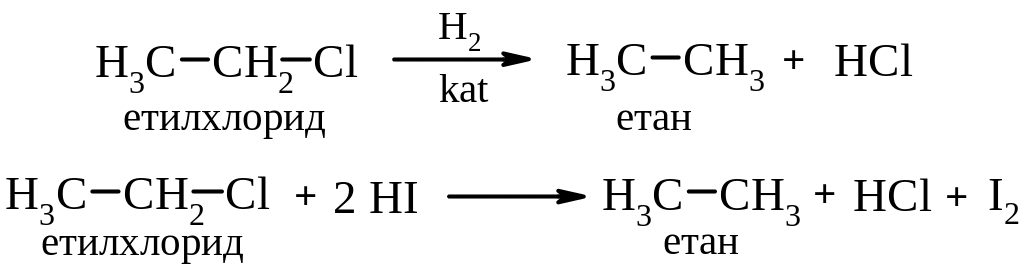
Способи одержання
1. Галогенування алканів.
(Активність галогенів знижується у ряду: F > Cl > Br > I ).
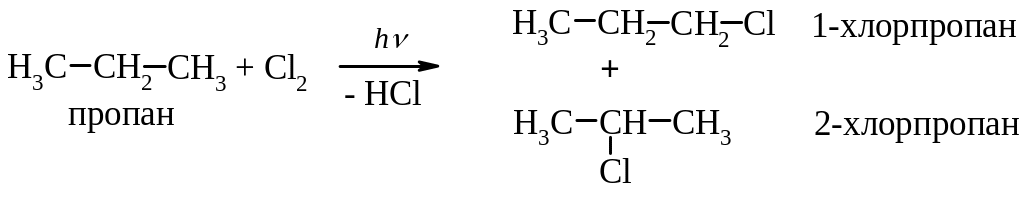
2. Приєднання галогеноводнів до ненасичених сполук:
а) за правилом Марковникова:
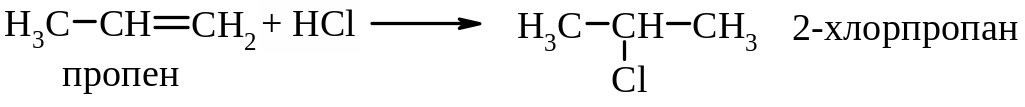
Механізм реакції АЕ – електрофільне приєднання.
б) проти правила Марковникова (перексидний ефект Хараша):
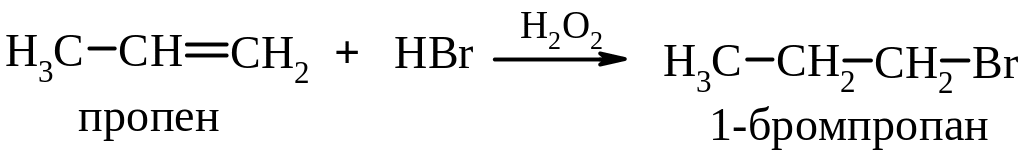
3. Заміщення гідроксильної групи в спиртах при дії:
а) тіонілхлориду:
![]()
б) п’ятихлористого фосфору:
![]()
в) галогеноводнів:
![]()
4. Реакції обміну атомів галогену, які базуються на різній розчинності солей у певних розчинниках, наприклад:
![]()
Хімічні властивості
Галогенопохідні – один з найбільш реакційно здатних класів органічних сполук. Найбільш характерні для них реакції нуклеофільного заміщення (SN) та відщеплення (Е).
І. Реакції нуклеофільного заміщення
Галогеналкани є електрофільними реагентами. Здатність галогеналканів вступати в реакції SN обумовлена полярністю зв’язку карбон–галоген. Оскільки атом галогену є більш електронегативним ніж атом Карбону, він зміщує на себе електронну густину зв’язку С–Hal. В результаті цього атом галогену набуває частково негативного заряду (δ-), а атом Карбону – частково позитивного заряду (δ+) і може бути атакованим нуклеофільним реагентом. Нуклеофільними реагентами можуть бути речовини, які мають атоми з неподіленими парами електронів (Н2O, NH3, RNH2, RSH тощо), а також речовини, які утворюють при дисоціації аніони (NaOH (OH–), KCN (CN–), NaSH (HS–) тощо).
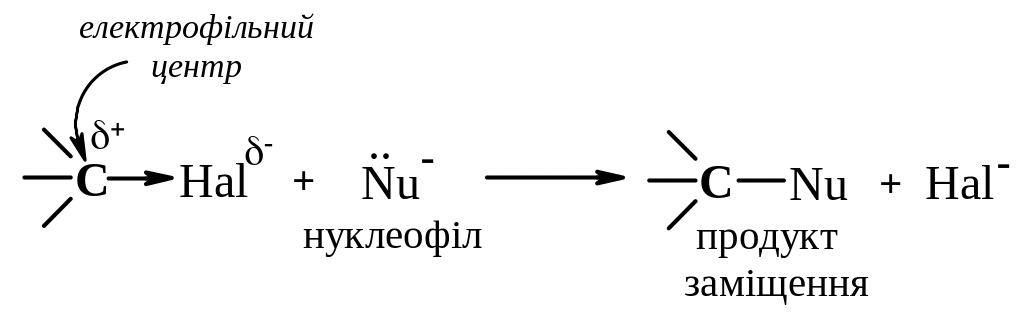
При нуклеофільному заміщенні нуклеофіл атакує молекулу, віддаючи для утворення нового зв’язку свою пару електронів, а атом галогену відщеплюється від молекули галогеналкану з електронною парою зв'язку С–Наl.
Реакційна здатність галогеналканів у реакціях SN зменшується в ряду:
R–I > R–Br > R–Cl >> R–F
Це пояснюється поляризованістю зв'язку С–Наl, тобто здатністю зв'язку збільшувати полярність при підході нуклеофільного реагенту. Поляризованість зв'язку тим більша, чим більш об'эмиста та рухлива електронна оболонка атомів, які утворюють зв'язок. Саме через низьку поляризованість зв'язку С–F флуоралкани практично не вступають в реакції нуклеофільного заміщення
В залежності від будови галогеналканів, природи нуклеофілу та розчинника реакції SN відбуваються за двома основними механізмами SN1 та SN2.
Механізм SN2 (заміщення нуклеофільне другого порядку або бімолекулярне нуклеофільне заміщення).
За механізмом SN2 реагують первинні і трудніше вторинні галогеналкани. Реакція відбувається в одну стадію через утворення перехідного стану.
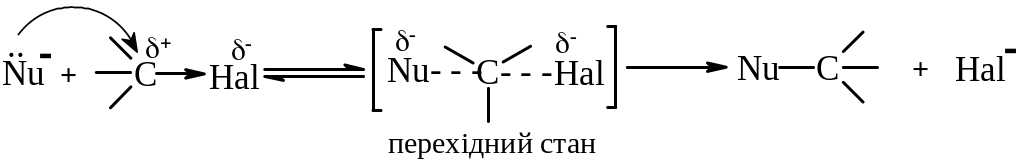
Для SN2 реакцій характерні такі ознаки:
1. Швидкість реакції залежить від концентрації обох реагентів.
2. Реакції супроводжуються, як правило, інверсією конфігурації атому Карбону, тобто конфігурація атому Карбону в процесі реакції змінюється на протилежну – відбувається Вальденівське обертання конфігурації.
3. При SN2 реакціях, як правило, відсутні перегрупування.
Механізм SN1 (заміщення нуклеофільне першого порядку або мономолекулярне нуклеофільне заміщення).
За цим механізмом проходить нуклеофільне заміщення у третинних і, в певних умовах, у вторинних галогеналканів.
Перша стадія реакції – дисоціація – є лімітуючою стадією і відбувається за участю молекул протонного полярного розчинника. Друга стадія відбувається миттєво.
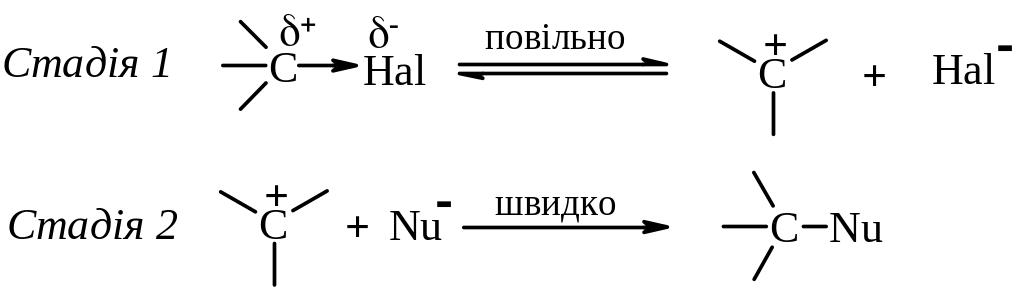
Особливості реакцій SN1:
1. Швидкість реакції залежить лише від концентрації галогеналкану.
2. Оскільки в реакціях SN1 на лімітуючий стадії утворюється карбокатіон, швидкість реакції перед усім залежить від відносної стійкості карбокатіону, тобто від електронних факторів: чим стійкіший утворений карбокатіон, тим більша швидкість реакції. Стійкість алкільних карбокатіонів обумовлена делокалізацією позитивного заряду за рахунок +І-ефекту і збільшується в ряду:
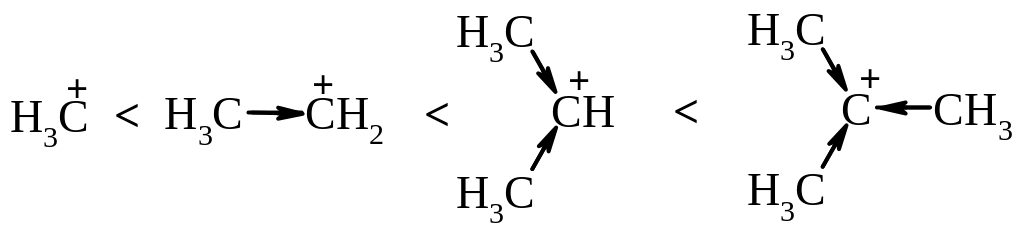
Тому утворення третинного карбкатіону для молекули енергетично вигідніше ніж вторинного, а тим більше первинного.
3. Оскільки реакції SN1 відбуваються через проміжне утворення карбокатіону, вони як правило, супроводжуються перегрупуванням.
1. Гілроліз галогеналканів. Галогеналкани гідролізуються до спиртів. Реакція проходить у присутності водних розчинів лугів або карбонатів лужних металів, так як з водою вона є оборотною.
![]()
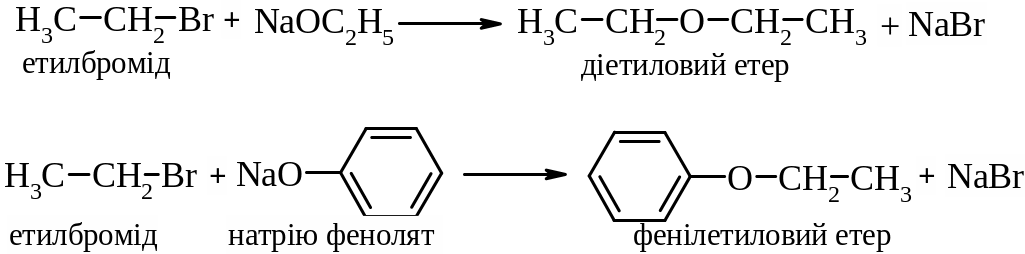
2. Реакція Вільямсона. Реакція взаємодії галогеналканів з алкоголятами та фенолятами є одним з найкращих методів одержання етерів.
3. Взаємодія з солями карбонових кислот. При дії солей карбонових кислот на галогеналкани утворюються естери. Реакція проходить у середовищі апротонного полярного розчинника (диметилформамід, диметилсульфоксид).

4. Взаємодія з амоніаком, алкіл- та арил амінами. При взаємодії з аммоніаком та амінами галоген алкани алкілують їх з утворенням суміші первинних, вторинних і третинних амінів, а також – четвертинних амонієвих основ.
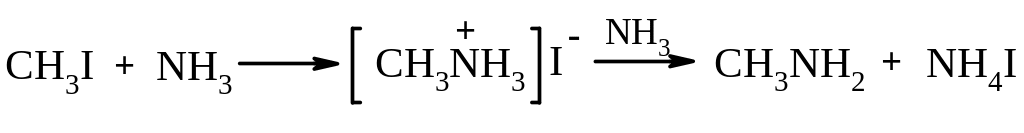
5. Взаємодія з солями синільна кислоти. Первинні та вторинні галогеналкани з натрієм або калієм цианідом у середовищі апротонного полярного розчинника утворюють нітрили (SN2).
![]()
6. Взаємодія з солями нітратної кислоти. Продукти цих реакцій залежать від умов проведення реакцій, будови галогеналкану та солі.
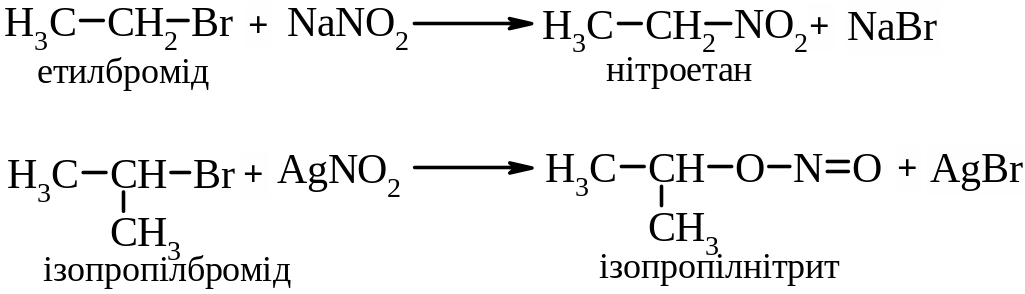
ІІ. Реакції елімінування. Реакції елімінування супроводжуються відщепленням гідрогенгалогену від галогеналканів і призводять до утворення алкенів.
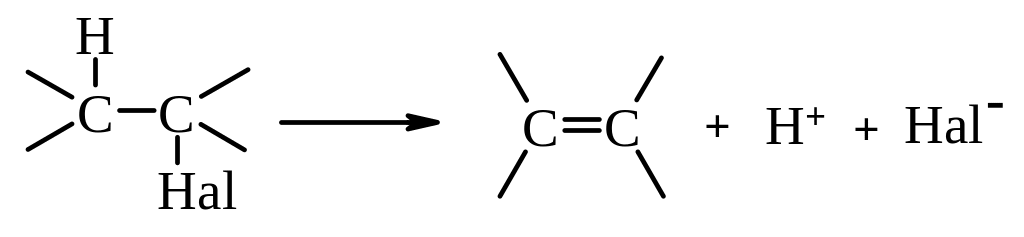
Відщеплення гідрогенгалогенів від галлогеналканів стає переважним процесом у присутності нуклеофільних реагентів, які мають високу основність. До них належать спиртові розчини гідроксидів лужних металів або алкоголяти лужних металів. Елімінуванню сприяють також підвищення температури реакційної суміші і концентрації реагентів. Сприятливо впливає збільшення кількості замісників біля електрофільного атома Карбону. Тому найлегше елімінування відбувається в ряду третинних галогеналканів.
Якщо в молекулі галогеналкану є кілька альтернативних шляхів відщеплення гідрогенгалогенів, то реалізується з них переважно той, в якому подвійний зв'язок утворюється при найбільш заміщеному атомі Карбону, тобто разом з галогеном відходить Гідроген від найменш гідрогенізованого сусіднього атома Карбону. Ця закономірність отримала назву "правило Зайцева":
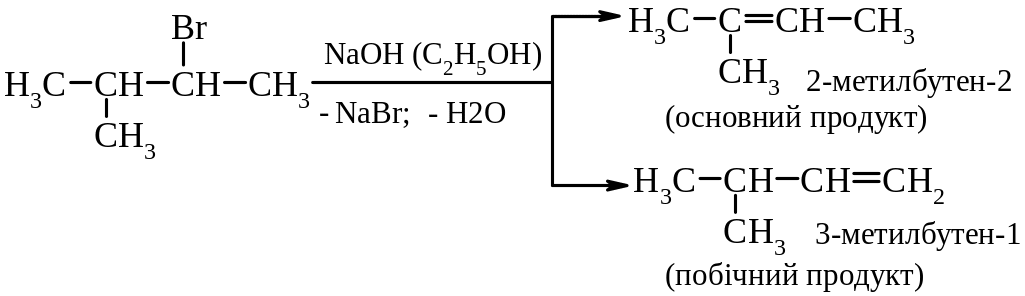
Відщеплення галгеноводнів від галогеналканів може проходити за моно- та бімолекулярним механізмами.
Механізм Е1 – відщеплення мономолекулярне, швидкість реакції залежить лише від концентрації галогеналкану:
V=k[R–Hal]
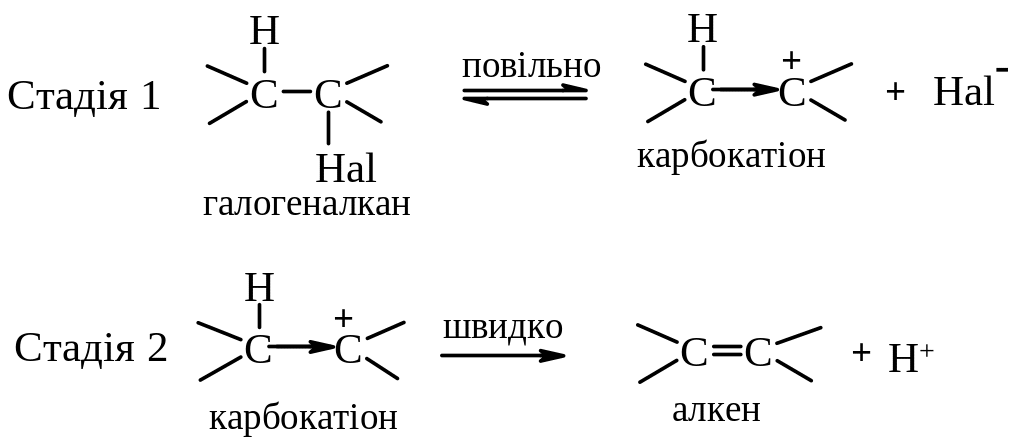
Лімітуюча стадія реакції – утворення карбокатіону, тому швидкість реакції зростає при переході від первинних до третинних алкілгалогенідів. Відщеплення протону за механізмом Е1 є наглядним проявом ефекту надсупряження; протон відщеплюється внаслідок перекривання вакантної орбіталі карбокатіоного центру з електронами сусіднього зв’язку С-Н.
Механізм Е2 – відщеплення бімолекулярне, швидкість реакції залежить від концентрації обох реагентів – галгеналкану та основи:
V=k[R–Hal][В-].
Механізм Е2 зображується такою схемою:
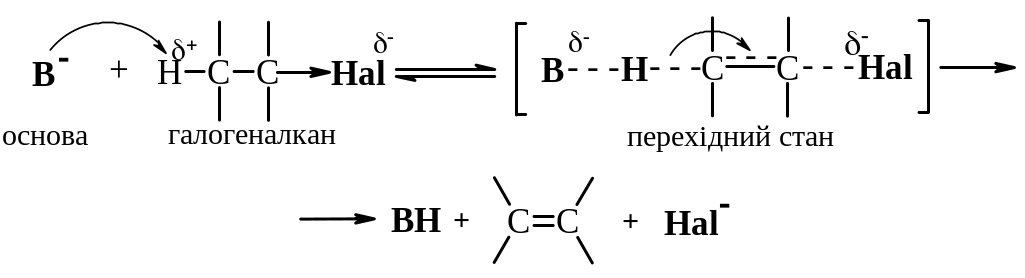
Реакція за механізмом Е2 прискорюється із збільшенням числа замісників при сусідньому атомі Карбону. Це пов'язано з утворенням термодинамічно вигідного розгалуженого алкену та меншою міцністю зв’язку С–Н біля більш заміщеного атому Карбону.
ІІІ. Взаємодія з металами

![]()
![]()
ІV. Відновлення галогеналканів