
- •Оглавление
- •Предисловие
- •Общий химический состав продуктов микробного синтеза,%
- •Содержание декстринов в компонетах комбикормов [67]
- •2. Биотехника выращивания и кормления основных объектов аквакультуры юга россии
- •2.1. Осетровые рыбы
- •Плотность посадки молоди осетровых рыб до массы 3 г
- •Состав рецепта стартового комбикорма ост-4 для бестера, белуги и русского осетра
- •Суточная норма добавки живых кормов к комбикорму
- •Суточные нормы кормления молоди осетровых рыб в зависимости от массы тела и температуры воды продукционными комбикормами
- •Бионормативы кормления и выращивания посадочного материала массой 500 г без зимовки
- •Суточные нормы кормления осетровых рыб массой 500-1500 г в зависимости от массы тела и температуры воды
- •Выращивание веслоноса
- •Расход, уровень воды и плотность посадки личинок веслоноса
- •Суточные нормы кормления личинок и мальков веслоноса, % от массы тела
- •2.2. Выращивание молоди белорыбицы
- •2.3. Канальный сом
- •Рекомендуемые соотношения между размером
- •2.4. Радужная форель, форель камлоопс и Дональдсона
- •Размер гранул в зависимости от массы тела радужной форели
- •Суточная норма кормления радужной форели, % массы тела
- •2.5. Карп и растительноядные рыбы
- •Суточная норма кормления личинок и мальков карповых рыб, % от массы тела
- •Рецепты комбикормов для выращивания карпа на теплых водах, %
- •Суточная норма кормления карпа в бассейнах и садках,
- •2.6. Черный амур
- •2.7. Выращивание буффало
- •2.8. Пресноводные креветки
- •Влияние плотности посадки на рост и выживаемость креветок
- •3. Культивирование дафнии магна
- •4. Биотехника получения декапсулированных яиц и науплиусов артемии салины
- •Декапсуляция яиц артемии
- •5.Отраслевой стандарт на воду для рыбоводных хозяйств ост 15.372-87
- •Доля растворенного аммиака (в %) в зависимости от величины рН и температуры
- •Решение проблемы удаления из водоисточников индустриальных рыбоводных хозяйств юга россии избытка молекулярного азота
- •Методы оценки морфобиологического и физиолого-биохимического состояния выращенных рыб
- •7.1. Оценка внешнего вида и поведения рыб
- •7.2. Измерение, взвешивание и вскрытие рыбы
- •Масса печени как тестовый показатель, % массы тела рыбы
- •7.3. Анализ химического состава рыб
- •Содержание жира в печени и мышцах растительноядных рыб
- •7.4. Анализ крови и печени
- •Содержание общего белка в сыворотке крови прудовых рыб, %*
- •Характеристика кормового сырья для производства сухих комбинированных кормов
- •8.1. Компоненты растительного происхождения.
- •Высокобелковые кормовые компоненты растительного происхождения.
- •8.2. Компоненты животного происхождения
- •8.3. Компоненты микробиального происхождения
- •Состав продуктов микробиологического синтеза по сравнению с основными белковыми кормами животного и растительного происхождения (г /100 г кормов)
- •Продолжение таблицы 56
- •8.4. Жировые добавки
- •8.5. Витамины
- •Жирорастворимые витамины
- •Водорастворимые витамины
- •8.6. Минеральные вещества и добавки
- •8.7. Премиксы
- •8.8. Кормовые антибиотики
- •8.9. Гормоны и ферментные препараты
- •8.10. Каротиноиды
- •8.11.Вкусовые добавки
- •8.12. Красящие вещества
- •8.13. Связующие вещества
- •8.14. Антиоксиданты
- •8.15. Пробиотики и энтеросорбенты
- •Антипитательные вещества компонентов комбикормов
- •10. Влажные кормовые компоненты, корма и пасты
- •Рецепты влажных кормов для форели,%
- •11. Методы разработки рецептур комбикормов
- •11.1 Метод расчета состава кормосмесей на эвм
- •11.2 Метод балансирования фракционного состава белка в стартовых кормах для рыб
- •11.3 Состав и питательная ценность компонентов комбикормов
- •12. Технические требования к качеству сухих комбикормов для объектов аквакультуры
- •Оптимальные значения длины формующего отверстия матрицы в зависимости от диаметра
- •Влияние состава компонентов комбикормов на крошимость гранул
- •13. Нормативно-техническая документация на комбикорма для рыб
- •13.1. Технические условия на комбикорма для индустриального рыбоводства (ту 1034-89)
- •13.2. Технические условия на комбикорма для прудового карпа
- •13.3. Технические условия на комбикорма-экструдаты
- •13.4. Продукционные комбикорма – концентраты для карпа
- •14. Направления технологии производства комбикормов
- •14.1 Плющение зерновых компонентов
- •14.2 Экструдирование кормовых компонентов
- •14.3. Микронизация компонентов комбикормов.
- •14.4. Экспандирование комбикормов
- •15. Технологические процессы и оборудование для производства стартовых и продукционных комбикормов
- •Технологические параметры производства комбикормов
- •Система контроля качества комбикормов
- •Технологические схемы производства комбикормов для рыб
- •Содержание жирных кислот в кормовых компонентах комбикормов,%
- •Приложение 2 Содержание питательных веществ в кормовых компонентах комбикормов [1]
- •Содержание основных аминокислот в кормовых компонентах комбикормов,% [1]
- •Список используемой итературы
Содержание жира в печени и мышцах растительноядных рыб
Рыба |
Содержание жира, % |
|
в печени |
в мышцах |
|
Белый толстолобик 0+ 2+ |
2,420,09 |
1,230,04 |
2,190,05 |
2,900,05 |
|
Пестрый толстолобик 0+ 2+ |
2,600,04 |
0,480,04 |
4,050,04 |
1,350,04 |
|
Белый амур 0+ 2+ |
3,420,07 |
0,490,04 |
10,280,06 |
2,420,04 |
|
Оборудование и реактивы: весы аналитические, ступка фарфоровая с пестиком, колба Бунзена, воронка Бюхнера, насос Комовского, стаканчики на 50-100 мл, сушильный шкаф, ацетон, сульфат натрия безводный.
Ход определения: арбитражным методом определения жирности является метод Сокслета, однако он слишком длительный и в некоторых случаях, например, при анализе икры рыб, дает заниженные результаты. Ниже приводится метод, основанный на экстракции ацетоном и отгонке ацетона.
Сеголетков массой до 10,0 г анализируют целиком. Более крупную рыбу измельчают, фарш хорошо перемешивают и берут навеску 5-10 г с точностью до 0,1 г.
Предварительно рыбу необходимо обсушить фильтровальной бумагой, взвесить и записать массу.
Рыбу, помещенную в фарфоровую ступку, измельчают ножницами, добавляют приблизительно равное по объему количество безводного сульфата натрия и хорошо растирают пестиком до однородной массы. Если масса получается мокрая, то следует добавить еще некоторое количество сульфата натрия. Можно также для ускорения кристаллизации воды и обезвоживания ткани поставить ступку на 1 ч в холодильник при температуре 4-6°С.
Сухую массу из ступки ложкой переносят в стакан и заливают 2-3-кратным объемом ацетона. Стакан накрывают стеклом или пленкой для уменьшения испарения и оставляют на ночь для экстракции жира.
Содержимое стакана переносят ложкой на фильтр прибора для фильтрования. Прибор состоит из колбы Бунзена и воронки Бюхнера с хорошо пригнанным бумажным фильтром. Особенно удобно пользоваться специальным стеклянным фильтром в виде цилиндрической воронки с вваренной пористой стеклянной пластинкой. Отрицательное давление в колбе Бунзена создается насосом Комовского или водоструйным насосом. После того, как весь ацетоновый раствор жира стечет в колбу, стакан ополаскивают новой порцией ацетона и также пропускают его через воронку. Общий объем ацетона должен в 5-10 раз превышать количество взятой на анализ рыбы.
Ацетон переливают из колбы Бунзена в мерный цилиндр и записывают полученный объем. Из этого объема берут пипеткой 20-30 мл и наливают в предварительно взвешенный стаканчик.
Стаканчик с ацетоновым раствором жира выпаривают в сушильном шкафу до исчезновения запаха ацетона.
После отгонки ацетона стаканчик остужают в эксикаторе взвешивают. Для взвешивания стаканчика с жиром и без жира требуются точные аналитические весы (например, ВЛА-200), т.к. взвешивается, как правило, не более 100 мг жира. Успех анализа прежде всего зависит от точности взвешивания.
Расчет жирности:

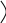 масса
стакана _ масса пустого объем всего
масса
стакана _ масса пустого объем всего
с жиром, г стакана, г * ацетона, мл
Жирность, %-----------------------------------------------------------------*100
навеска рыбы, г * объем ацетона, взятого
для отгонки
Содержание белка в теле рыбы может меняться в зависимости от целого ряда причин. При истощении количество белка в теле уменьшается прежде всего из-за обводнения ткани. Но содержание белка может несколько уменьшаться и благодаря повышению жирности. Поэтому этим признакам следует пользоваться осторожно, учитывая другие показатели общего химического состава.
Определение белка. Арбитражным методом является метод Къельдаля, при котором навеску ткани сжигают в серной кислоте, определяют азот и по этому показатели судят о содержании белка в теле рыб. Метод Къельдаля требует навыка и аккуратности. Более прост описываемый ниже метод определения белка «по разности». Поскольку рыба состоит на 70-90% из воды, 1-10% жира, 1,5-3% минеральных веществ и 9-17% белка, то при наличии данных о сухой массе и жирности для определения белка достаточно сделать анализ на содержание в теле золы. Метод дает несколько завышенные данные (в среднем в 1,14 раза) по сравнению с методом Къельдаля, но т.к. ошибка будет постоянной, то получаемые результаты будут сравнимы и вполне приемлемы для практического рыбоводства. Расчет содержания белка, %:
Белок = сухое вещество - жир - зола
Довольно точно отражает содержание белка в теле карпа также со- держание сухого вещества. Для такого определения можно пользоваться результатами, представленными на графике.
Содержание золы в теле рыбы имеет возрастную динамику, которая заключается в повышении зольности по мере роста.
При истощении содержание золы в теле увеличивается. Низкое содержание золы в теле и в костях может указывать также на недостаток фосфора в рационе.
Содержание золы определяют весовым способом. Навеску помещают в взвешенный фарфоровый тигель, взвешивают и сжигают в муфельной печи 500-700°С. Сжигать можно навеску сухого вещества (порядка 0,5 г) или навеску сырого вещества (2-3 г). Сжигание производят до превращения ткани в светлую, иногда слегка окрашенную золу. Взвешивание проводят на аналитических весах.
Расчет содержания золы при сжигании сырого вещества:
(масса тигля с золой, г – масса пустого тигля, г)
Зола = ----------------------------------------------------------------- * 100%
навеска сырой ткани, г
Содержание гликогена в тканях рыб. Высокое содержание гликогена в организме рыб, особенно в печени, как правило, является благоприятным признаком. Однако повышенное содержание гликогена в печени может указывать на высокое содержание в кормах углеводов (табл.51).
Таблица 51
Содержание гликогена в тканях рыб, %
Масса, возраст, условия и особенности содержания рыбы |
Гликоген, % |
|
Печень |
||
Карп 0+, нормальное состояние |
8 |
|
Карп, нормальное состояние |
||
Лето |
4,81,3 |
|
Осень |
9,20,14 |
|
Декабрь |
15,50,66 |
|
Мышца белая |
||
Лето |
0,660,1 |
|
Осень |
0,360,03 |
|
Декабрь |
0,440,06 |
|
Мышца красная |
||
Осень |
1,100,13 |
|
Декабрь |
1,500,10 |
|
Печень |
||
Карп 30-40 г |
||
голодание, февраль-май |
1,400,20 |
|
подкормка, февраль-май |
4,200,90 |
|
15 дней карповый корм |
1,600,60 |
|
после 3 месяцев голодания |
|
|
15 дней форелевый корм |
3,401,70 |
|
40 дней карповый корм |
10,400,70 |
|
40 дней форелевый корм |
2,801,10 |
|
Карп 15-25 г |
||
нормальное состояние |
8,501,27 |
|
2 дня голодания |
12,201,20 |
|
10 дней голодания |
8,801,70 |
|
22 голодания |
10,701,80 |
|
100 голодания |
1,600,40 |
|
44 дня корм 90% углеводов |
12,302,30 |
|
50% углеводов |
9,800,90 |
|
10% углеводов |
8,001,60 |
|
Форель 2+ |
||
чистая вода |
1,7 |
|
грязная вода |
0,6 |
|
При высоком содержании гликогена в пробе определение проводят «прямым» методом. Если гликогена в пробе мало, что можно ожидать у истощенной рыбы, его предварительно осаждают спиртом – «непрямой» метод, т.к. цветную реакцию с антроном дают также продукты гидролиза белка.
Оборудование и реактивы: фотоэлектроколориметр, антрон - 0,2%-й раствор, приготовленный на 95%-ном растворе х.ч. серной кислоты (раствор готовят в день определения), глюкоза - стандартный раствор (1 мл содержит 40 мкг глюкозы); КОН – 30%-ный раствор; этиловый спирт.
Определение гликогена.
«Прямой» метод. В пробирки, содержащие 25-100 мг печени, добавляют 3 мл З0%-ного КОН, закрывают пробками и 20 мин выдерживают на кипящей водяной бане, охлаждают и разводят до 25-50 мл дистиллированной водой. 2 мл полученного раствора смешивают в пробирке с 4 мл антронового реактива и в течение 10 мин нагревают на кипящей водяной бане, затем охлаждают в холодной воде. Проявившуюся сине-зеленую окраску фотометрируют с красным фильтром (620 нм) против холостой пробы (окраска стабильна при комнатной температуре в течение нескольких часов). Такую же цветную реакции проводят с раствором глюкозы разных концентраций для построения калибровочного графика. Между концентрацией и оптической плотностью сохраняется прямолинейная зависимость для концентраций глюкозы 0,1-1,5 мг/мл. Для расчета содержания гликогена найденное по калибровочному графику количество глюкозы делят на коэффициент 1,11, который отражает отношение молекулярного веса глюкозы к молекулярному весу глюкозного остатка в гликогене.
«Непрямой» метод. В центрифужную пробирку берут 25-100 мг ткани, добавляют 3 мл 30% КОН, нагревают 20 мин на кипящей водяной бане. После охлаждения добавляют 4 мл этилового спирта, хорошо перемешивают и вновь нагревают в водяной бане, пока спирт не закипит. После охлаждения отделяют осадок гликогена центрифугированием в течение 15 мин при 3000 об/мин. Надосадочную жидкость осторожно сливают, осадок растворяют в 1 мл дистиллированной воды и снова повторяют осаждение равным объемом спирта. Осадок растворяют в 2 мл дистиллированной воды, добавляют 4 мл антронового реактива. Далее ход определения, как при «прямом» методе.
