
- •Лекція № 5 розчини електролітів
- •2.Використання законів ідеальних розчинів до розбавлених розчинів електролітів
- •4.Теорія сильних електролітів. Активність
- •5. Іонно - молекулярні реакції
- •7.Дисоціація води
- •8.Водневий показник
- •9. Добуток розчинності До рівноважних належить також система "важкорозчинний електроліт його насичений розчин", наприклад
Лекція № 5 розчини електролітів
1.Загальні поняття теорії розчинів електролітів
Електролітами називаються сполуки, які у розчинах чи розплавах розпадаються (дисоціюють) на йони і які при накладенні різниці потенціалів проводять електричний струм. Електроліти є провідниками другого роду, тому що електричний струм утворюється внаслідок руху іонів (на відміну від провідників першого роду – металів, в яких струм зумовлюється рухом електронів).
Розчини електролітів характеризуються ступенем дисоціації - , який є співвідношенням кількості молекул, які розпались на іони до загальної кількості молекул:
= nдис / nзаг.
В залежності від чисельного значення електроліти розділяють на сильні та слабкі. До сильних електролітів ( > 30 %) відносять майже всі солі, з кислот – сульфатну, нітратну, хлоридну, хлорну; з основ – розчинні основи металів першої та другої групи NaOH, KOH, Ca(OH)2, Ba(OH)2.
До слабких електролітів ( < 3 %) належать з кислот: сульфідна, нітритна, карбонатна, сульфурводнева, більшість одноосновних органічних кислот (ацетатна, бензойна, тощо); з основ – розчин амоніаку в воді – амоній гідроксид, всі нерозчинені основи р-, d-, і f-елементів (Сu(OH)2, Fe(OH)3, Al(OH)3, тощо). Фосфорна кислота є кислотою середньої сили.
За величиною розподілити електроліти на сильні і слабки можна тільки приблизно, тому що ця характеристика залежить від природи розчинника, температури та концентрації розчину.
Процес електролітичної дисоціації слабких електролітів зручніше характеризувати константою хімічної рівноваги, яку в цьому випадку називають константою дисоціації. Так для реакції KА К+ + А–, відповідно до закону діючих мас, константа дисоціації Kд дорівнює:
K рівн = [ K+] [A–] / [ KA] = Kдис.
Величина K залежіть від природи електроліта, розчинника та температури і не залежіть від концентрації розчину. Чим більше Kдис, тим більше дисоціює електроліт. Наприклад, Kдис(СН3СООН) = 1.10–5, Kдис(Н2СО3) = 4,5.10–7, тобто ацетатна кислота, більш сильна, ніж карбонатна.
Багатоосновні кислоти та багатокислотні основи дисоціюють ступінчасто і кожна з ступенів має свою константу Кдис. Наприклад:
Н3РО4 Н+ + Н2РО4- K1дис =7,5.10–3;
Н2РО4- Н+ + НРО42- K2дис = 6,3.10–8;
НРО42- Н+ + РО43-- K3дис = 1,3.10–12.
Сумарна константа знаходиться за рівнянням Kдис = K 1K 2K 3.
При ступінчастій дисоціації речовин подальший ступень дисоціації характеризується меншим розпадом, ніж попередній, тобто K1 > K2 > K3. Це пояснюється тим, що енергія, яку треба затратити для відривання йона, мінімальна в разі його відривання від нейтральної молекули і стає більшою при дисоціації у кожному наступному процесі.
2.Використання законів ідеальних розчинів до розбавлених розчинів електролітів
У своїх дослідженнях Вант-Гофф довів, що розчини електролітів підкоряються законам ідеальних розчинів тільки при введені поправочного коефіцієнту, якій він назвав ізотонічним коефіцієнтом (і). Ізотонічний коефіцієнт зумовлений зростанням кількості частинок у розчині при дисоціації. Для цих розчинів математичні вирази законів ідеальних розчинів мають вигляд:
Р = іРАоВ; Т зам = іКкрСm; Ткіп = іКебСm ; Росм = іСмRT.
Ці закономірності діють тільки для розбавлених розчинів. Коефіцієнт і змінюється від одиниці до числа, яке дорівнює кількості йонів, на які розпадається електроліт. При подальшому розбавленні розчину і зростає. Наприклад: і (0,2 М розчина КСl ) = 1,81, і (0,02 М розчину КСl ) = 1,96. Між і та існує зв язок: = і1/n1, де n – кількість іонів, на які дисоціює електроліт.
Приклад 1. Визначити ізотонічний коефіцієнт для розчину, який містить 8 г NaOH у 1000 г Н2О, що закіпає при 100,184 С. К еб(Н2О) = 0,516 С.
Розвʼязання:
1. і –?
Другий
закон Рауля для розчинів електролітів
виражається рівнянням tкіп
= іКебСm
; Сm
= ni
.
(1000/m
роз-ка
)
=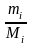 .
1000/
m
роз-ка,
звідки
.
1000/
m
роз-ка,
звідки
і = (tкі. m роз-ка . M(NaOH) : (Кеб. 1000 . m(NaOH) = (0,18410040):(0,51610008) = =1,78.
Відповідь: і = 1,78.
3.Теорія слабких електролітів
Якщо концентрацію слабкого електроліту, що розкладається на два іони
АВ А+ +В–
позначити через С, а ступінь його дисоціації у розчині через , то концентрація кожного з іонів буде С, а концентрація недисоційованих молекул С(1– ).Тоді рівняння константи дисоціації матиме вигляд:
Kдис = С22/С(1– )
Це
рівняння є законом розбавлення
Оствальда.
Він дає можливість визначити ступінь
дисоціації при різних концентраціях,
але не виражає залежність константи
дисоціації від ступеня дисоціації, тому
що Kдис
є стала величина для конкретного
електроліту. Для розчинів, в яких
досить мала (
0)
рівняння набуває вигляду Kдис
= 2С
або α
=
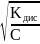 Kдис
є сталою, табличною величиною, С
= СМ,
зростає при розбавленні розчину. Це
відбувається внаслідок зменшення
кількості потрібних зіткнень іонів.
Kдис
є сталою, табличною величиною, С
= СМ,
зростає при розбавленні розчину. Це
відбувається внаслідок зменшення
кількості потрібних зіткнень іонів.
Приклад 2. Розрахувати ступінь дисоціації ацетатної кислоти у 0,1 М та 0,001 М розчинах. Kдис(СН3СООН) = 10−5.
Розвʼязання:
Використовуємо закон розбавлення Оствальда:
α(0,1
М)
=
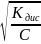 =
=
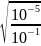 = 10−2
= 0,01.
= 10−2
= 0,01.
α(0,001
М)
=
=
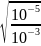 = 10−1
=
0,1.
= 10−1
=
0,1.
Відповідь: α(0,1 М р-ну СН3СООН) = 0,01, α(0,001 М р-ну СН3СООН) = 0,01.
