
Салициловая_Фотометрия
.docxРабота. Спектрофотометрическое определение салициловой кислоты
Вариант 1. Фотометрическое определение содержания салициловой кислоты а растворе по реакции с Fe(III)
Определение основано на реакции салициловой кислоты или ее солей с ионами Fe(III) с образованием окрашенного комплексного соединения. За образование комплексного соединения отвечает функционально-аналитическая группировка атомов в молекуле салициловой кислоты, состоящая из карбоксильной группы и в орто-положении к ней гидроксильной группы. Состав и окраска образующихся комплексов зависит от рН раствора. Возможно образование комплексных ионов различного стехиометрического состава. В зависимости от кислотности среду могут образовываться комплексные соединения [Fe(III)]:[Sal] = 1:1, 1:2 и 1:3. Схема образования трисалицилата железа:
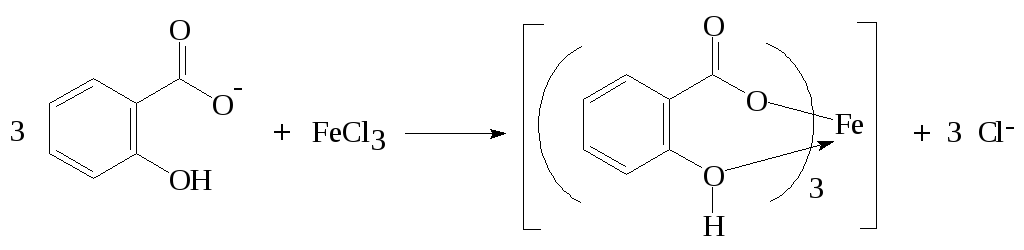
В кислой среде (pH 1-2) образуется моносалицилат железа (III), имеющий фиолетовую окраску. В интервале значений рН 3-8 преобладает комплексный ион со стехиометрическим соотношением Fe(III) : Sal = 1:2, окрашенный в красный цвет. В щелочной среде (рН 8-11) образуется комплексное соединение со стехиометрией Fe(III) : Sal = 1:3 желтого цвета. При условии строгого контроля рН аналитической реакции все три комплексные формы пригодны для фотометрического определения как железа, так и салициловой кислоты. В соответствии с приведенной в справочнике по аналитической химии [1] информацией устойчивость всех трех комплексных форм достаточно велика: логарифмы констант устойчивости lgβ1, lgβ2 и lgβ3 соответственно равны: 15,35; 27,20; 36,27. Следует отметить, что в отношении салициловой кислоты данная реакция не будет селективной, поскольку схожий аналитический эффект дадут и некоторые другие замещенные фенолы.
В настоящей работе используют аналитическую реакцию в кислой среде. Определение проводят при длине волны, соответствующей максимуму поглощения моносалицилатного комплекса железа(III), имеющего фиолетовую окраску. Спектр поглощения водного раствора моносалицилата железа (III) в видимой области приведен на рис.1.
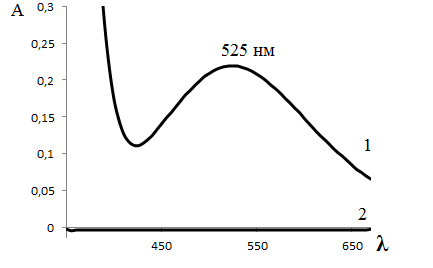
Рис. 1. Спектр поглощения монослицилта железа(III) – 1 и салициловой кислоты -2 в кислой среде
Для проведения градуировки готовят пять растворов салициловой кислоты с различной концентрацией. Их поглощение измеряют при выбранной предварительно длине волны и строят градуировочный график. После чего определяют содержание салициловой кислоты в заданном для анализа растворе.
РЕАГЕНТЫ И ОБОРУДОВАНИЕ
Стандартный водный раствор салициловой кислоты, 1 мг/мл.
Раствор Fe2(SO4), 1%-ный в 1%-ной серной кислоте.
Серная кислота, 1 N.
Фотометр (КФК-3);
Спектрофотометр Cintra;
Кюветы стеклянные, 0,5 см, 1 см, 5 см;
Колбы мерные, 50 мл, 6 штук;
Пипетки (1 - 5 мл).
ВЫПОЛНЕНИЕ ОПРЕДЕЛЕНИЯ
В 5 мерных колб вместимостью 50 мл вносят стандартный раствор салициловой кислоты с содержанием 2,5; 5; 10; 15 и 20 мг, соответственно. В каждую колбу далее вносят по 1 мл раствора серной кислоты и по 5 мл раствора Fe2(SO4)3. Объемы растворов в мерных колбах доводят до метки дистиллированной водой и хорошо перемешивают. Отдельно в ерной колбе объемом 50 мл готовят раствор сравнения, содержащий все компоненты кроме салициловой кислоты.
Раствор с наибольшей концентрацией салициловой кислоты фотометрируют относительно воды в интервале длин волн от 450 до 550 нм с интервалом в 5 нм, или снимают спектр поглощения на спектрофотометре. По построенному спектру поглощения комплекса и выбирают длину волны, соответствующую максимуму полосы поглощения. При выбранной длине волны фотометрируют все растворы градуировочного ряда относительно раствора сравнения, содержащего все компоненты за исключением салициловой кислоты (раствор сравнения) и строят градуировочный график в координатах А = f(c(Sal), где А – поглощение, c(Sal) – концентрация салициловой кислоты).
Для определения салициловой кислоты в анализируемом растворе аликвотную часть его (5 мл) вводят в мерную колбу (готовят растворы для 3 – 5 повторных опытов). Далее в колбы вносят все необходимые по методике растворы (аналогично приготовлению растворов градуировочной серии) и фотометрируют их относительно воды. Содержание салициловой кислоты в приготовленных растворах определяют с использованием построенного градуировочного графика (или для расчета используют градуировочную функцию). По 5 полученным результатам рассчитывают среднее значение содержания салициловой кислоты в исходном растворе (в мг/мл) и доверительный интервал (интервал неопределенности).
Вариант 2. Спектрофотометрическое определение содержания салициловой кислоты в растворе по ее собственному поглощению в УФ-области
РЕАГЕНТЫ И ОБОРУДОВАНИЕ
Стандартный водный раствор салициловой кислоты, 1 мг/мл.
Спектрофотометр Cintra;
Кюветы кварцевые 1 см, 2 шт;
Колбы мерные, 50 мл, 6 штук;
Пипетки (1 - 5 мл).
ВЫПОЛНЕНИЕ ОПРЕДЕЛЕНИЯ
Готовят растворы градуировочного ряда. В 5 мерных колб вместимостью 50 мл вносят стандартный раствор салициловой кислоты с содержанием 2,5; 2,0; 1,5; 1,0 и 0,5 мг, соответственно. Объемы растворов в мерных колбах доводят до метки дистиллированной водой и хорошо перемешивают.
Определение проводят по собственному поглощению салициловой кислоты в УФ-области спектра. Спектр поглощения раствора с наибольшей концентрацией салициловой кислоты снимают относительно воды в интервале длин волн от 200 до 550 нм на спектрофотометре. Задают шаг сьемки 5 нм. По полученному спектру поглощения кислоты и выбирают длину волны, соответствующую максимуму полосы поглощения. При выбранной длине волны снимают поглощение всех растворов градуировочного ряда относительно воды. Далее строят градуировочную прямую, используя программу Cintra.
Для определения салициловой кислоты в анализируемом растворе аликвотную часть его (по указанию преподавтеля) вводят в мерную колбу (готовят растворы для 3 – 5 повторных опытов). Содержание салициловой кислоты в приготовленных растворах определяют с использованием поcтроенной ранее калибровки. По 5 полученным результатам рассчитывают среднее значение содержания салициловой кислоты в исходном растворе (в мкг/мл) и доверительный интервал (интервал неопределенности).
Список литературы для подготовки
1. Справочник по аналитической химии. Лурье Ю.Ю. – М.: Химия, 1989 г.
2. Практикум по физико-химическим методам анализа. Учебное пособие\под редакцией Петрухина О.М., 2006.
Дополнительная:
3. Петрухин О.М.(ред.), Аналитическая химия. Физические и физико-химические методы анализа. Учебник для вузов - М.: Химия, 2001. – 497 с.
4. Отто М. Современные методы аналитичской химии (в 2-х томах). Учебник. – М.: Техносфера, 2008. – 544 с.
5. Кристиан Г. Аналитическая химия (в 2-х томах). Учебник. – М: Лаборатория знаний, 2013, том 1 - 623 c., том 2 - 504 с.
