
Коллоидная химия
Агрегатные состояния вещества.
В этом разделе мы рассмотрим агрегатные состояния, в которых пребывает окружающая нас материя и силы взаимодействия между частицами вещества, свойственные каждому из агрегатных состояний.
Принято считать, что вещество может находиться в одном из трёх агрегатных состояниях:
1. Состояние твёрдого тела,
2. Жидкое состояние и
3. Газообразное состояние.
Часто выделяют четвёртое агрегатное состояние – плазму.
Иногда, состояние плазмы считают одним из видов газообразного состояния.
Плазма — частично или полностью ионизированный газ, чаще всего существующий при высоких температурах.
Плазма является самым распространённым состоянием вещества во вселенной, поскоьку материя звёд пребывает именно в этом состоянии.
Для каждого агрегатного состояния характерны особенности в характере взаимодействия между частицами вещества, что влияет на его физические и химические свойства.
Каждое вещество может пребывать в разных агрегатных состояниях. При достаточно низких температурах все вещества находятся в твёрдом состоянии. Но по мере нагрева они становятся жидкостями, затем газами. При дальнейшем нагревании они ионизируются (атомы теряют часть своих электронов) и переходят в состояние плазмы.

Газ
Газообразное состояние (от нидерл. gas, восходит к др.-греч. Χάος) характеризующееся очень слабыми связями между составляющими его частицами.
Образующие газ молекулы или атомы хаотически движутся и при этом преобладающую часть времени находятся на больших (в сравнении с их размерами) растояниях друг от друга. Вследствие этого силы взаимодействия между частицами газа пренебрежимо малы.
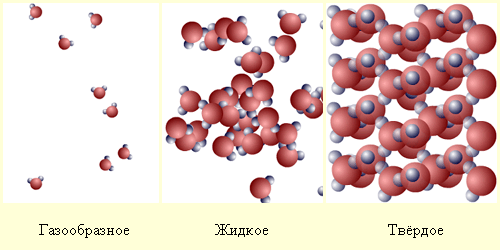
Основной особенностью газа является то, что он заполняет все доступное пространство, не образуя поверхности. Газы всегда смешиваются. Газ — изотропное вещество, то есть его свойства не зависят от направления.
При отсутствии сил тяготения давление во всех точках газа одинаково. В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь с высотой. Соответственно, в поле сил тяжести смесь газов становится неоднородной. Тяжелые газы имеют тенденцию оседать ниже, а более легкие — подниматься вверх.
Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении температуры расширяются.
При сжатии газ может перейти в жидкость, но конденсация происходит не при любой температуре, а при температуре, ниже критической температуры. Критическая температура является характеристикой конкретного газа и зависит от сил взаимодействия между его молекулами. Так, например, газ гелий можно ожижить только при температуре, ниже от 4,2 К.
Существуют газы, которые при охлаждении переходят в твердое тело, минуя жидкую фазу. Превращения жидкости в газ называется испарением, а непосредственное превращение твердого тела в газ — сублимацией.
Твёрдое тело
Состояние твёрдого тела в сравнении с другими агрегатными состояниямихарактеризуется стабильностью формы.
Различают кристаллические и аморфные твёрдые тела.
Кристаллическое состояние вещества
Стабильность формы твёрдых тел связана с тем, что большинство, находящихся в твёрдом состоянии имеет кристалическое строение.
В этом случае расстояния между частицами вещества малы, а силы взаимодействия между ними велики, что и определяет стабильность формы.
В кристаллическом строении многих твёрдых тел легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов и пр.) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствии различного отражения ими света.
В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Формы кристаллов
Каждое вещество образует кристаллы совершенно определённой формы.
Разнообразие кристаллических форм может быть сведено к семи группам:
1. Триклинная (параллелепипед),
2. Моноклинная (призма с параллелограммом в основании),
3. Ромбическая (прямоугольный параллелепипед),
4. Тетрагональная (прямоугольный параллелепипед с квадратом в основании),
5. Тригональная,
6. Гексагональная (призма с основанием правильного центрированного шестиугольника),
7. Кубическая (куб).

Многие вещества, в частности железо, медь, алмаз, хлорид натрия кристализуются вкубической системе. Простейшими формами этой системы являются куб, октаэдр, тетраэдр.
Магний, цинк, лёд, кварц кристализуются в гексагональной системе. Основные формы этой системы – шестигранные призмы и бипирамида.
Природные кристаллы, а также кристаллы, получаемые искусственным путём, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной.
Однако как бы неравномерно не происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла у одного и того же вещества остаются постоянными.
Анизотропия
Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств – прочность, теплопроводность, отношение к свету и др. – не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией.
Внутреннее строение кристаллов. Кристаллические решётки.
Внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, - молекул, атомов или ионов.
Это расположение можно представить в виде кристаллической решётки – пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий – узлах решётки – лежат центры частиц.

В зависимости от природы частиц, находящихся в узлах кристаллической решётки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают следующие виды кристаллических решёток:
1. молекулярные,
2. атомные,
3. ионные и
4. металлические.
Молекулярные и атомные решётки присущи веществам с ковалентной связью, ионные – ионным соединениям, металические – металам и их сплавам.
Атомные кристаллические решётки
В узлах атомных решёток находятся атомы. Они связаны друг с другомковалентной связью.
Веществ, обладающих атомными решётками, сравнительно мало. К ним принадлежаталмаз, кремний и некоторые неорганические соединения.
Эти вещества характеризуются высокой твёрдостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства объясняются прочностьюковалентной связи.
Молекулярные кристаллические решётки
В узлах молекулярных решёток находятся молекулы. Они связаны друг с другоммежмолекулярными силами.
Веществ с молекулярной решёткой очень много. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью имногие неорганические соединения.
Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твёрдость, легкоплавки и летучи.
Ионные кристаллические решётки
В узлах ионных решёток располагаются, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силамиэлектростатического притяжения.
К соединениям с ионной связью, образующим ионные решётки, относится большинство солей и небольшое число оксидов.
По прочности ионные решётки уступают атомным, но превышают молекулярные.
Ионные соединения имеют сравнительно высокие температуры плавления. Летучесть их в большинстве случаев не велика.
Металлические кристаллические решётки
В узлах металлических решёток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны.

Наличием свободных электронов в кристаллических решётках металлов можно объяснить их многие свойства: пластичность, ковкость, металлический блеск, высокую электро- и теплопроводность
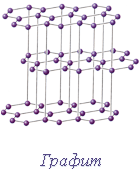
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью, а в других – металлической. Поэтому решётку графита можно рассматривать и как атомную, и как металлическую.
Во многих неорганических соединениях, например, в BeO, ZnS, CuCl, связь между частицами, находящимися в узлах решётки, является частично ионной, а частичноковалентной. Поэтому решётки подобных соединений можно рассматривать как промежуточные между ионными и атомными.
Аморфное состояние вещества
Свойства аморфных веществ
Среди твёрдых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то его излом окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями.
Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называется аморфным.
Различие между кристаллическими и аморфными телами особенно резко проявляется в их отношении к нагреванию.
В то время как кристаллы каждого вещества плавятся при строго определённой температуре и при той же температуре происходит переход из жидкого состояния в твёрдое, аморфные тела не имеют постоянной температуры плавления. При нагревании аморфное тело постепенно размягчается, начинает растекаться и, наконец, становится совсем жидким. При охлаждении оно также постепенно затвердевает.
В связи с отсутствием определённой температуры плавления аморфные тела обладают другой способностью: многие из них подобно жидкостям текучи, т.е. при длительном действии сравнительно небольших сил они постепенно изменяют свою форму. Например, кусок смолы, положенный на плоскую поверхность, в теплом помещении на несколько недель растекается, принимая форму диска.
Строение аморфных веществ
Различие между кристаллическим и аморфным состоянием вещества состоит в следующем.
Упорядоченное расположение частиц в кристалле, отражаемое элементарной ячейкой, сохраняется на больших участках кристаллов, а в случае хорошо образованных кристаллов – во всём их объёме.
В аморфных телах упорядоченность в расположении частиц наблюдается только на очень малых участках. Кроме того, в ряде аморфных тел даже эта местная упорядоченность носит лишь приблизительный характер.

Это различие можно коротко сформулировать следующим образом:
структура кристаллов характеризуется дальним порядком,
структура аморфных тел – ближним.
Примеры аморфных веществ.
К стабильно-аморфным веществам принадлежат стекла (искусственные и вулканические), естественные и искусственные смолы, клеи, парафин, воск и др.
Переход из аморфного состояния в кристаллическое.
Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состоянии. Диоксид кремния SiO2 встречается в природе в виде хорошо образованныхкристаллов кварца, а также в аморфном состоянии (минерал кремень).
При этом кристаллическое состояние всегда более устойчиво. Поэтому самопроизвольный переход из кристаллического вещества в аморфное невозможен, а обратное превращение – самопроизвольный переход из аморфного состояния в кристаллическое – возможно и иногда наблюдается.
Примером такого превращения служит расстеклование – самопроизволная кристаллизация стекла при повышенных температурах, сопровождающаяся его разрушением.
Аморфное состояние многих веществ получается при высокой скорости затвердевания (остывания) жидкого расплава.
У металлов и сплавов аморфное состояние формируется, как правило, если расплав охлаждается за время порядка долей-десятков миллисекунд. Для стёкол достаточно намного меньшей скорости охлаждения.
Кварц (SiO2) также имеет низкую скорость кристаллизации. Поэтому отлитые из него изделия получаются аморфными. Однако природный кварц, имевший сотни и тысячи лет для кристаллизации при остывании земной коры или глубинных слоёв вулканов, имеет крупнокристаллическое строение, в отличие от вулканического стекла, застывшего на поверхности и поэтому аморфного.
Жидкости
Жидкость – промежуточное состояние между твёрдым телом и газом.
Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам, по другим – к твёрдым телам.
С газами жидкости сближает, прежде всего, их изотропность и текучесть. Последняя обуславливает способность жидкости легко изменять свою форму.
Однако высокая плотность и малая сжимаемость жидкостей приближает их ктвёрдым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жёстких сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объём, указывает на присутствие хотя и не жёстких, но всё же значительных сил взаимодействия между частицами.
Соотношение потенциальной и кинетической энергии.
Для каждого агрегатного состояния характерно своё соотношение между потенциальной и кинетической энергиями частиц вещества.
У твёрдых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твёрдых телах частицы занимают определённые положения друг относительно друга и лишь колеблются относительно этих положений.
Для газов соотношение энергий обратное, вследствии чего молекулы газов всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объём.
В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жёстко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объём.
Стуктуры жидкостей и аморфных тел схожи.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок – число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всём объёме жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры.
При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика.
С ростом температуры она падает и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствии сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твёрдым телам относят только вещества в кристаллическом состоянии.
Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах в отличие от обычных жидкостей частицы имеют незначительную подвижность – такую же как в кристаллах.
Силы межмолекулярного взаимодействия.
Когда вещество находится в газообразном состоянии, тогда образующие его частицы – молекулы или атомы – хаотически движутся и при этом преобладающую часть времени находятся на больших расстояниях (в сравнении с их собственными размерами) расстояниях друг от друга. Вследствии этого силы взаимодействия между ними пренебрежимо малы.
Иначе обстоит дело, когда вещество находится в конденсированном состоянии– в жидком или твёрдом. Здесь расстояния между частицами вещества малы исилы взаимодействия между ними велики. Эти силы удерживают частицы жидкости или твёрдого тела друг около друга. Поэтому вещества в конденсированном состоянии имеют, в отличии от газов, постоянный при данной температуре объём.
Все силы, удерживающие частицы жидкости или твёрдого тела друг около друга, имеют электрическую природу. Но в зависимости от того, что представляют собой частицы – являются ли они атомами металического или неметалического элемента, ионами или молекулами – эти силы существенно различны.
Неметалы с атомным строением
Если вещество состоит из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью.
Металлы
Если вещество – металл, то часть электронов его атомов становится общими для всех атомов. Эти электроны свободно движутся между атомами, связывая их друг с другом.
Вещества с ионным строением
Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического притяжения.
Вещества с молекулярным строением
В веществах с молекулярным строением имеет место межмолекулярное взаимодействие.
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
1. Ориентационное взаимодействие.
Если вещество состоит из полярных молекул, например, Н2О, НCl, то в конденсированном состоянии молекулы ориентируются друг по отношению к другу своими разноимённо заряженными концами, вследствии чего наблюдается их взаимное притяжение.
Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует их взаимной ориентации, поэтому с ростом температуры ориентационный эффект ослабевает.
2. Индукционное взаимодействие.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например СО2, наблюдается возникновение наведённых илииндуцированных диполей.
Причина их появления обычно состоит в том, что каждый атом создаёт вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы.
В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
3. Дисперсионное взаимодействие.
Дисперсионные силы (Лондоновские силы) — силы электростатического притяжения мгновенного и индуцированного (наведённого) диполей электрически нейтральных атомов или молекул.
В атомах и молекулах электроны сложным образом движутся вокруг ядер. Всреднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей.
Считается, что дисперсионная энергия не имеет классического аналога и определяется квантовомеханическими флуктуациями электронной плотности.
Как показывает квантовая механика, мгновенные диполи возникают в твёрдых телах и жидкостях согласованно, причём концы соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению.
Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обуславливает переход благородных газов при низких температурах в жидкое состояние.
Соотношение молекулярных сил.
Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества.
Чем больше полярность молекул, тем больше ориентационные силы.
Чем крупнее атомы, чем слабее связаны внешние электроны атомов, чем больше деформируется электронное облако, тем значительнее дисперсионные силы.
Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих размеры этих веществ.
Например:
в случае HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия,
для НBr эта величина составляет 95%,
для HI - 99,5%.
Индукционные силы почти всегда малы.
Свойства жидкостей
Характеристика жидкого состояние вещества.
Жидкость – промежуточное состояние между твёрдым телом и газом.
Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам, по другим – к твёрдым телам.
С газами жидкости сближает, прежде всего, их изотропность и текучесть. Последняя обуславливает способность жидкости легко изменять свою форму.
Однако высокая плотность и малая сжимаемость жидкостей приближает их к твёрдым телам.
Жидкость может обнаруживать механические свойства, присущие твёрдому телу. Если время действия силы на жидкость мало, то жидкость проявляет упругие свойства. Например, при резком ударе палкой о поверхность воды палка может вылететь из руки или сломаться.
Камень можно бросить так, что он при ударе о поверхность воды отскакивает от неё, и лишь совершив несколько скачков, тонет в воде.
Если же время воздействия на жидкость велико, то вместо упругости проявляетсятекучесть жидкости. Например, рука легко проникает внутрь воды.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жёстких сил межмолекулярного взаимодействия.
В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объём, указывает на присутствиехотя и не жёстких, но всё же значительных сил взаимодействия между частицами.
Соотношение потенциальной и кинетической энергии
Для каждого агрегатного состояния характерно своё соотношение между потенциальной и кинетической энергиями частиц вещества.
У твёрдых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твёрдых телах частицы занимают определённые положения друг относительно друга и лишь колеблются относительно этих положений.
Для газов соотношение энергий обратное, вследствии чего молекулы газов всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объём.
В случае жидкостей кинетическая и потенциальная энергия частиц приблизительно одинаковы, т.е. частицы связаны друг с другом, но не жёстко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объём.
Взаимодействие частиц, образующих жидкость
Расстояния между молекулами жидкости меньше радиуса молекулярного действия.
Если вокруг молекулы жидкости описать сферу молекулярного действия, то внутри этой сферы окажутся центры многих других молекул, которые будут взаимодействовать с нашей молекулой. Эти силы взаимодействия удерживают молекулу жидкости около её временного положения равновесия примерно в течение 10-12 – 10-10 с, после чего она перескакивает в новое временное положение равновесия приблизительно на расстояние своего диаметра.
Молекулы жидкости между перескоками совершают колебательное движение около временного положения равновесия.
Время между двумя перескоками молекулы из одного положения в другое называется временем оседлой жизни. Это время зависит от вида жидкости и температуры. При нагревании жидкости среднее время оседлой жизни молекул уменьшается.
В течение времени оседлой жизни (порядка 10-11 с) большинство молекул жидкости удерживается в своих положениях равновесия, и лишь небольшая часть их успевает за это время перейти в новое положение равновесия.
За более длительное время уже большинство молекул жидкости успеет переменить своё местоположение.
Так как молекулы жидкости расположены почти вплотную друг к другу, то получив достаточно большую кинетическую энергию, они хотя и могут преодолеть притяжение своих ближайших соседей и выйти из сферы их действия, но попадут в сферу действия других молекул и окажутся в новом временном положении равновесия.
Лишь находящиеся на свободной поверхности жидкости молекулы могут вылететь за пределы жидкости, чем и объясняется процесс её испарения.
Если в жидкости выделить очень малый объём, то в течение времени оседлой жизни в нём существует упорядоченное расположение молекул, подобное их расположению в кристаллической решётке твёрдого тела. Затем оно распадается, но возникает в другом месте. Таким образом, всё пространство, занятое жидкостью, как бы состоит из множества зародышей кристаллов, которые, однако, не устойчивы, т.е. распадаются в одних местах, но снова возникают в других.
Стуктуры жидкостей и аморфных тел схожи
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок – число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всём объёме жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры.
При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика.
С ростом температуры она падает и по мере нагревания свойства жидкости всё больше и больше приближаются к свойствам газа. При достижении критической температуры различие между жидкостью и газом исчезает.
Вследствии сходства во внутренней структуре жидкостей и аморфных тел последние часто рассматриваются как жидкости с очень высокой вязкостью, а к твёрдым телам относят только вещества в кристаллическом состоянии.
Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах в отличие от обычных жидкостей частицы имеют незначительную подвижность – такую же как в кристалах.
Поверхностное натяжение жидкости.
Поверхностный слой жидкости.
Все жидкости и твёрдые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, с паром, другой жидкостью или твёрдым телом.
Свойства вещества в этой межфазовой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объёма фазы.
Внутри объёма чистого вещества в твёрдом, жидком или газообразном состоянии любая молекула окружена себе подобными молекулами.
В пограничном слое молекулы находятся во взаимодействии или с другим числом молекул (другим в сравнении с взаимодействием внутри объёма вещества). Это происходит, например, на границе жидкости с их паром.
Среднее значение равнодействующей молекулярных сил притяжения, приложенных к молекуле, которая находится внутри жидкости, близко к нулю. На рисунке ниже эта молекула обозначена М1.
Случайные флуктуации этой равнодействующей заставляют молекулу М1 совершать лишь хаотическое движение внутри жидкости.

Иначе обстоит дело с молекулами, находящимися в поверхностном слое жидкости.
Рассмотрим молекулу, находящуюся непосредственно на границе раздела фаз. На рисунке обозначим её М2.
Если вокруг молекулы М2 описать сферу молекулярного действия, то внутри этой сферы окажутся центры многих других молекул, которые будут взаимодействовать с нашей молекулой. Радиус такой сферы составляет примерно 10-9 м.
Для молекулы М2 в нижней полусфере окажется много молекул, а в верхней – значительно меньше, так как снизу находится жидкость, а сверху – пар или воздух.
Поэтому для молекулы М2 равнодействующая молекулярных сил притяжения в нижней полусфере много больше равнодействующей молекулярных сил в верхней полусфере. Силы, действующие в верхней полусфере так малы, что ими можно пренебречь.
Если рассмотреть ещё одну молекулу, которая, в сравнении с М2 будет немного больше «утоплена» в жидкость, но также находится в поверхностном слое. Обозначим её М3.
Поскольку в верней полусфере М3 будут находиться другие молекулы жидкости, то они будут притягивать М3 к себе и частично уравновешивать силы притяжение молекул, находящихся в нижней полусфере М3.
В результате общая равнодействующая сил, действующих на М3 окажется меньше общей равнодействующей М2.
Обе равнодействующие будут направлены внутрь жидкости перепендикулярно к её поверхности.
Таким образом, все молекулы жидкости, находящиеся в поверхностном слое толщиной, равной радиусу молекулярного действия, втягиваются внутрь жидкости.
Но пространство внутри жидкости занято другими молекулами, поэтомуповерхностный слой создаёт давление на жидкость, которое называют молекулярным давлением.
Энергия поверхностного слоя жидкости.
Поскольку молекулы жидкости, находящиеся в её поверхностном слое, втягиваются внутрь жидкости, их потенциальная энергия больше, чем у молекул внутри жидкости.
Эту дополнительную потенциальную энергию молекул поверхностного слоя жидкости называют свободной энергией. За счёт неё может быть произведена работа, связанная с уменьшением свободной поверхности жидкости.
И, наоборот, для того, чтобы вывести молекулы, находящиеся внутри жидкости, на её поверхность, нужно преодолеть противодействие молекулярных сил, т.е. произвести работу, которая нужна для увеличения свободной энергии поверхностного слоя жидкости.
При этом, изменение свободной энергии прямо пропорционально изменению площади поверхности жидкости.
Так как всякая система самопроизвольно переходит в состояние, при котором её потенциальная энергия минимальна, то жидкость должна самопроизвольно переходить в такое состояние, при котором площадь её свободной поверхности имеет наименьшую величину.
Например, капля дождя или тумана в воздухе приобретают форму шара, форму, соответствующую наименьшему уровню свободной энергии.
Коэффициент поверхностного натяжения
Коэффициент поверхностного натяжения – это величина, характеризующая зависимость работы молекулярных сил, идущих на изменение площади свободной поверхности жидкости и самой площади изменения этой поверхности.
σ = А/ΔS
σ - коэффициент поверхностного натяжения
А – работа молекулярных сил по изменению площади поверхности жидкости
ΔS - изменение площади поверхности жидкости
σ измеряется работой молекулярных сил при уменьшении площади свободной поверхности жидкости на единицу.
Коэффициент поверхностного натяжения зависит от рода жидкости и внешних условий, например, температуры.
Сила поверхностного натяжения
Молекула М1, которая расположена на поверхности жидкости, взаимодействует не только с молекулами, находящимися внутри жидкости, но и с молекулами на поверхности жидкости, расположенными в пределах сферы молекулярного действия.

Для молекулы М1 равнодействующая R молекулярных сил, направленных вдоль поверхности жидкости, равна нулю, а для молекулы М2, расположенной у края поверхности, R отлична от нуля.
Из рисунка видно, что сила R направлена перпендикулярно к границе свободной поверхности и по касательной к самой поверхности.
Молекулярные силы, направленные вдоль поверхности жидкости, действуют на любую замкнутую линию на свободной поверхности жидкости по нормали к этой линии таким образом, что стремятся сократить площадь поверхности жидкости, ограниченную замкнутой линией.
Это можно показать на следующем опыте.
На проволочном кольце укрепляется нитка длиной L.

Если затянуть кольцо мыльной плёнкой, то нитка свободно расположится на этой плёнке (Рис. А). Площадь поверхности мыльной плёнки будет определяться контуром рамки.
Если прорвать мыльную плёнку с нижней стороны нитки, то молекулярные силы сократят поверхность, огрниченную теперь верхней частью контура и ниткой. При этом нитка натянется (Рис. В).
Сила, обусловленная взаимодействием молекул жидкости, вызывающая сокращение площади её свободной поверхности и направленная по касательной к этой поверхности, называется силой поверхностного натяжения.
Силы молекулярного давления втягивают молекулы с поверхности внутрь жидкости, а силы поверхностного натяжения сокращают площадь свободной поверхности, т.е. закрывают образовавшиеся «окна» на этой поверхности.
Итак, поверхностный слой жидкости всегда находится в состоянии натяжения. Однако, это состояние нельзя сравнивать с натяжением упругой растянутой плёнки. Упругие силы возрастают по мере увеличения площади растянутой плёнки, а силы поверхностного натяжения от площади поверхности жидкости не зависят.
Опыт показывает, что на на коэффициент поверхностного натяжения влияет среда и температура жидкости. При повышении температуры жидкости еёповерхностное натяжение уменьшается и при критической температуре становится равной нулю.
Растворы.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства одного раствора во всех частях его объёма одинаковы.
В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Часто для определения раствора используют понятия гомогенной и системы.
В этом случае, раствором называется гомогенная система, состоящая из двух или более компонентов.
Гомогенные и гетерогенные системы
Гомогенная система (от греч. όμός — равный, одинаковый; γένω — рождать) — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях – твёрдом, жидком и газообразном (парообразном). Примерами твёрдых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.).
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Онигетерогенны, так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
Растворы высокомолекулярных соединений: белков, полисахаридов, каучука обладают свойствами как истинных, так и коллоидных растворов и выделяются в особую группу.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов). В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.

Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем большеконцентрация раствора. А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливаетсядинамическое равновесие, при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.
![]()
Раствор, находящийся в равновесии с растворяющимся веществом, называетсянасыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называютсяконцентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым.
Если растворяется менее 1 г вещества – малорастворимым.
Если в раствор переходит менее 0,01 г вещества, то такое вещество называют практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества, состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
Гидраты и сольваты.
При растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами (от латинского solvere – растворять). Этот процесс называется сольватацией.
В частном случае, когда растворителем является вода, эти соединения называютсягидратами, а самый процесс их образования – гидратацией.
В зависимости от природы растворённого вещества, сольваты могут образовываться разными путями.
1. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. В этом случае говорят о ион-дипольном взаимодействии.
2. Может иметь место донорно-акцепторное взаимодействие. Здесь ионы растворённого вещества обычно выступают в качестве акцепторов, а молекулы растворителя – в качестве доноров электронных пар. В таком взаимодействии могут участвовать растворители, молекулы которых обладают неподеленными электронными парами (например, вода, аммиак).
3. При растворении веществ с молекулярной структурой сольваты образуются вследствие диполь-дипольного взаимодействия. Диполи растворённого вщества могут быть при этом постоянными (у веществ с полярными молекулами) или наведёнными (у веществ с неполярными молекулами).
Кристаллогидраты
Вещества, в кристаллы которых входят молекулы воды, называютсякристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат.
Примеры:
кристаллогидрат сульфата меди (медный купорос), содержащий одну грамм- молекулу CuSO4 и пять грамм-молекул воды, изображается формулой CuSO4 · 5 H2O;
кристаллогидрат сульфата натрия (глауберова соль) изображается формулой Na2SO4 · 10H2O.
Алюмокалиевые квасцы могут изображаться формулой: K2SO4 · Al2(SO4)3 · 24H2O или после сокращения на два: KAl(SO4)2 · 12H2O
Свойства гидратов
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов.
Но иногда гидраты настолько прочны, что при выделении растворённого вещества из раствора вода входит в состав его кристаллов.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре.
Так, прозрачные кристаллы «бельевой» соды (Na2СO3 · 10H2O), если оставить их лежать на воздухе, очень легко «выветриваются», т.е., теряя воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание.
Тепловые эффекты растворения и гидратации
Растворение
Количество теплоты, поглощающейся (или выделяющейся) при растворении одной грам-молекулы вещества, называется теплотой растворения этого вещества.
Теплота растворения имеет отрицательное значение, если при растворении теплота поглощается, и положительное – при выделении теплоты. Например, теплота растворения нитрата аммония равна –6,32 ккал/моль, гидрооксида калия +13,3 ккал/моль.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко возрастает число микросостояний системы. Поэтому, несмотря на эндотермичность растворения большинства кристаллов, изменение изобарного потенциала системы отрицательно и растворение протекает самопроизвольно.
При растворении кристаллов происходит их разрушение и распределение молекул (или ионов) по всей массе растворителя, что требует затраты энергии. Поэтому растворение должно сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением идёт другой процесс.
Гидратация
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается их теплового эффекта собственно растворения и теплового эффекта гидратации.
Поскольку первый из этих процессов эндотермичен, а второй экзотермичен, то общий тепловой эффект процесса растворения, равный алгебраической сумме отдельных процессов, может быть как положительным, так и отрицательным.
Дисперсные системы. Определение. Классификация.
Растворы
В предыдущем параграфе мы говорили о растворах. Здесь коротко напомним об этом понятии.
Растворами называют однородные (гомогенные) системы, состоящие из двух и более компонентов.
Гомогенная система – это однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
Такое определение раствора не вполне корректно. Оно скорее относится к истинным растворам.
В тоже время существуют ещё коллоидные растворы, которые являются не гомогенными, а гетерогенными, т.е. состоят из разных фаз, разделённых поверхностью раздела.
Для того чтобы достичь большей чёткости в определениях используют другой термин –дисперсные системы.
Перед рассмотрением дисперсных систем немного расскажем об истории их изучения и о появления такого термина как коллоидные растворы.
История вопроса
Ещё в 1845 г. химик Франческо Сельми, исследуя свойства различных растворов, заметил, что биологические жидкости – сыворотка и плазма крови, лимфа и другие – резко отличаются по своим свойствам от обычных истинных растворов, и поэтому такие жидкости были им названы псевдорастворами.
Коллоиды и кристаллоиды
Дальнейшие исследования в этом направлении, проводившиеся с 1861 г. английским учёным Томасом Грэмом, показали, что одни вещества, быстро диффундирующие и проходящие через растительные и животные мембраны, легко кристаллизуются, другие же обладают малой способностью к диффузии, не проходят через мембраны и не кристаллизуются, а образуют аморфные осадки.
Первые Грэм назвал кристаллоидами, а вторые – коллоидами (от греческого слова kolla – клей и eidos – вид) или клееподобными веществами.
В частности, было выявлено, что вещества, способные к образованию аморфных осадков, как, например, альбумин, желатин, гуммиарабик, гидроокиси железа и алюминия и некоторые другие вещества, диффундируют в воде медленно по сравнению со скоростью диффузии таких кристаллических веществ, как поваренная соль, сернокислый магний, тростниковый сахар и др.
С.В таблице ниже приведены коэффициенты диффузии D для некоторых кристаллоидов и коллоидов при 18
Кристаллоиды |
Молекулярный вес |
D·107 см2/сек |
Коллоиды |
Молекулярный вес |
D·107 см2/сек |
Глюкоза |
180 |
57,0 |
Пепсин |
35000 |
7,0 |
Рафиноза |
504 |
35,5 |
Яичный альбумин |
45000 |
5,9 |
Из таблицы видно, что между молекулярным весом и коэффициентом диффузии существует обратная зависимость.
Кромме того у кристаллоидов была обнаружена способность не только быстро диффундировать, но и диализироваться, т.е. проходить через мембранны, в противоположность коллоидам, имеющим больший размер молекул и поэтому медленно диффундирующим и не проникающим через мембраны.
В качестве мембран используют стенки бычьего пузыря, целлофан, плёнки из железисто-синеродистой меди и т.д.
На основании сделанных наблюдений Грэм установил, что все вещества могут быть подразделены на кристаллоиды и коллоиды.
Русские не согласны
Против такого строго разделения химических веществ возражал профессор Киевского университета И.Г. Борщёв (1869). Мнение Борщёва позднее было подтвеждено исследованиями другого русского учёного Веймарна, который доказал, что одно и то же вещество в зависимости от условий может проявлять свойства коллоидов или кристаллоидов.
Так, например, раствор мыла в воде обладает свойствами коллоида, а мыло, растворённое в спирте, проявляет свойства истинных растворов.
Точно также кристаллические соли, например, поваренная соль, растворённая в воде, даётистинный раствор, а в бензоле – коллоидный раствор и т.п.
Гемоглобин же или яичный альбумин, обладающие свойствами коллоидов, могут быть получены в кристаллическом состоянии.
Д.И. Менделеев полагал, что любое вещество, в зависимости от условий и природы среды, может проявлять свойства коллоида. В настоящее время любое вещество можно получить в коллоидном состоянии.
Таким образом, нет оснований подразделять вещества на два обособленных класса – на кристаллоиды и коллоиды, а можно говорить о коллоидном и кристаллоидном состоянии вещества.
Под коллоидным состоянием вещества подразумевается определённая степень его раздробленности или дисперсности и нахождении коллоидных частиц во взвешенном состоянии в растворителе.
Наука, изучающая физико-химические свойства гетерогенных высокодисперсных и высокомолекулярных систем называется коллоидной химией.
Дисперсные системы
Если одно вещество, находящееся в раздробленном (диспергированном) состоянии, равномерно распределено в массе другого вещества, то такую систему называют дисперсной.
В таких системах раздробленное вещество принято называть дисперсной фазой, а среду, в которой она распределена, - дисперсионной средой.
Так, например, система, представляющая собой взмученную глину в воде, состоит из взвешенных мелких частиц глины – дисперсной фазы и воды – дисперсионной среды.
Дисперсные (раздробленные) системы являются гетерогенными.
Дисперсные системы, в отличие от гетерогенных с относительно крупными, сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называютультрамикрогетерогенными.
Классификация дисперсных систем
Классификацию дисперсных систем чаще всего производят исходя из степени дисперсности или агрегатного состояния дисперсной фазы и дисперсионной среды.
Классификация по степени дисперсности
Все дисперсные системы по величине частиц дисперсной фазы можно разделить на следующие группы:
Вид дисперсности |
Размер частиц |
Микроскопическая дисперсность (суспензии, эмульсии) |
10-2 - 10-4 |
Коллоидная дисперсность |
10-5 - 10-7 |
Молекулярная дисперсность |
10-8 - 10-9 |
Ионная дисперсность |
10-10 |
Для справки прводим единицы размеров в системе СИ: 1 м (метр) = 102 см (сантиметра) = 103 мм (миллиметра) = 106 мкм (микрометра) = 109 нм (нанометра). Иногда применяют другие единицы – мк (микрон) или ммк (миллимикрон), причём: 1 нм = 10-9 м =10-7 см = 1 ммк; 1 мкм = 10-6 м = 10-4 см = 1 мк.
Грубодисперсные системы.
Эти системы содержат в качестве дисперсной фазы наиболее крупные частицы диаметром от0,1 мк и выше. К этим системам относятся суспензии и эмульсии.
Суспензиями называют системы, в которых твёрдое вещество находится в жидкой дисперсионной среде, например, взвесь крахмала, глины и др. в воде.
Эмульсиями называют дисперсионные системы двух несмешивающихся жидкостей, где капельки одной жидкости во взвешенном состоянии распределены в объёме другой жидкости. Например, масло, бензол, толуол в воде или капельки жира (диаметром от 0,1 до 22 мк) в молоке и др.
Коллоидные системы.
Они имеют размеры частиц дисперсной фазы от 0,1 мк до 1 ммк (или от 10-5 до 10-7 см). Такие частицы могут проходить через поры фильтровальной бумаги, но не проникают через поры животных и растительных мембран.
Коллоидные частицы при наличии у них электрического заряда и сольватно-ионных оболочек остаются во взвешенном состоянии и без изменения условий очень долго могут не выпадать в осадок.
Примерами коллоидных систем могут служить растворы альбумина, желатина, гуммиарабика, коллоидные растворы золота, серебра, сернистого мышьяка и др.
Молекулярно-дисперсные системы.
Такие системы имеют размеры частиц, не превышающие 1ммк. К молекулярно-дисперсным системам относятся истинные растворы неэлектролитов.
Ионно-дисперсные системы.
Это растворы различных электролитов, как, например, солей, оснований и т.д., распадающихся на соответствующие ионы, размеры которых весьма малы и выходят далеко за пределы 10-8 см.
Уточнение по повду представления истинных растворов как дисперсных системах. Из приведённой здесь классификации видно, что любой раствор (как истинный, так и коллоидный) можно представить как дисперсную среду. Истинные и коллоидные растворы будут различаться размерами частиц дисперсных фаз. Но выше мы писали о гомогенности истинных растворов, а дисперсионные системы гетерогенны. Как разрешить это противоречие? Если говорить о структуре истинных растворов, то их гомогенность будет относительной. Структурные единицы истинных растворов (молекулы или ионы) значительно меньше частиц коллоидных растворов. Поэтому, можно сказать, что по сравнению с коллоидными растворами и взвесями, истинные растворы гомогенны. Если же говорить о свойствах истинных растворов, то их нельзя в полной мере называть дисперсными системами, поскольку обязательным существованием дисперсных систем является взаимная нерастворимость диспергированного вещества и дисперсионной среды. В коллоидных растворах и грубых взвесях дисперсная фаза и дисперсионная среда практически не смешиваются и не реагируют друг с другом химически. Этого совсем нельзя сказать об истинных растворах. В них при растворении вещества смешиваются и даже взаимодействуют друг с другом. По этой причине коллоидные растворы резко отличаются по свойствам от истинных растворов.
Размеры некоторых молекул, частиц, клеток.
Объект |
Размеры (ммк) |
Атом водорода |
0,01 |
Ион натрия |
0,26 |
Молекула спирта |
0,5 |
Молекула гемоглобина |
3,5 |
Молекулы крахмала |
5,0 |
Частицы коллоидного золота |
2 - 130 |
Вирусы |
10 - 300 |
Хромосомы |
200 - 3500 |
Зёрна крахмала |
7000 |
Бактерии |
400 - 15000 |
Эритроциты |
7500 |
По мере изменения размеров частиц от наиболее крупных к мелким и обратно будут соответственно меняться и свойства дисперсных систем. При этом коллоидные системызанимают как бы промежуточное положение между грубыми взвесями и молекулярно-дисперсными системами.
Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Пены – это дисперсия газа в жидкости, причём в пенах жидкость вырождается до тонких плёнок, разделяющих отдельные пузырьки газа.
Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена другой, нерастворяющей её жидкостью (например вода в жире).
Суспензиями называют низкодисперсные системы твёрдых частиц в жидкостях.
Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем:
Дисперсная фаза |
Дисперсионная среда |
Название и пример |
Газообразная |
Газообразная |
Дисперсная система не образуется |
Газообразная |
Жидкая |
Газовые эмульсии и пены |
Газообразная |
Твёрдая |
Пористые тела: поролон пемза |
Жидкая |
Газообразная |
Аэрозоли: туманы, облака |
Жидкая |
Жидкая |
Эмульсии: нефть, крем, молоко, маргарин, масло |
Жидкая |
Твёрдая |
Капилярные системы: Жидкость в пористых телах, грунт, почва |
Твёрдая |
Газообразная |
Аэрозоли (пыли, дымы), поршки |
Твёрдая |
Жидкая |
Суспензии: пульпа, ил, взвесь, паста |
Твёрдая |
Твёрдая |
Твёрдые системы: сплавы, бетон |
Золи – другое название коллоидных растворов.
Коллоидные растворы иначе называют золями (от латинского solutus – растворённый).
Дисперсные системы с газообразной дисперсионной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдой дисперсной фазой. Дым более высокодисперсная система, чем пыль.
Дисперсные системы с жидкой дисперсионной средой называют лизолями (от греческого «лиос» – жидкость).
В зависимости от растворителя (дисперсионной среды), т.е. воды, спирта бензола или эфира и т.д., различают гидрозоли, алкозоли, бензоли, этерозоли и т.д.
Связнодисперсные системы. Гели.
Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы.
К свободнодисперсным системам относятся аэрозоли, лизоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести.

На рисунках выше изображены свободно-дисперсные системы: На рисунках а, б, в изображены корпускулярно-дисперсные системы: а,б - монодисперсные системы, в - полидисперсная система, На рисунке г изображена волокнисто-дисперсная система На рисунке д изображена плёночно-дисперсная система
Связнодисперсные системы – твердообразны. Они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки.
Такая структура ограничивает текучесть дисперсной системы и придаёт ей способность сохранять форму. Подобные структурированные коллоидные системы называются гелями.
Переход золя в гель, происходящий в результате понижения устойчивости золя, называютгелеобразованием (или желатинированием).

На рисунках а, б, в изображены связнодисперсные системы: а - гель, б - коагулят с плотной структурой, в - коагулят с рыхлой - "арочной" структурой На рисунках г, д изображены капилярнодисперсные системы
Порошки (пасты), пены – примеры связнодисперсных систем.
Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капиляры, образующие капилярнодисперсные системы. К ним относятся, например, древесина, кожа, бумага, картон, ткани.
Лиофильность и лиофобность
Общей характеристикой коллоидных растворов является свойство их дисперсной фазы взаимодействовать с дисперсионной средой. В этом отношении различают два типа золей:
1. Лиофобные (от греческого phobia – ненависть) и
2. Лиофильные (от греческого philia – любовь).
У лиофобных золей частицы не имеют сродства к растворителю, слабо с ним взаимодействуют и образуют вокруг себя тонкую оболочку из молекул растворителя.
В частности, если дисперсионной средой является вода, то такие системы называютсягидрофобными, например, золи металлов железа, золота, сернистого мышьяка, хлористого серебра и т.д.
В лиофильных системах между диспергированным веществом и растворителем имеется сродство. Частицы дисперсной фазы, в этом случае, приобретают более объёмную оболочку из молекул растворителя.
В случае водной дисперсионной среды такие системы называются гидрофильными, как, например, растворы белка, крахмала, агар-агара, гуммиарабика и др.
Коагуляция коллоидов. Стабилизаторы.
Вещество на границе раздела фаз.
Все жидкости и твёрдые тела ограничены внешней поверхностью, на которой они соприкасаются с фазами другого состава и структуры, например, с паром, другой жидкостью или твёрдым телом.
Свойства вещества в этой межфазовой поверхности, толщиной в несколько поперечников атомов или молекул, отличаются от свойств внутри объёма фазы.
Внутри объёма чистого вещества в твёрдом, жидком или газообразном состоянии любая молекула окружена себе подобными молекулами.
В пограничном слое молекулы находятся во взаимодействии или с другим числом молекул (другим в сравнении с взаимодействием внутри объёма вещества).
Это происходит, например, на границе жидкости или твёрдого тела с их паром. Либо в пограничном слое молекулы вещества взаимодействуют с молекулами другой химической природы, например, на границе двух взаимно малорастворимых жидкостей.
В результате различия в характере взаимодействия внутри объёма фаз и на границе фаз возникают силовые поля, связанные с этой неравномерностью. (Подробнее об этом в параграфе Поверхностное натяжение жидкости.)
Чем больше различие в напряжённости межмолекулярных сил, действующих в каждой из фаз, тем больше потенциальная энергия межфазовой поверхности, кратко называемойповерхностной энергией.
Поверхностное натяжение Для оценки поверхностной энергии пользуются такой величиной, как удельная свободная поверхностная энергия. Она равна работе затрачиваемой на образование единицы площади новой поверхности раздела фаз (при условии постоянной температуры). В случае границы двух конденсированных фаз эту величину называют пограничным натяжением. Когда говорят о границе жидкости с её парами, то эту величину называют поверхностным натяжением.
Коагуляция коллоидов
Все самопроизвольные процессы происходят в направлении уменьшения энергии системы (изобарного потенциала).
Аналогично, на границе раздела фаз самопроизвольно происходят процессы в направлении уменьшения свободной поверхностной энергии.
Свободная энергия тем меньше, чем меньше поверхность раздела фаз.
А поверхность раздела фаз, в свою очередь, связана со степенью дисперсности растворённого вещества. Чем выше дисперсность (мельче частицы дисперсной фазы), тем больше поверхность раздела фаз.
Таким образом, в дисперсных системах всегда существуют силы, приводящие к уменьшению суммарной поверхности раздела фаз, т.е. к укрупнению частиц. Поэтому происходит слияние мелких капель в туманах, дождевых облаках и эмульсиях – агрегация высокодисперсных частиц в более крупные образования.
Всё это приводит к разрушению дисперсных систем: туманы и дождевые облака проливаются дождём, эмульсии расслаиваются, коллоидные растворы коагулируют, т.е. разделяются на осадок дисперсной фазы (коагулят) и дисперсионную среду или в случае вытянутых частиц дисперсной фазы, превращаются в гель.
Способность раздробленных систем сохранять присущую им степень дисперсности называется агрегативной устойчивостью.
Стабилизаторы дисперсных систем
Как было сказано ранее, дисперсные системы принципиально термодинамически неустойчивы. Чем выше дисперсность, тем больше свободная поверхностная энергия, тем больше склонность к самопроизвольному уменьшению дисперсности.
Поэтому для получения устойчивых, т.е. длительно сохраняющихся суспензий, эмульсий, коллоидных растворов, необходимо не только достигнуть заданной дисперсности, но и создать условия для её стабилизации.
Ввиду этого устойчивые дисперсные системы состоят не менее чем из трёх компонентов: дисперсной фазы, дисперсионной среды и третьего компонента – стабилизатора дисперсной системы.
Стабилизатор может иметь как ионную, так и молекулярную, часто высокомолекулярную, природу.
Ионная стабилизация золей лиофобных коллоидов связана с присутствием малых концентраций электролитов, создающих ионные пограничные слои между дисперсной фазой и дисперсионной средой.
Высокомолекулярные соединения (белки, полипептиды, поливиниловый спирт и другие), добавляемые для стабилизации дисперсных систем, называют защитными коллоидами.
Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы.
Структурно-механическая стабилизация имеет решающее значение для стабилизации взвесей, паст, пен, концентрированных эмульсий.
Адсорбция.
Сорбция
Сорбцией (от латинского sorbeo – поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим (сорбентом), независимо от механизма поглощения.
В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию и капилярную конденсацию.
Адсорбция
Адсорбция это процесс, происходящий на границе раздела фаз. Он затрагиваетолько поверхностные слои, взаимодействующих фаз, и не распространяется на глубинные слои этих фаз.
Адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Абсорбция
Абсорбция, в отличии от адсорбции, это процесс захватывающий не только поверхность раздела фаз, но распространяющийся на весь объём сорбента.
Примером процесса абсорбции является растворение газов в жидкости.
Хемосорбция
Хемосорбцией называется поглощение одного вещества другим, сопровождающееся их химическим взаимодействием.
Капилярная конденсация
Капиллярная конденсация — сжижение пара в капиллярах, щелях или порах в твердых телах.
Явление конденсации отлично от физической адсорбции.
Таким образом, сорбционные процессы различны по их механизму. Однако, любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твёрдыми.
Адсорбция
Напомним, что адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Адсорбция происходит на любых межфазовых поверхностях и адсорбироваться могут любые вещества.
Адсорбционное равновесие, т.е. равновесное распределение вещества между пограничным слоем и граничащими фазами является динамическим равновесием и быстро устанавливается.
Адсорбция понижается с понижением температуры.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтивом, поглощённое — адсорбатом. Вещество, на поверхности которого происходит адсорбция – адсорбентом.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией.
Удаление адсорбированных веществ с адсорбентов при помощи растворителей называютэлюцией.
Различают молекулярную и ионную адсорбцию. Это различение происходит в зависимости от того, что адсорбируется – молекулы или ионы вещества.
Адсорбция на поверхности жидкостей
На поверхности жидкостей могут адсорбироваться частицы веществ, растворённых в жидкостях. Адсорбция сопровождает процесс растворения, влияя на распределение частичек растворённого вещества между поверхностным слоем растворителя и внутренним его объёмом.

В соответствии со вторым началом термодинамики поверхностная энергия жидкостей стремится к минимуму. В чистых растворителях уменьшение этой энергии происходит путём сокращения поверхности.
В растворах поверхностная энергия может понижаться или увеличиваться за счёт изменения концентрации частиц в поверхностном слое жидкости.
Гиббсом было установлено, что распределение растворяемого в жидкости вещества происходит так, чтобы достигалось максимальное уменьшение поверхностного натяжения.
Он же предложил уравнение, определяющее величину адсорбции Г, т.е избытка вещества, накапливающегося в 1 см2 поверхностного слоя, имеющего толщину примерно в одну молекулу, по сравнению с содержанием этого вещества в таком же объёме внутри жидкости.

Где Δσ - изменение поверхностного натяжения, соответствующее изменению концентрации ΔС. Величина Δσ/ΔС называется поверхностной активностью.
Следовательно, адсорбция Г зависит от величины поверхностной активности иконцентрации вещества С.
Если при этом поверхностное натяжение уменьшается, то адсорбция Г имеетположительное значение.
Положительная адсорбция. Поверхностно-активные вещества.
Чем сильнее вещество понижает поверхностное натяжение, тем больше оно будет накапливаться в поверхностном слое.
Концентрация растворённого вещества в поверхностном слое станет значительно выше, чем в остальном объёме жидкости. Возникающая разность концентраций неизбежно вызовет диффузию, которая будет направлена из поверхностного слоя внутрь жидкости и явится препятствием для полного перехода всех растворённых частиц в поверхностный слой. Установится подвижное адсорбционное равновесие между растворённым веществом в поверхностном слое и остальном объёме жидкости.
Адсорбцию, сопровождающуюся накоплением вещества в поверхностном слое, называют положительной. Пределом её служит полное насыщение поверхностного слоя адсорбируемым веществом.
Положительно адсорбирующиеся вещества называют также поверхностно-активными веществами (ПАВ). В водных растворах роль ПАВов будут играть вещества с жирной и дифильной природой (жиры, большинство жирных кислот, кетоны, спирты, холестерин и др.).
Отрицательная адсорбция. Поверхностно-инактивные вещества.
Если растворённое вещество увеличивает поверхностное натяжение, то оно будет выталкиваться из поверхностного слоя внутрь адсорбента. Такую адсорбцию называют отрицательной.
Пределом отрицательной адсорбции является полное вытеснение адсорбтива из поверхностного слоя внутрь адсорбента (растворителя).
В результате разности концентраций возникнет диффузия, которая будет направлена в поверхностный слой. Поэтому в поверхностном слое всегда окажется некоторое количество адсорбтива.
Вещества, резко повышающие поверхностное натяжение, почти не содержатся в поверхностном слое разбавленных растворов. Лишь значительное увеличение концентрации подобных растворов приводит к перемещению в поверхностный слой заметных количеств растворённого вещества, что сопровождается увеличением поверхностного натяжения.
Отрицательно адсорбирующиеся вещества называются поверхностно-инактивными.
Адсорбция и поверхносное натяжение биологических жидкостей
Отрицательная и положительная адсорбция различных веществ в крови и протоплазме клеток имеет большое значение для обмена веществ в живых организмах.
Поверхностное натяжение биологических жидкостей значительно ниже, чем воды. Поэтому гидрофобные вещества, например кислоты жирного ряда, стероиды, будут накапливаться у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны.
Жидкость |
Поверхностное натяжение эрг/см2 |
Ртуть |
430,0 |
Вода |
72,7 |
Глицерин |
65,0 |
Сыворотка крови человека (при 38 С) |
46 - 47 |
Этиловый спирт |
22,0 |
Эфир |
16 |
Цитоплазма амёб (на границе с маслом) |
0,5 - 1,5 |
Для адсорбции из водных растворов большое значение имеет наличие у молекул полярных (гидрофильных) и неполярных (гидрофобных) групп.
Так, в молекуле масляной кислоты имеется полярная группа СООН и гидрофобная углеводородная цепь:

Молекулы обладающие одновременно обеими видами групп, называются дифильными.
У дифильной молекулы с короткой гидрофобной цепью преобладаютгидрофильные свойства, поэтому такие молекулы хорошо растворяются в воде, адсорбируясь отрицательно.
С удлинением углеводородной цепи усиливаются гидрофобные свойства молекул и понижается их растворимость в воде.
Следовательно, к поверхностно-активным веществам принадлежат вещества дифильной структуры, имеющие меньшее, чем растворитель, поверхностное натяжение, и растворение которых приводит к положительной адсорбции, вызывая понижение поверхностного натяжения.
Поверхностно-инактивные вещества обладают противоположными свойствами.
Одновременно с увеличением гидрофобных свойств молекул повышается их поверхностная активность. Так удлинение цепи в гомологическом ряду жирных кислот, спиртов, аминов и др. на радикал –СН2– увеличивает их способность к положительной адсорбции в разбавленных растворах в 3,2 раза (правило Траубе-Дюкло).
Поверхностные плёнки
Молекулы веществ с преобладанием гидрофобных свойств (жирные кислоты с большим молекулярным весом и др.) располагаются в основном на поверхности воды, образуя поверхностные плёнки.
При небольшом количестве таких молекул поверхностной плёнки не образуется. Если же молекул много, то они располагаются упорядоченно, одна рядом с другой, причём их гидрофобные части выступают над водной поверхностью, образуя так называемый частокол Лэнгмюра.

1 - беспорядочное расположение дифильных молекул; 2 - частокол Лэнгмюра; 3 - избыток молекул; 4 - гидрофильная часть молекул; 5 - гидрофобная часть молекул;
Поверхностная плёнка образуется мономолекулярным слоем молекул, каждая из которых занимает на поверхности воды определённую площадь. Толщину слоя и площадь, занимаемую каждой молекулой, можно расчитать.
Так, молекулы жирных кислот, имеющие по одной полярной группе (масляная, валериановая, каприновая кислоты и т.п.) занимают на поверхности воды площадь 21 · 10-16 см2, независимо от длины углеводородной цепи.
Жирные кислоты с двумя полярными группами (например, олеиновая кислота) занимает площадь, вдвое большую, а молекулы с тремя полярными группами (например, тристеарин) – втрое большую площадь и т.д.
При избытке вещества с преимущественно гидрофобными свойствами его молекулы располагаются над молекулярной плёнкой.
Кессонная болезнь
Образование поверхностных плёнок нередко затрудняет процесс фильтрации.
На границе раздела воздух–вода в пузырьках воздуха, находящихся в растворе, может адсорбироваться поверхностно-активное вещество. Плёнка этого вещества образует как-бы оболочку вокруг пузырька. Такой пузырёк при продавливании через узкие поры в фильтре не способен резко деформироваться и поэтому может закупорить более крупные отверстия в фильтре, чем пузырёк без плёнки.
У водолазов, работающих на больших глубинах, иногда возникает, так называемая,кесонная болезнь. В их скафандры воздух подаётся под давлением и, следовательно, в крови водолазов растворяется повышенное количество газов.
При слишком быстром поднятии на поверхность давление в скафандрах резко понижается, и значительная часть газов крови выделяется в виде пузырьков, на которых образуется поверхностная плёнка из содержащихся в крови поверхностно-активных веществ.
Пузырьки газов закупоривают мелкие сосуды в различных тканях и органах, что приводит к тяжёлому заболеванию или даже гибели человека.
Подобная же паталогия может возникнуть и в результате резкого падения атмосферного давления при разгерметизации скафандров лётчиков и кабин самолётов при высотных полётах.
Для лечения кессонной болезни больного помещают в барокамеру, где создают большое давление. Пузырьки газов вновь растворяются в крови. В течении нескольких суток давление в барокамере медленно снижают. За это время избыточный газ из крови столь же медленно удаляется через лёгкие, не создавая закупорок.
Адсорбция твёрдыми телами
Твёрдыми телами могут адсорбироваться газы и пары, а также молекулы и ионы растворённых веществ.
Природа сил, вызывающих адсорбцию
Адсорбция на твёрдых телах может быть объяснена наличием силовых полей притяжения, возникающих за счёт неуравновешенных связей в кристалической решётке.
На выступающих участках твёрдого адсорбента (на активных центрах) адсорбция идёт особенно сильно. Так выступы на частичке угля в 4,5 раза интенсивнее адсорбируют кислород, чем углубления на его поверхности.
Адсорбционные силы слагаются из валентных сил взаимодействия (химических) и более слабых ван-дер-ваальсовых (физических). Роль тех и других при разных случаях адсорбции различна. Так, в самом начале адсорбции большинства газов, когда их давление мало, наблюдается химическая адсорбция. С увеличением давления она уступает место физической, которая в основном определяет адсорбцию газов.
Адсорбционные силы могут быть достаточно велики. Так, для полного удаления со стекла адсорбированных молекул воды его необходимо сильно нагревать в вакууме.
Адсорбенты, обладающие мощными силовыми полями, оказываются сплошь покрытыми адсорбированными частицами. При незначительных же адсорбционных силах только более активные центры покрываеются адсорбируемыми частицами.
На адсорбцию влияет не только природа адсорбента, но и адсорбтива. Так, на твёрдых адсорбентах сильнее адсорбируются те газы, которые легче сжижаются, т.е. критическая температура которых выше.
Обратимость адсорбции
Адсорбция представляет собой обратимый процесс. Адсорбированные частицы не остаются не остаются неподвижными. Они удерживаются на адсорбенте всего сотые и тысячные доли секунды и, десорбируясь, замещаются на новые частицы. К тому же они не являются строго фиксированными на адсорбенте, а могут перемещаться по его поверхности. В итоге устанавливается динамическое адсорбционное равновесиемежду свободными и адсорбированными частицами.
Скорость адсорбции
Скорость адсорбции имеет большое значение для практического использования различных адсорбентов.
Например, в противогазе проходящий через коробку воздух должен очень быстро очищаться от примесей отравляющих веществ, что возможно лишь при высоких скоростях адсорбционных процессов.
Необходимо указать, что активированный уголь в противогазе играет роль не только адсорбента ряда отравляющих веществ, но и катализатора реакций разложения некоторых из них.
В частности, активированный уголь катализирует гидролиз фосгена:
COCl2 + H2O = HCl + CO2.
Повышение температуры понижает физическую адсорбцию адсорбцию, так как при этом усиливается движение молекул в адсорбционном слое, нарушается ориентация адсорбированных молекул, т.е. увеличивается десорбция.
С другой стороны увеличение температуры увеличивает энергию адсорбированных частиц, что усиливает химическую адсорбцию.
Следовательно, в одних случаях повышение температуры усиливает десорбцию, в других – увеличивает адсорбцию.
Так, для большинства газов повышение температуры уменьшает адсорбцию. В то же время увеличение температуры от –185 до +20°С в 10 раз увеличивает адсорбцию кислорода платиной, так как при этом возрастает химическая адсорбция.
Повышение давления газов и паров увеличивает адсорбцию.
Капилярная конденсация
При адсорбции паров наблюдают так называемую капилярную конденсацию, протекающую на угле и других пористых адсорбентах.
Сконденсировавшаяся в капилярах жидкость образует вогнутый мениск, над которым пар оказывается насыщенным при более низком давлении, чем над плоской поверхностью. Это повышает конденсацию паров в капилярах адсорбента.
Капилярная конденсация особенно выражена у легко сжижаемых газов.
Хемосорбция
При хемосорбции вещество вступает с адсорбентом в химическую реакцию, например:
O2 + 2Cu = 2CuO.
Если вновь образующиеся при хемосорбции молекулы диффундируют в глубь вещества адсорбента, то достижение сорбционного равновесия наступает медленнее, так как оно зависит от скорости диффузии.
Если же при хемосорбции на поверхности сорбента возникают недиффундирующие молекулы, т.е. образуется плёнка, то она тормозит и со временем останавливает процесс хемосорбции.
Так, пластинка алюминия, сорбируя кислород, покрывается плёнкой из оксида оалюминия, что быстро прекращает процесс хемосорбции:
4Al + 3O2 = 2Al2O3.
Хемосорбция, как и всякая химическая реакция, может быть экзо- илиэндотермической. Следовательно повышение температуры усиливает одни хемосорбционные процессы и ослабляет другие.
Полностью разграничить адсорбцию и хемосорбцию нельзя. Обычно эти два процесса протекают совместно.
Коллоидные частицы.
Коллоидные растворы
Коллоидными растворами называют микрогетерогенные дисперсные системы с частицами размером от 1 до 100 мкм. Их характеризует не только наличие поверхности раздела между дисперсной фазой и дисперсионной средой (т.е. между частицами растворяемого вещества и растворителем), но и малая устойчивость. Коллоидные растворы не образуются самопроизвольно.
Виды коллоидных частиц
Частицы коллоидных размеров могут иметь различную внутреннюю структуру, что существенно сказывается как на методах получения коллоидных растворов, так и на их свойствах.
Существуют следующие три типа внутренней структуры первичных частиц коллоидных размеров.
1. Суспензоиды (или необратимые коллоиды),
2. Мицеллярные коллоиды (или ассоциативные коллоиды),
3. Молекулярные коллоиды (обратимые коллоиды).
Суспензоиды
Так называют коллоидные растворы металлов, их оксидов, гидроксидов, сульфидов и других солей.
Мельчайшие частицы перечисленных веществ, имеющих молекулярную или ионную кристалические решётки, составляют дисперсную фазу суспензоидов.
От суспензий они отличаются более высокой дисперсностью.
Суспензоидами их назвали потому, что, как и суспензии, они не могут длительно существовать в отсутствие стабилизатора дисперсности.
Необратимыми их назвали потому, что осадки, остающиеся при выпаривании таких коллоидных растворов, не образуют вновь золя при контакте с дисперсионной средой.
Суспензоиды называют лиофобными коллоидами. Название происходит от греческих слов: лиос – жидкость, фобио – ненавижу. Такое название они получили из-за предположения, что дисперсная фаза в них очень слабо взаимодействует с дисперсионной средой.
Суспензоиды, как и вообще дисперсные системы, могут быть получены двумя путями:
Методом диспергирования, т.е. измельчения крупных тел, и
Методами конденсации молекулярно- или ионнорастворённых веществ.
Метод диспергирования
Измельчение путём дробления, помола, истирания даёт сравнительно крупнодисперсионные прошки (> 60 мкм). Более тонкого измельчения достигают с помощью специальных аппаратов, получивших название коллоидных мельниц, или применением ультразвука.
Метод конденсации
Метод конденсации состоит в получении нерастворимых соединений путём реакций обмена, гидролиза, восстановления, окисления.
Проводя эти реакции в сильно разбавленных растворах и в присутствии небольшого избытка одного из компонентов, получают не осадки, а коллоидные растворы.
К конденсационным методам относится также получение лизолей путём замены растворителя. Например, коллоидный раствор канифоли можно получить, выливая её спиртовой раствор в воду, в которой канифоль не растворима.
Мицелярные коллоиды
Их называют также полуколлоидами. Коллоидные частицы этого типа возникают при достаточной концентрации дифильных* молекул низкомолекулярных веществ путём их ассоциации в агрегаты молекул – мицеллы – сферической или пластинчатой формы.
Дифильными называют молекулы, которые состоят из углеводородного радикала, имеющего сходство с неполярными растворителями, и гидрофильной (полярной) группы, имеющей сродство к воде.
Мицеллы представляют собой скопления правильно расположенных молекул, удерживаемых преимущественно дисперсионными силами.

Образование мицелл характерно для водных растворов моющих веществ (например, мыл – щелочных солей высших жирных кислот).
Минимальную концентрацию поверхностно-активных веществ в растворе, при которой в системе образуются устойчивые мицеллы, находящиеся в равновесии с неассоциированными молекулами поверхностно-активного вещества, называют критической концентрацией мицеллоообразования.
Молекулярные коллоиды (обратимые коллоиды)
К молекулярным коллоидам относятся природные и синтетические высокомолекулярные вещества с молекулярным весом от десяти тысяч до нескольких миллионов. Молекулы этих веществ имеют размеры коллоидных частиц. Из-за огромного размера такие молекулы называют макромолекулами.
Разбавленные растворы высокомолекулярных соединений – это истинные, гомогенные растворы, которые при предельном разведении подчиняются общим законам разбавленных растворов.
Для получения растворов молекулярных коллоидов достаточно привести сухое вещество в контакт с подходящим растворителем.
Неполярные макромолекулы растворяются в углеводородах (например, каучуки в бензоле), а полярные макромолекулы в полярных растворителях (например, некоторые белки - в воде и водных растворах солей).
Вещества этого типа назвали обратимыми коллоидами потому, что после выпаривания их растворов и добавления новой порции растворителя сухой остаток вновь переходит в раствор.
Растворение макромолекулярных коллоидов проходит через стадию набухания, являющуюся характерной качественной особенностью веществ этого типа.
При набухании молекулы растворителя проникают в твёрдый полимер и раздвигают макромолекулы. Последние из-за своего большого размера медленно диффундируют в раствор, что внешне проявляется в увеличеннии объёма полимера.
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и, часто, понижение температуры приводят к застудневанию, т.е. к превращению сильно вязкого, но всё же текучего раствора, в сохраняющий форму твёрдообразный студень.
Растворы полимеров с сильно вытянутыми макромолекулами застудневают при небольшой концентрации раствора. Так, желатин и агар-агар образуют студни и гели в 0,2-1% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей).
Строение коллоидной мицеллы
Строение коллоидных частиц удобнее рассматривать, если проследить процессы их образования. Сделаем это на примере частиц AgI.
Образование коллоидной частицы AgI происходит в результате реакции:
AgNO3 + KI → AgI↓ + KNO3.
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионыAg+ и I- образуют кристаллическую решётку.
Новообразованные частицы сначала имеют аморфное строение, затем в них постепенно происходит кристаллизация.

Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. Так, при избыткеAgNO3 в растворе будет находится большое количество ионов Ag+ и NO3- . Однако построение кристаллической решетки AgI согласно правилу Панета – Фаянса может идти только за счёт ионов, входящих в её состав; в данном случае за счёт ионов Ag+.
Ионы Ag+ будут продолжать достраивать кристаллическую решётку ядра, прочно входя в её структуру и сообщая ему электрический потенциал.

1 - электронейтральное ядро 2 - зона достройки ядра потенциалопределяющими ионами 3 - адсорбционный слой 4 - противоионы адсорбционного слоя
В связи с этим ионы, достроившие кристаллическую решётку ядра, называютсяпотенциалопределяющими ионами.
Величина электродинамического потенциала, или Е-потенциала, у многих коллоидных частиц достигает 1 В. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3 (называемые поэтому противоионами). Начнётся процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами.
Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой (позиция 3на рисунке выше).
Ядро и адсорбционный слой вместе составляют гранулу. Гранула имеет электрический потенциал того же знака, что и Е-потенциал, но величина его меньше и зависит от количества противоионов в адсорбционном слое.
Так, если 90% их адсорбировано, то и потенциал гранулы составит 10% от Е-потенциала.
Потенциал гранулы называется электрокинетическим или дзета-потенциалом (ζ-потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц в электрическом поле. Его можно определить также, как потенциал на границе между адсорбционным (неподвижным относительно частицы) идиффузным (подвижным) слоями. (о диффузном слое см. ниже)
Остаток противоионов удерживается электростатическими силами притяжения вблизизи гранулы, образуя диффузный слой (позиция 5 на рисунке ниже).

5 - диффузный слой, состоящий из противоионов, не вошедших в адсорбционный слой гранулы
Гранула вместе с диффузным слоем образует мицеллу.
Толщина диффузного слоя различна, так как зависит от ионной силы раствора: чем ионная сила выше, тем толщина слоя меньше.
Концентрация противоионов в диффузном слое убывает по направлению к переферии. Соответственно этому убывает и потенциал частицы, падая на границе дифузного слоя до нуля. Таким образом, мицелла всегда электронейтральна.
Если переместить в адсорбционный слой большое количество противоионов, например 95%, электрокинетический (ζ-потенциал), измеряемый на поверхности гранулы, уменьшится до 5% от величины Е-потенциала. Величина Е-потенциала, зависящая от потенциал-определяющих ионов меняться не будет.
Устойчивость коллоидных растворов обусловлена присутствием стабилизатора, т.е. электролита и зависит от величины заряда гранулы (ζ-потенциала). Чем выше этот потенциал, тем сильнее оказываются силы взаимного отталкивания частиц, препятствующие их объединению при столкновениях, наблюдающихся в результате броуновского движения.
Коагуляция коллоидных растворов.
Коагуляция
Коллоидные системы обладают различной устойчивостью. Все они стремятся к уменьшению свободной поверхностной энергии за счёт сокращения удельной поверхности коллоидных частиц, что происходит при их стремлении к объединению.
Удельная поверхность этих частиц очень велика, поэтому они и обладают большим избытком поверхностной энергии, что, в свою очередь, ведёт к термодинамической неустойчивости коллоидных систем.
Процесс объединения коллоидных частиц в более крупные агрегаты называется коагуляцией.
Расклинивающее давление
По теории коагуляции Б.В. Дерягина и Л.Д. Ландау, при Броуновском движении коллоидные частицы свободно сближаются на расстояние до примерно 10-5 см, однако дальнейшему их сближению препятствует, так называемое, расклинивающее давление, возникающее в тонких слоях воды, находящихся между двумя поверхностями.
Расклинивающим давлением называют избыточное (по сравнению с гидростатическим) давление, действующее со стороны тонкого слоя жидкости на ограничивающие поверхности.
В золях оно обусловлено в основном взаимным отталкиванием противоионов диффузного слоя сблизившихся частиц и, кроме того, силами молекулярного взаимодействия между поверхностями этих частиц и молекулами воды.
Изменение свойств воды вокруг коллоидных частиц
Под влиянием электростатических полей, создаваемых ионами, расположенными на поверхности коллоидных частиц, прилегающие к ним молекулы воды сильнее поляризуются и располагаются более упорядоченно, что, в частности, усиливает связь не только между этими молекулами воды, но и между ними и коллоидными частицами.
В результате прилегающий к частице слой воды, приобретает особые свойства (повышенную вязкость и упругость), что препятствует объединению частиц.
Преодоление расклинивающего давления
Если частицы обладают достаточной энергией для преодоления давления расклинивания, то на расстоянии, равном диаметру частиц, т.е. примерно 10-7 – 10-8 см, начинают преобладать силы межмолекулярного притяжения, и частицы объединяются.
Только очень малое число столкновений приводит к объединению частиц, поэтому многие золи устойчивы. Если же понизить величину заряда коллоидных частиц, то такие частицы будут легче и сильнее коагулировать.
С наибольшей скоростью коагулируют коллоидные частицы, у которых заряд гранул равен нулю, т.е. частицы, находящиеся в изоэлектрическом состоянии.
Отсутствие заряда у гранулы означает, что у частицы нет противоионов в диффузионном слое и, следовательно, их водной оболочки.
Оказалось также, что полидисперсные золи коагулируют быстрее монодисперсных и что форма частиц имеет значение для этого процесса: с наибольшей скоростью коагулируют палочкообразные частицы.
Динамика процесса коагуляции
При коагуляции двух частиц золя (так называемых частиц первого порядка) образуется более крупная частица второго порядка, которая может объединяться с ещё одной частицей первого порядка, образуя частицу третьего порядка, которая вновь присоединяет частицу первого порядка и превращается в частицу четвёртого порядка и т.д.
Расчёты показали, что присоединение частиц первых порядков происходит легче, чем объединение частиц более высоких порядков.
Сумма всех частиц в золе при коагуляции непрерывно уменьшается, причём если число исходных частиц первого порядка n1 всё время убывает, то число частиц второго порядка n2 вначале увеличивается, а затем уменьшается. Чуть отставая по времени отn2 растёт количество частиц третьего порядка n3, которое, пройдя свой максимум, начинает падать. В это время возрастает количество частиц следующего порядка и т.д.
Седиментация частиц
В результате при коагуляции образуются рыхлые агрегаты различной величины, в которой частицы непрочно связаны между собой.
Крупные агрегаты под действием силы тяжести начинают опускаться на дно сосуда. Происходит процесс седиментации.
Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил.
Скорость седиментации зависит от размеров и плотности частиц, от их заряда, вязкости раствора и т.п.
Частицы, находящиеся в изоэлектрическом состоянии, оседают быстрее, так как заряд не препятствует их коагуляции и седиментации.
Использование центрифуг для осаждения
Для ускорения процесса седиментации широко используют центрифуги. Возникающая при помощи них центробежная сила заставляет частицы оседать быстрее. При достаточном числе оборотов удаётся осаждать даже некоагулированные частицы.
При постоянных температуре, вязкости растворителя, величине заряда частиц и т.п. скорость их осаждения зависит от различий в их массе и размерах, благодаря чему можно расчитывать молекулярный вес этих частиц.
При помощи ультрацентрифуг, развивающих скорость в десятки тысяч оборотов в минуту, были определены молекулярные веса многих белков и других органических соединений.
Изменение скорости коагуляции
Самопроизвольная коагуляция многих золей часто протекает медленно. Её можно ускорить, повышая скорость движения частиц. Это поможет им преодолеть расклинивающее давление.
Ускорение движения частиц можно вызвать, например, повышением температуры раствора. Повышение концентрации золя также приводит к ускорению его коагуляции, поскольку с увеличением концентрации растёт число эффективных столкновений между мицеллами.
Процесс коагуляции очень чувствителен к добавлению электролитов.
Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить водные растворы кислот, солей и оснований и пр.
Небольшие количества электролитов могут резко ускорить скорость коагуляции. Следовательно, с одной стороны, электролиты необходимы для стабилизации золей, а с другой – их избыточное добавление ведёт к коагуляции золей. Влияние различных электролитов на этот процесс неодинаково.
Зависимость коагуляции от величины заряда иона электролита
Коагулирующее действие электролитов зависит от величины заряда иона, который противоположен заряду коллоидной частицы.
С наибольшей скоростью коагулируют электронейтральные частицы. Такое состояние частицы, заряженной до начала коагуляции, например положительно, станет возможным в том случае, если все противоионы диффузного слоя, заряженные отрицательно, будут перемещены в адсорбционный слой.
Чем выше окажется концентрация добавленного электролита, тем сильнее будет сжат диффузионный слой, тем меньше станет ζ-потенциал и быстрее пойдёт коагуляция.

А - до начала коагуляции гранула заряжена положительно; Б - гранула стала электронейтральной, коагуляция протекает с максимальной скоростью.
При достаточной концентрации электролита практически все её противоионы окажутся в адсорбционном слое, заряд частицы снизится до нуля. Отсутствие диффузного слоя обусловит значительное понижение давления расклинивания и коагуляция пойдёт с максимальной скоростью.
Коагулирующее действие ионов резко возрастает с увеличением числа их зарядов в прогрессии, которую грубо принимают за соотношение шестых степеней числа зарядов ионов: 1 : 26 : 36 и т.д.
В действительности из-за влияния ряда факторов это соотношение оказывается меньшим.
Из данных приведённых ниже таблицах следует, что коагулирующая способность двухзарядных ионов в десятки раз, а трёхзарядных ионов - в сотни раз выше, чем у однозарядных ионов.
Влияние различных электролитов на коагуляцию золей As2S3 |
|||
Электролит |
Коагулирующий ион |
Пороговая концентрация коагуляции ммоль/л |
Коагулирующая способность в сравнении с Na+ |
NaCl |
Na+ |
51,0 |
1,0 |
KCL |
K+ |
49,5 |
1,03 |
MgCl2 |
Mg2+ |
0,72 |
70,9 |
CaCl2 |
Ca2+ |
0,65 |
78,5 |
AlCl3 |
Al3+ |
0,092 |
554,0 |
Влияние различных электролитов на коагуляцию золей Fe(OH)3 |
|||
Электролит |
Коагулирующий ион |
Пороговая концентрация коагуляции ммоль/л |
Коагулирующая способность в сравнении с Na+ |
KBr |
Br- |
12,5 |
1,0 |
KNO3 |
NO3- |
12,0 |
1,04 |
KCl |
Cl- |
9,0 |
1,33 |
K2SO4 |
SO42- |
0,205 |
60,1 |
K2Cr2O7 |
Cr2O72- |
0,195 |
64,1 |
Коагулирующие способности этих же ионов по отношению к другому золю будут иметь иные значения. Но различие в этих значениях будет не очень велико. Поэтому можно расположить одинаково заряженные ионы в лиотропные ряды, показывающие, в каком порядке убывает их коагулирующая способность для всех противоположно заряженных золей.
Положительные ионы:
Cs+ > Rb+ > K+ > Na+ > Li+
Ba2+ > Sr2+ > Ca2+ > Mg2+
Отрицательные ионы:
Cl- > Br- > NO3- > I- > CNS-
Механизм коагулирующего действия электролитов
В механизме коагулирующего действия электролитов можно выделить три фактора.
