
- •Химия элементов и их соединений Общие свойства металлов
- •Основные способы получения металлов:
- •Общие химические свойства металлов:
- •Свойства металлов и их соединений
- •Свойства элементов 1-й группы и их соединений
- •Получение щелочных металлов в свободном состоянии
- •1. Электролиз расплавов хлоридов или гидроксидов:
- •2. Металлотермическое восстановление соединений:
- •Физические свойства щелочных металлов
- •Химические свойства Наименее активен литий, наиболее – цезий
- •1. Взаимодействие с кислородом
- •2. Взаимодействие с неметаллами:
- •3. Взаимодействие с водой:
- •4. Взаимодействие с кислотами (см. Общие свойства металлов):
- •Свойства элементов 2-й группы и их соединений
- •1. Электролиз расплавов галогенидов (см. Получение щелочных металлов)
- •2. Магний, кроме того, можно выделить термическим путем, восстанавливая его при температуре выше 2000 0с:
- •Физические свойства металлов 2-й группы
- •Химические свойства
- •1. Взаимодействие с кислородом:
- •2. Взаимодействие с неметаллами (при нагревании): азотом, фосфором, серой, галогенами
- •3. Взаимодействие с водой:
- •4. Взаимодействие с кислотами:
- •Жесткость воды и способы её устранения Наиболее вероятный солевой состав воды следующий:
- •Под жесткостью воды (согласно гост р 52029–2003) понимается совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальция и магния (иногда )
- •Предельно допустимая жесткость питьевой водопроводной воды составляет 7 моль Способы устранения жесткости
Свойства элементов 2-й группы и их соединений
Во 2-й
группе
периодической системы элементов
расположены

Нахождение в природе: Как и щелочные металлы, все металлы 2-й группы встречаются в природе только в виде соединений.
Бериллий
– редкий,
но
не
рассеянный
элемент,
его
содержание
в
земной
коре
составляет
 ,
мас. доли.
Наибольшее
значение
имеет
берилл
,
мас. доли.
Наибольшее
значение
имеет
берилл
 ,
окрашенные
кристаллические
разновидности
которого
являются
драгоценными
камнями:
изумруд
(зеленая
окраска
обусловлена
примесью
,
окрашенные
кристаллические
разновидности
которого
являются
драгоценными
камнями:
изумруд
(зеленая
окраска
обусловлена
примесью
 ),
голубовато-зеленый
аквамарин
(
),
голубовато-зеленый
аквамарин
( )
и др.
)
и др.
Содержание
 и
и
 в
земной
коре
весьма
велико
–2,0
и
3,4
мас.
доли,
%,
стронция
и
бария
– значительно
меньше
в
земной
коре
весьма
велико
–2,0
и
3,4
мас.
доли,
%,
стронция
и
бария
– значительно
меньше
 .
Основные
соединения:
.
Основные
соединения:
 – флюорит
или
плавиковый
шпат;
– флюорит
или
плавиковый
шпат;
 – бишофит,
– бишофит,
 – карналлит,
– карналлит,
 – в
морской
воде;
магнезит
– в
морской
воде;
магнезит
 ,
доломит
,
доломит
 мрамор
или
известняк
мрамор
или
известняк
 ,
стронцианит
,
стронцианит
 ,
,
 ,
гипс
,
гипс
 ,
кизерит
,
кизерит
 ,
каинит
,
каинит
 ,
тяжелый
шпат
,
тяжелый
шпат
 ;
апатит
;
апатит
 ,
фосфорит
,
фосфорит
 и
др.
и
др.
Получение:
1. Электролиз расплавов галогенидов (см. Получение щелочных металлов)
2. Магний, кроме того, можно выделить термическим путем, восстанавливая его при температуре выше 2000 0с:


Металлы 2-й группы по сравнению с щелочными металлами имеют гораздо более высокие температуры плавления и кипения, плотность и твердость. По твердости бериллий не отличается от стали, а барий – от свинца.
Физические свойства металлов 2-й группы
Металл |
Радиусы, нм |
|
|
Кристаллическая структура |
кДж/моль |
|
||||||
атома |
иона |
|||||||||||
|
0,112 |
0,031 |
1850 |
1278 |
12500С ГПУ → ОЦК |
900 |
1,5 |
|||||
|
0,160 |
,065 |
1740 |
649 |
ГПУ |
740 |
1,2 |
|||||
|
0,197 |
0,099 |
1540 |
839 |
2500С ГЦК → ГПУ 4500С ГПУ → ОЦК |
590 |
1,0 |
|||||
|
0,215 |
0,113 |
2600 |
769 |
2150С ГЦК → ГПУ 6050С ГПУ → ОЦК |
550 |
1,0 |
|||||
|
0,222 |
0,135 |
3500 |
725 |
ОЦК |
500 |
0,9 |
|||||
Химические свойства

1. Взаимодействие с кислородом:
Оксиды
 образуются
при
непосредственном
соединении
металла
с
кислородом
при
нагревании:
образуются
при
непосредственном
соединении
металла
с
кислородом
при
нагревании:

Ba +
O2 2BaO;
2BaO + O2
2BaO2
2BaO;
2BaO + O2
2BaO2
Все оксиды растворимы в кислотах, так как имеют осно̀вный характер, кроме оксида бериллия, который проявляет амфотерные свойства, растворяясь и в кислотах, и в щелочах:



2. Взаимодействие с неметаллами (при нагревании): азотом, фосфором, серой, галогенами


Важный
для
техники
карбид
кальция
 получают
из
оксида
кальция
и
кокса:
получают
из
оксида
кальция
и
кокса:


Галогениды образуются при непосредственном соединении металла с галогеном:
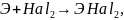 где
где



 ,
,




