
- •Химия элементов и их соединений Общие свойства металлов
- •Основные способы получения металлов:
- •Общие химические свойства металлов:
- •Свойства металлов и их соединений
- •Свойства элементов 1-й группы и их соединений
- •Получение щелочных металлов в свободном состоянии
- •1. Электролиз расплавов хлоридов или гидроксидов:
- •2. Металлотермическое восстановление соединений:
- •Физические свойства щелочных металлов
- •Химические свойства Наименее активен литий, наиболее – цезий
- •1. Взаимодействие с кислородом
- •2. Взаимодействие с неметаллами:
- •3. Взаимодействие с водой:
- •4. Взаимодействие с кислотами (см. Общие свойства металлов):
- •Свойства элементов 2-й группы и их соединений
- •1. Электролиз расплавов галогенидов (см. Получение щелочных металлов)
- •2. Магний, кроме того, можно выделить термическим путем, восстанавливая его при температуре выше 2000 0с:
- •Физические свойства металлов 2-й группы
- •Химические свойства
- •1. Взаимодействие с кислородом:
- •2. Взаимодействие с неметаллами (при нагревании): азотом, фосфором, серой, галогенами
- •3. Взаимодействие с водой:
- •4. Взаимодействие с кислотами:
- •Жесткость воды и способы её устранения Наиболее вероятный солевой состав воды следующий:
- •Под жесткостью воды (согласно гост р 52029–2003) понимается совокупность свойств, обусловленных содержанием в ней щелочноземельных элементов, преимущественно ионов кальция и магния (иногда )
- •Предельно допустимая жесткость питьевой водопроводной воды составляет 7 моль Способы устранения жесткости
Химия элементов и их соединений Общие свойства металлов
Электрическая проводимость металлов: Ag, Cu, Al, Fe
Основные способы получения металлов:
1. Вытеснение металла более активным металлом
Гидрометаллургия:

Алюмотермия:

2.
Восстановление
металлов
неметаллами ;
а также другими веществами, например,
;
а также другими веществами, например,

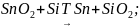
 2
2
 2
2

3. Восстановление металлов при электролизе
Общие химические свойства металлов:
1. Взаимодействие с окислителями:






2. Взаимодействие с кислотами:
Металлы,
стоящие
в
ряду
активностей
после
водорода
( )
с разбавленными
HCl,
)
с разбавленными
HCl,
 не
взаимодействуют
не
взаимодействуют

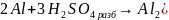




Концентрированные
холодные

 пассивируют
некоторые
довольно
активные
металлы
(например,
пассивируют
некоторые
довольно
активные
металлы
(например,
 )
)
3. Амфотерность металлов:


Свойства металлов и их соединений
Общая
электронная
конфигурация
внешнего уровня –
 или
или
 ,
где
,
где
 номер
периода;
активные восстановители:
номер
периода;
активные восстановители:
Свойства элементов 1-й группы и их соединений
Металлы,
образованные элементами
1-й
группы
 щелочные.
Гидроксиды
щелочные.
Гидроксиды
 исторически
называемые
щелочами,
хорошо
растворимы
в
воде
и
полностью
диссоциированы
на
ионы.
исторически
называемые
щелочами,
хорошо
растворимы
в
воде
и
полностью
диссоциированы
на
ионы.
Нахождение
в
природе:
Натрий
и
калий
относятся
к
самым
распространенным
в
природе
элементам
(мас.
доли,
%):
 (2,27),
(2,27),
 (1,85), литий,
рубидий
и
цезий
являются
редкими
элементами:
(1,85), литий,
рубидий
и
цезий
являются
редкими
элементами:

 ,
,

 ,
,


Природные
соединения Na
:
 – каменная
соль
и
в
растворенном
виде
в
морской
воде;
глауберова
соль
– каменная
соль
и
в
растворенном
виде
в
морской
воде;
глауберова
соль
 ;
глауберит
;
глауберит
 ;
чилийская
селитра
;
чилийская
селитра
 ;
сода
;
сода
 ;
бура
;
бура
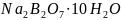 и
др.
и
др.
Калий
находится
в
ряде
минералов:
сильвин
 ,
каинит
,
каинит
 ,
карналлит
,
карналлит
 ;
селитры
;
селитры
 ,
входит
в
состав
алюмосиликатных
горных
пород,
например,
ортоклаз
,
входит
в
состав
алюмосиликатных
горных
пород,
например,
ортоклаз
 и
др.
и
др.
 обычно
сопутствуют
в
небольших
количествах
натрию
и
калию
в
их
соединениях
обычно
сопутствуют
в
небольших
количествах
натрию
и
калию
в
их
соединениях
Получение щелочных металлов в свободном состоянии
1. Электролиз расплавов хлоридов или гидроксидов:


на
катоде
выделяется
металл:
 ;
;
на
аноде
выделяется
хлор:

или
кислород:

2. Металлотермическое восстановление соединений:

Щелочные металлы при обычных условиях находятся в твердом состоянии, имеют ОЦК, серебристо-белую окраску, кроме золотисто-желтого цезия, очень мягкие и пластичные, легко режутся ножом. На воздухе покрываются пленкой сложного состава, в которой присутствуют оксиды, пероксиды, нитриды; хранятся в защитной атмосфере – керосине или вакууме
В пределах группы сверху вниз (от к ) радиусы атомов элементов увеличиваются, энергии ионизации уменьшается, и, следовательно, повышается их восстановительной активность. Степени окисления щелочных металлов во всех соединениях +1, проявляют себя как сильнейшие восстановители:

