
4. Методичні вказівки до розрахунку
Як приклад приведемо розрахунок циклу із заданими наступними параметрами в характерних крапках: р1 = 0,3 МПа; V1 = 0,3 м3/кг; p2 = 1,0 МПа; T3 = 473 К і наступним типом термодинамічних процесів, що складають даний цикл:
1–2 S = const
2–3 V = const
3–4 T = const
4–1 p = const
Ескіз термодинамічного циклу представлений на рис. 1.
 Термодинамічний цикл, що розраховується
Термодинамічний цикл, що розраховується
містить наступні процеси:
1-2 адіабатний
2-3 ізохорний
3-4 ізотермічний
4-1 ізобарний
Рис. 1 - Термодинамічний цикл
Визначимо температуру робочого тіла в крапці 1 (Т1)
![]()
Вибираємо по
додатку В теплоємність при постійному
тиску
![]() =
1,005 кДж/(кг∙ К), теплоємність при постійному
об’ємі
=
1,005 кДж/(кг∙ К), теплоємність при постійному
об’ємі
![]() =
0,718 кДж/(кг∙ К), що відповідає властивостям
сухого повітря при t1
= 40
=
0,718 кДж/(кг∙ К), що відповідає властивостям
сухого повітря при t1
= 40
![]() .
.
Визначимо показник
адіабати
![]() .
.
Визначимо показник політропи n і теплоємність С для кожного із процесів. Показник політропи n для процесів знайдемо з виразу
![]() (1)
(1)
у яке замість
теплоємності
![]() підставимо відповідні значення
теплоємностей для даного процесу. Як
відомо, для ізохорного процесу
=
,
для ізобарного
=
,
для ізотермічного
= ∞, для адіабатного
= 0. Підставивши відповідні значення
у вираження (1) і виконавши перетворення,
одержимо: для ізохорного процесу
підставимо відповідні значення
теплоємностей для даного процесу. Як
відомо, для ізохорного процесу
=
,
для ізобарного
=
,
для ізотермічного
= ∞, для адіабатного
= 0. Підставивши відповідні значення
у вираження (1) і виконавши перетворення,
одержимо: для ізохорного процесу
![]() ,
для ізобарного
,
для ізобарного
![]() ,
для ізотермічного
,
для ізотермічного
![]() ,
для адіабатного
,
для адіабатного
![]() .
.
Отже, вихідними даними для розрахунку є:
р1 = 0,30 МПа; р2 = 1,0 МПа; V1 = 0,3 м3/кг; Т1 = 313,6 К; Т3 = 473 К;
RВ = 287 кДж/(кг∙ К); k = 1,40; = 1,005 кДж/(кг∙ К); = 0,718 кДж/(кг∙ К);
;
;
;
;
![]() = 0; сТ
= ∞
= 0; сТ
= ∞
4.1. Розрахунок р, V, Т у основних крапках циклу проведемо використовуючи співвідношення, що визначають зв'язок між основними термодинамічними параметрами робочого тіла, які можна представити в такий спосіб:
 , (2)
, (2)
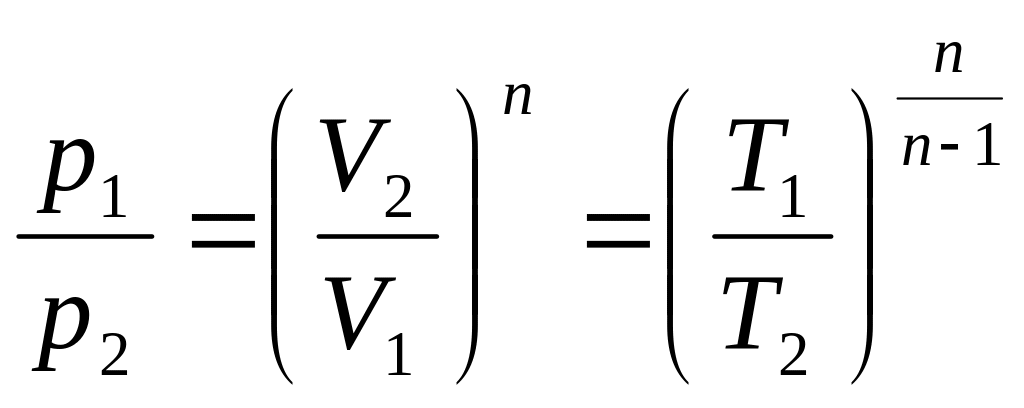 , (3)
, (3)
 . (4)
. (4)
Крім того, для розрахунку також буде необхідно і рівняння стану ідеального газу, що має наступний вид
![]() . (5)
. (5)
Отже, для т. 2 дано р2 =1,0 МПа, визначимо V2 і T2.
Для визначення V2 використаємо рівняння зв'язку параметрів в адіабатному процесі 1–2:
 м3/кг.
м3/кг.
Для визначення T2 використаємо рівняння Клапейрона – Менделєєва
![]()
Для т. 3 дано Т3 =473 К = 200 , а також V2 = V3 = 0,127 м3/кг.
Визначимо р3 з рівняння співвідношення параметрів ізохорного процесу 2–3:
![]() МПа.
МПа.
Для т. 4 дано р4 = р1 = 0,30 МПа, Т4 = Т3 = 473 К = 200 . Визначимо V4 з рівняння співвідношення параметрів ізотермічного процесу 3-4:
![]() м3/кг.
м3/кг.
Результати розрахунків p, V, T, зведемо в табл. 1.
Таблиця 1 - Результати розрахунку основних параметрів
Параметри Крапки |
р, МПа |
V, м3/кг |
Т, К |
1 |
0,30/0,30 |
0,3/0,3 |
313,6/315 |
2 |
1,0/1,0 |
0,127 /0,125 |
442,5/ 445 |
3 |
1,07/1,07 |
0,127 0,125 |
473/475 |
4 |
0,30/0,30 |
0,453 /0,455 |
473/475 |
4.2. Визначимо ∆u,
∆h, ∆S, q, l, lo,
α,
![]() для кожного із чотирьох процесів.
для кожного із чотирьох процесів.
Всі вищевказані параметри визначимо використовуючи залежності, які представлені в Додатку Г.
Процес адіабатний 1-2
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() ;
;
![]() кДж/кг;
кДж/кг;
![]() кДж/кг.
кДж/кг.
Величини α і не визначаємо, тому що в адіабатному процесі теплообмін відсутній, тобто
Процес ізохорний 2-3
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() кДж/(кг∙ К)
кДж/(кг∙ К)
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() .
.
Процес ізотермічний 3-4
![]() ;
;
![]() ;
;
![]() кДж/(кг∙ К);
кДж/(кг∙ К);
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() .
.
Процес ізобарний 4-1
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() кДж/(кг∙ К);
кДж/(кг∙ К);
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() ;
;
![]() .
.
Розраховані значення n, c, ∆u, ∆h, ∆S, q, l, lo , α, для кожного із процесів зведемо в табл. 2.
Таблиця 2. - Значення параметрів процесів циклу
Параметри
Процеси |
N |
с,
|
|
|
∆u,
|
∆h,
|
∆S,
|
q,
|
l,
|
lo,
|
1 – 2 |
|
0 |
– |
– |
|
|
|
|
|
|
2 – 3 |
|
0,718 |
1 |
0 |
|
|
|
|
|
|
3 – 4 |
|
∞ |
0 |
1 |
|
|
|
|
|
|
4 – 1 |
|
1,005 |
0,714 |
0,286 |
|
|
|
|
|
|
СУМА |
|
|
|
|
|
|
||||
4.3. Визначаємо
сумарну кількість підведеної q1
і відведеної q2
теплот у циклі, роботу циклу lц,
розположену роботу циклу lоц
,
термічний к.к.д циклу
![]() ,
індикаторний тиск pi.
,
індикаторний тиск pi.
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
![]() ;
;
![]() кПа.
кПа.
4.4. Будуємо цикл у координатах:
а) у координатах цикл представлений на рис. 2 і табл. 3.
Таблиця 3. - Значення параметрів в основних крапках
Крапки Параметри |
1 |
2 |
3 |
4 |
р, МПа |
0,3 |
1,0 |
1,07 |
0,3 |
lg p |
- 0,523 |
0 |
0,029 |
- 0,523 |
V, м3/кг |
0,3 |
0,127 |
0,127 |
0,453 |
lg V |
- 0,523 |
- 0,896 |
- 0,896 |
- 0,344 |
б) у координатах p – V цикл представлений на рис. 3 і табл. 4.
Проміжні крапки а, а', а″, а'″ для адіабати 1–2 і крапки в, в', в″, в″' для ізотерми 3–4 отримані в такий спосіб: у логарифмічних координатах адіабата 1–2 і ізотерма 3–4 являють собою прямі лінії (рис. 2), тому для цих проміжних крапок відповідні величини тисків і питомих об’ємів одержують потенцируванням їхніх значень, узятих з координат lg p і lg V.
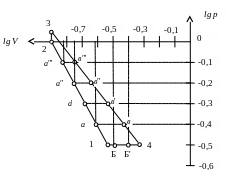
Рис. 2 - Цикл у координатах lg p – lg V


Рис. 3. – Цикл у координатах p-V
Таблиця 4 - Значення параметрів у проміжних крапках
Крапки Параметри |
а |
а' |
а″ |
а'″ |
в |
в' |
в″ |
в″' |
р, МПа |
0,398 |
0,501 |
0,631 |
0,794 |
0,398 |
0,501 |
0,631 |
0,794 |
lg p |
-0,4 |
-0,3 |
-0,2 |
-0,1 |
-0,4 |
-0,3 |
-0,2 |
-0,1 |
V, м3/кг |
0,243 |
0,207 |
0,176 |
0,148 |
0,339 |
0,269 |
0,221 |
0,170 |
lg V |
-0,615 |
-0,685 |
-0,755 |
-0,830 |
-0,470 |
-0,570 |
-0,665 |
-0,770 |
в) у координатах T – S цикл представлений на рис. 4.
Для коректної побудови циклу в координатах T – S аналогічним образом визначаємо значення тисків і питомих об’ємів проміжних крапок Б и Б' для ізобари 4-1 (значення представлені в табл. 5), за допомогою яких визначимо температури в цих крапках і відповідні значення зміни ентропії (значення представлені в табл. 5).
![]() К;
К;
![]() К;
К;
![]() кДж/(кг∙ К);
кДж/(кг∙ К);
![]() кДж/(кг∙ К).
кДж/(кг∙ К).
Таблиця 5 - Значення параметрів у проміжних крапках
Параметри Крапки |
р, Мпа |
lg p |
V, м3/кг |
lg V |
T, К |
∆S, кДж/(кг К) |
Б |
0,30 |
- 0,523 |
0,331 |
- 0,48 |
345,6 |
- 0,130 |
Б' |
0,30 |
- 0,523 |
0,398 |
- 0,40 |
415,6 |
- 0,315 |


Рис. 4 – Цикл у координатах T-S
4.5 Використовуючи p- V – і T - S діаграми, графічно визначимо величини, зазначені в п. 2 і п. 3 і порівняємо результати графічного й аналітичного розрахунків:
а) Роботи розширення,
стиску й розположені знайдемо по графіках
процесів, представленим на рис. 3. При
цьому треба мати на увазі, що знак δl
визначається з вираження δl=![]() , тому що тиск p
– величина позитивна, то знак δl
визначається знаком dV.
Якщо об’єм зменшується, то dV
також має знак мінус, тобто робота
відбувається над робочим тілом і δl
також має знак мінус і навпаки.
, тому що тиск p
– величина позитивна, то знак δl
визначається знаком dV.
Якщо об’єм зменшується, то dV
також має знак мінус, тобто робота
відбувається над робочим тілом і δl
також має знак мінус і навпаки.
Процес адіабатний 1-2
Площа, обмежена
процесом 2-М–1, ординатами 2–2
і 1–1,
а також віссю абсцис, еквівалентна
роботі стиску l1-2
. Після проведення додаткової лінії
2-N-1 на діаграмі циклу (рис. 3) ця площа
може бути представлена як різниця площ
прямокутної трапеції 2-N-1-![]() і сегменти 2-N-1-М-2. Звісно, що цілком
справедливим буде наступний запис
і сегменти 2-N-1-М-2. Звісно, що цілком
справедливим буде наступний запис

де
![]() –
площа на діаграмі циклу еквівалентна
роботі процесу, мм2;
–
площа на діаграмі циклу еквівалентна
роботі процесу, мм2;
(1-1'), (2-2'), (2'-1'), (2-N-1), (M-N) – Довжини відрізків на p – V діаграмі (рис. 3) мм.
Звідки
![]() кДж/кг
кДж/кг
де Mp,v – масштаб p – V діаграми, що по рис. 3 дорівнює 50 Дж/(кг∙ мм2), тобто 1мм2= 50 Дж/кг
Знак мінус, тому що процес 1-2 це стиск, отже dV негативна.

![]() кДж/кг.
кДж/кг.
Процес ізохорний 2-3
l2-3=
0; тому що
![]()
![]() мм2;
мм2;
![]() кДж/кг.
кДж/кг.
Процес ізотермічний 3-4

![]() кДж/кг,
кДж/кг,
т. к. процес 3–4 – розширення, то і dV має знак плюс, отже й l має знак плюс.

![]() кДж/кг.
кДж/кг.
Процес ізобарний 4-1
![]() мм2;
мм2;
![]() кДж/кг,
кДж/кг,
т. к. процес 4-1 – стиск, то dV має знак мінус, отже й l має знак мінус.
![]() ,
тому що
,
тому що
![]() .
.
Розраховані значення l і lo графічним шляхом зведемо в табл. 2 у знаменники відповідних колонок;
б) Для кожного процесу, що становить цикл, дамо схему в T–S координатах і графічним методом визначимо u, h, q, n.
При графічному дослідженні процесів в T - S діаграмі для простоти їх приймають за прямі лінії.
Крім того необхідно мати на увазі наступне:
1. Знак теплоти
визначається з вираження
![]() .
Тому що абсолютна температура Т
– величина завжди позитивна, то знак
q
визначається знаком dS.
Якщо dS
має знак плюс і q
також буде мати знак плюс і навпаки.
.
Тому що абсолютна температура Т
– величина завжди позитивна, то знак
q
визначається знаком dS.
Якщо dS
має знак плюс і q
також буде мати знак плюс і навпаки.
2. Знак u
визначається з вираження
![]() .
Тому що
.
Тому що
![]() - величина позитивна, то знак u
визначається знаком dT.
Температура зменшується, значить dT
має знак мінус і u
також має знак мінус і навпаки.
- величина позитивна, то знак u
визначається знаком dT.
Температура зменшується, значить dT
має знак мінус і u
також має знак мінус і навпаки.
3. Знак ∆h
визначається з вираження
![]() .
Тому що cp
– величина позитивна, то знак ∆h
визначається знаком dT.
Якщо температура збільшується, значить
dT
має знак плюс і ∆h
також має знак плюс і навпаки.
.
Тому що cp
– величина позитивна, то знак ∆h
визначається знаком dT.
Якщо температура збільшується, значить
dT
має знак плюс і ∆h
також має знак плюс і навпаки.
Процес адіабатний 1-2 (рис. 5)


Рис. 5 – Схема розрахунку процесу 1–2 в T - S діаграмі
При визначенні u, ∆h і n необхідно нанести додатково процеси: ізобарний і ізохорний. Для визначення зміни ентропії для ізохорного і ізобарного процесів в інтервалі зміни температур адіабатного процесу 1-2
![]() кДж/(кг∙ К)
кДж/(кг∙ К)
![]() кДж/(кг∙ К)
кДж/(кг∙ К)
Як видно з рис. 5 процес 1-2 є адіабатним. Площа під изохорой 2–2V еквівалентна зміні внутрішньої енергії в процесі 1–2.
Таким чином, маємо:

Площа під ізобарою 2-2р еквівалентна зміні энтальпии в процесі 1-2, тобто

З рис. 5 слідує, що q1-2 = 0.
Показник політропи n графічно по T - S діаграмі може бути визначений у такий спосіб.
З початкової крапки процесу т. 1 (рис. 5) проводиться ізотерма, а з кінцевої т. 2 – ізобара і изохора до перетинання із проведеною ізотермою в т. 2р и т.2v Відношення відрізків 1–2р до 1–2v і дає чисельне значення. Дійсно, відрізки 1–2р і 1–2v можна розглядати, як зміна ентропії в ізотермічних процесах 1–2р і 1–2v .
Показник політропи позитивний, якщо т. 2р и т.2v розташовуються по одну сторону від т. 1. Причому, якщо т. 2р и т.2v розташовуються ліворуч від т. 1, то n>1, а якщо праворуч, то 0 < n < 1. Якщо ж т. 1 розташовується між т. 2р и т.2v , то n < 0.
Це легко одержати
з вираження (1). Як відомо, теплота
підведена в ізобарному процесі 2-2р
може бути розрахована по формулі
![]() ,
але у свою чергу q2-2p
можна виразити і як
,
але у свою чергу q2-2p
можна виразити і як
![]() .
Дорівнюючи ліві частини q2-2p
цих виражень, одержимо
.
Дорівнюючи ліві частини q2-2p
цих виражень, одержимо
![]() .
Звідки
.
Звідки
![]() .
Аналогічно одержимо співвідношення
.
Аналогічно одержимо співвідношення
![]() і для ізохорного процесу 2–2v
.
і для ізохорного процесу 2–2v
.
З огляду на, що
![]() = 0, і підставивши відповідні значення
= 0, і підставивши відповідні значення
![]() і
сv
у вираження (1), одержимо:
і
сv
у вираження (1), одержимо:
![]() .
.
Процес ізохорний 2-3 (рис. 6).
Для ізохорного процесу 2-3, як відомо, площа під изохорой 2-3 чисельно Дорівнює теплоті процесу 2-3 і одночасно зміні внутрішньої енергії цього ж процесу.
![]() з табл. 2 дорівнює 0,048 кДж/(кг
К);
з табл. 2 дорівнює 0,048 кДж/(кг
К);
![]() кДж/(кг∙ К)
кДж/(кг∙ К)

![]() кДж/кг;
кДж/кг;



Рис. 6 – Схема розрахунку процесу 2–3 в T- S діаграмі
Показник політропи n для ізохорного процесу 2–3 визначимо в такий спосіб
![]() .
.
Отже, в T- S діаграмі графічне визначення показника політропи n змісту не має, тому що в знаменнику дробі нуль.
Процес ізотермічний 3-4 (рис. 7)


Рис. 7 – Схема розрахунку процесу 3–4 в T - S діаграмі
;
;
![]() з табл. 2 дорівнює 0,365 кДж/(кг
К);
з табл. 2 дорівнює 0,365 кДж/(кг
К);
![]() кДж/кг.
кДж/кг.
Показник політропи n для ізотермічного процесу 3–4 визначимо в такий спосіб.
Тому що Т4 = Т3 , то зміна ентропії для ізохорного і ізобарного процесів у цьому інтервалі температур буде дорівнювати нулю, (∆S4V = 0; ∆S4p = 0). Це слідує з виражень
![]()
![]() ;
;
![]()
Отже, провести
изохору і ізобару з т. 4 для ізотермічного
процесу 3–4 не можна. Тому, підставивши
відповідні значення
![]() ;
;
![]() ;
;
![]() у формулу (1), маємо:
у формулу (1), маємо:
![]() .
.
Процес ізобарний 4-1 (рис. 8)


Рис.8 – Схема розрахунку процесу 4–1 в T- S діаграмі
Для ізобарного процесу як відомо, вся підведена теплота витрачається на зміну энтальпии. Отже, під ізобарою 4-1 площа 4-1-1'-4' еквівалентна теплоті процесу 4-1 і зміні энтальпии процесу 4-1

де з табл. 2
![]() кДж/(кг∙ К).
кДж/(кг∙ К).
Під изохорой 4-1v площа еквівалентна внутрішньої енергії процесу 4-1

де
![]() кДж/( кг∙ К).
кДж/( кг∙ К).
Показник політропи n для ізобарного процесу 4–1 знайдемо в такий спосіб:
![]() .
.
Отже, в T- S діаграмі графічне визначення показника політропи n змісту не має, тому що в чисельнику дробі 0.
Додаток А
