
- •Н. В. Степанова весовой (гравиметрический) метод анализа
- •Содержание
- •Введение
- •1 Теоретическая часть
- •1.1 Основы гравиметрического метода анализа
- •1.2 Метод осаждения
- •1.2.1 Основные операции метода осаждения
- •1.2. 2 Условия осаждения кристаллических осадков
- •1.2.3 Оптимальные условия осаждения аморфных осадков
- •1.2.4 Вычисление результатов гравиметрических определений
- •1.3 Метод выделения и отгонки
- •2 Экспериментальная часть
- •2.1 Лабораторная работа № 1 «Гравиметрическое определение
- •2.1.1 Краткая характеристика метода
- •2.1.2 Порядок проведения работы
- •2.1.3 Подготовка фарфоровых тиглей
- •2.1.4 Осаждение сульфата бария
- •2.1.5 Фильтрование и промывание сульфата бария
- •2.1. 6 Получение весовой формы сульфата бария
- •2.1.7 Обработка результатов анализа
- •2.1.8 Приборы, посуда и реактивы
- •2.2 Лабораторная работа № 2 «Гравиметрическое определение
- •2.2.1 Краткая характеристика метода
- •2.2.2 Порядок проведения работы
- •2.2.3 Обработка результатов анализа
- •2. 2. 4 Приборы, посуда и реактивы
- •2.3 Лабораторная работа № 3 «Определение массовой доли
- •2.3.1 Краткая характеристика метода
- •2.3.2 Порядок проведения работы
- •2.3.3 Обработка результатов анализа
- •2.3.4 Приборы, посуда и реактивы
- •3 Методические рекомендации по оформлению
- •4 Контрольные вопросы
- •5 Задачи
- •5.1 Примеры решения задач
- •5.2 Задачи для самостоятельного решения
- •6 Основные требования техники безопасности при работе в химической лаборатории
- •Литература
- •Министерство образования и науки рф
- •«Алтайский государственный технический университет
- •Им. И.И. Ползунова»
- •Весовой (гравиметрический) метод анализа
2.1. 6 Получение весовой формы сульфата бария
Если осадок отмыт, то дают полностью стечь промывной жидкости, после чего фильтр с осадком слегка подсушивают. Для этого воронку с осадком накрывают листом фильтровальной бумаги и на несколько минут помещают вертикально в сушильный шкаф с температурой 100─120 0С (фильтр после просушивания должен оставаться слегка влажным). Фильтр с осадком помещают в тигель, доведенный до постоянной массы.
Для озоления фильтра тигель с осадком берут с помощью тигельных щипцов и вносят в открытую муфельную печь с температурой 800 0С и доводят до постоянной массы.
2.1.7 Обработка результатов анализа
Результаты измерения
массы пустого тигля (доведенного до
постоянной массы) и тигля с осадком
(также доведенного до постоянной массы)
заносят в журнал. Рассчитывают массу
осадка (m![]() )
и гравиметрический фактор (F=
)
и гравиметрический фактор (F=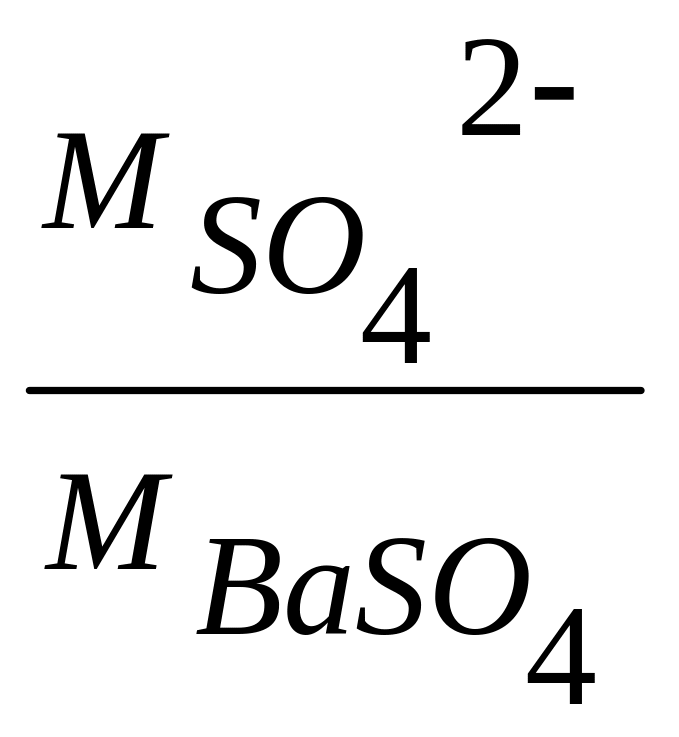 ).
Содержание сульфат-ионов рассчитывают
по формуле
).
Содержание сульфат-ионов рассчитывают
по формуле
m![]() =
m
=
m![]()
F.
F.
Результаты двух параллельных определений вместе с кратким отчетом сдают преподавателю для проверки.
2.1.8 Приборы, посуда и реактивы
1) муфельная печь с температурой нагрева от 800─900 0 С;
2) весы лабораторные рычажные 1 и 2-го классов точности;
3) фарфоровые стаканы для прокаливания (тигли);
4) эксикатор;
5) кальций хлористый, прокаленный при температуре 700─800 0С, для заполнения эксикатора или силикагель;
7) хлорид бария с массовой долей 4 %;
8) нитрат серебра с массовой долей 1 %;
9) азотная кислота, раствор (1: 1);
10) вода дистиллированная;
11) стаканы химические объемом 250 см3;
12) палочки стеклянные;
13) цилиндры мерные объемом 10 и 100 см3.
2.2 Лабораторная работа № 2 «Гравиметрическое определение
содержания ионов железа (II) в растворе его соли»
Цель работы: освоение основных операций весового анализа и определение содержания ионов железа (II) в растворе его соли.
2.2.1 Краткая характеристика метода
Гравиметрическое определение Fe3+ основано на осаждении его в виде труднорастворимого соединения Fe(OH)3 согласно реакции
Fe3+
+ 3NH4OH
![]() Fe(OH)3
+ 3NH4+
Fe(OH)3
+ 3NH4+
с последующим отделением осадка, промыванием его, высушиванием, прокаливанием его до Fe2O3, взвешиванием и вычислением его количества.
Точные результаты можно получить только тогда, когда в анализируемом растворе не содержится других ионов кроме Fe3+, осаждаемых аммиаком, или веществ, способных связать Fe3+ в растворимый комплекс.
2.2.2 Порядок проведения работы
Анализируемый раствор, содержащий до 0,0500 г железа, помещается в химический стакан емкостью 100─150 см3, в котором он подкисляется 15─20 каплями HNO3 и нагревается до кипения для перевода Fe2+ в Fe3+, далее раствор разбавляется 25 см3 воды и снова нагревается до начала кипения. Одновременно с этим в стакане емкостью 100─150 см 3 нагревают до кипения раствор нитрата аммония (NH4NO3). Затем горячий анализируемый раствор быстро нейтрализуют концентрированным раствором аммиака (NH4OH) до темно-красного окрашивания раствора.
Далее осторожно по каплям при постоянном помешивании стеклянной палочкой прибавляют 10 %-ный раствор NH4OH до остающегося едва различимого запаха избытка раствора аммиака. В случае полного осаждения железа, если прекратить размешивание, будет наблюдаться хорошее отстаивание осадка от раствора и отстоявшаяся жидкость над осадком будет бесцветна.
Нейтрализацию прекращают и к анализируемому раствору с осадком добавляют от 30 до 40 см3 горячего раствора NH4NO3, перемешивают стеклянной палочкой и перед фильтрованием дают отстояться 5─7 минут. Осадок отфильтровывают через фильтр с красной или белой лентой диаметром
7 см. На фильтре осадок промывают горячим раствором NH4NO3 до исчезновения в пробе фильтрата Cl-. Затем осадок вместе с фильтром помещают во взвешенный фарфоровый тигель, осторожно на электрической плитке подсушивают его, озоляют и прокаливают в муфельной печи при температуре 800─900 0C до постоянной массы. Исходя из массы диоксида железа, рассчитывают массу ионов железа, содержащихся в анализируемом растворе.
