
- •Письмова робота
- •8.Вказати вираз концентраційної константи рівноваги для оборотної реакції
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •17. До амфотерних оксидів належать:
- •18. Яка властивість ковалентного зв’язку зумовлює просторову структуру молекул?
- •Письмова робота
- •11. У ряду нf – hci – hBr – hi
- •12. Для якісного виявлення озону використовують реакцію взаємодії його з:
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •11. У ряду нf – hci – hBr – hi
- •12. Для якісного виявлення озону використовують реакцію взаємодії його з:
- •16. Максимальна ступінь окиснення елемента, як правило, дорівнює
- •Письмова робота
- •14. Сухий хлор можна зберігати у балонах з:
- •18. Яка властивість ковалентного зв’язку зумовлює просторову структуру молекул?
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
Письмова робота
Знайти масу нітрогену в 1кг: а) калійної селітри KNO3; б) аміачної селітри NH4NO3; в) кальцій ціанаміду CaCN2; г) карбаміду CO(NH2)2.
Чи однакова густина за воднем: а) СО та С2Н4; б) СО2 та О2; в) СО та N2; г) NH3 та CH4?
Написати молекулярні рівняння наступних перетворень: нітратна кислота → нітроген(V) оксид → нітратна кислота → купрум(ІІ) нітрат → алюміній нітрат → алюміній оксид → калій ортоалюмінат → калій гексагідроксоалюмінат.
Розчин, що містить 3,7г кальцій гідроксиду, поглинув 1,68л вуглекислого газу за нормальних умов. Знайти масу осаду, що утворився.
Що характеризує магнітне квантове число? Які значення воно приймає для р- та d-орбіталей?
Дати порівняльну характеристику властивостей простих речовин елементів, атомам яких відповідають такі електронні формули:
1s2 2s2 2p3 1s2 2s1
1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
Назвати ці елементи.
В яких молекулах є гібридні атомні орбіталі: СО, СО2, СF4, HI, BCl3? Вказати тип гібридизації та геометрію молекул.
Чим відрізняється ковалентно-полярний зв’язок від ковалентно-неполярного? Навести приклади. Як пояснити наявність диполя в молекулі SO2 та його відсутність в молекулі СО2?
Як метод ВЗ пояснює просторову будову та магнітні властивості таких комплексних іонів [Ni(NH3)6]2+, [Ni(CN)4]2‾. Дописати до цих іонів зовнішню сферу і назвати утворені сполуки.
Скільки теплоти виділиться в результаті повного перетворення 82кг етилового спирту в оцтову кислоту:
С2Н5ОН(р) + О2(г) = СН3СООН(р) + Н2О(р)?
Які молекули називають активними? Що таке енергія активації. Рівняння Арреніуса. Пояснити виходячи з рівняння Арреніуса, залежність швидкості хімічної реакції від енергії активації.
Які реакції належать до окисно-відновних?
SnCl2 + H2O → SnOHCl + HCl;
Sn + NaOH + H2O → Na2[Sn(OH)4] + H2;
SnCl2 + Bi(NO3)3 + NaOH → Bi + Na2SnO3 + NaCl + H2O.
Скласти електронні рівняння і розставити коефіцієнти. Вказати окисник і відновник.
Які реакції належать до окисно-відновних?
Cl2 + KOH → KCl + KClO3 + H2O;
KClO3 + KI + H2SO4 → I2 + KCl + K2SO4 + H2O;
Zn + H2SO4 (конц) → ZnSO4 + S + H2O.
Скласти електронні рівняння і розставити коефіцієнти. Вказати окисник і відновник.
Що таке стандартний окисно-відновний потенціал? Від яких факторів він залежить?
Які розчини називають насиченими, ненасиченими, пересиченими? Як треба змінити температуру та тиск, яку додати речовину, щоб насичений розчин кисню у воді став: а) ненасиченим; б) пересиченим?
До 400мл розчину сульфатної кислоти з масовою часткою H2SO4 15% (густина розчину 1,1г/мл) додали 60г води. Знайти масову концентрацію H2SO4 в одержаному розчині.
Водневий показник артеріальної крові 7,40, а венозної 7,36. Обчислити молярні концентрації іонів гідрогену та гідроксиду у крові.
Чи утвориться осад аргентум сульфату при змішуванні рівних об’ємів розчину аргентум нітрату з с(AgNO3) = 0,02моль/л та розчину сульфатної кислоти з с(
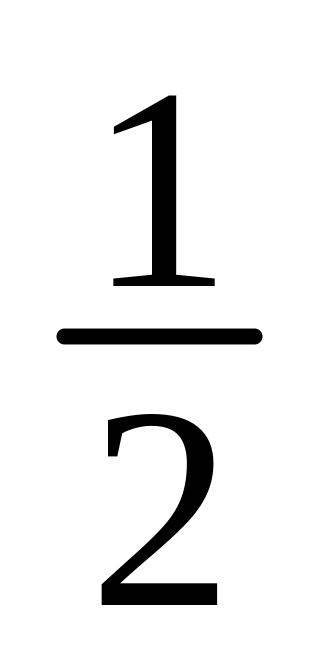 H2SO4)
= 1моль/л?
H2SO4)
= 1моль/л?
Варіант № 34
1. Вказати елемент, що має найбільшу електронегативність:
А) O ; Б) Сl ; В) F ; Г) N ; Д) P .
2. Загальне позначення масової частки атомів даного хімічного елементу в сполуці позначаєтьсяγ :
А) γ (х) ; Б) х (x) ; В) w (x) ; Г) c (x) ?
3. Вказати молекулу, cумарний дипольний момент якої дорівнює нулю:
А) HCl; Б) H2S ; В) NH3 ; Г) H2O ; Д) CH4 .
4. Вказати молекулу, сумарний дипольний момент якої дорівнює нулю:
А) H2S; Б) CH3Cl ; В) CH2O ; Г) HC ≡ CH; Д) CH3OH .
5.В комплексі Na3 [Сo(NO2)6] вказати ступінь окиснення, координаційне число, тип гібридизації орбіталей комплексоутворювача:
А) +3;4; sp3d2 ; Б) +3;4; d2sp3 ; В) +3;6; d2sp3; Г) +3;6; sp3d2; Д) +2;6; d2sp3 .
6.В окисно-відновному перетворенні I2→ 2I- вказати хімічний еквівалент (1/z·x) для I2 :
А) I2 ; Б) 1/2 I2; В)1/3 I2 ; Г) 1/4 I2; Д) 1/5 I2 .
7.Назвати гідроксид, який в момент утворення розкладається на оксид і воду:
А) Mg(OH)2; Б) Ca(OH)2 ; В) Sr(OH)2 ; Г) Hg(OH)2 ; Д) Ba(OH)2 .
8. Назвати одиниці вимірювання константи реакції третього порядку :
А) моль ; Б) с-1; В) л ; Г) л2 ; Д) л2
л·с моль·с моль2с моль·с
9. Серед наведених кислот вказати слабку :
А) HCl; Б) HClO4 ; В) HClO3 ; Г) HNO3 ; Д) HClO .
10.Серед наведених солей вказати ту, що при гідролізі утворює кисле середовище :
А) N2SO4 ; Б) K2SO4 ; В) Al2(SO4)3 ; Г) K2CO3 ;
Д) CH3COOK; Е) HCl .
11. Деякі метали можуть реагувати з водою з утворенням гідроксидів та водню. Який гідроксид утворюється при взаємодії метала з водою?
A) NaOH; Б) Mn[OH]2; В) Fe[OH]3; Г) Zn[OH]2; Д) Cr[OH]3;
12. Яка з нижченаведених реакцій у розчині йде практично до кінця?
A) Сульфатна кислота+хлорид натрію
Б) Хлоридна кислота+нітрат срібла
В) Хлорид калію+нітратна кислота Г) Хлорид натрію+гидроксид калію
Д) Сульфатна кислота+хлорид калію
13. Який об’єм водню виділиться при взаємодії 2 моль цинку із сульфатною кислотою за реакцією:
Zn + H2SO4=ZnSO4+H2
A) 48 л. Б) 22,4л. В) 11,2л. Г) 44,8л. Д) 33,6 л.
14. Реакція між розчинами Na2SiO3 і H2SO4 йде до кінця, тому що:
A) Утворюється нерозчина силікатна кислота.
Б) Утворюється розчинний натрій сульфат
В) Це реакція іонного обміну. Г) Сульфатна кислота – сильна кислота
Д) Силікат натрію-розчинна сіль.
15. Для синтезу аміаку витратили 112 л азоту (н.у.) Який об’єм водню витратився при цьому?
N2 + 3H2 = 2NH3
A) 33,6 л. Б) 67,2 л. В) 112 л. Г) 224 л. Д) 336 л.
16. Укажіть сполуку нітрогену, яка виявляє тільки відновні властивості:
A) NO2 Б) N2H4 В) NH2OH Г) NH3 Д) HNO2
17. В якій сполуці Нітроген виявляє валентність 4:
A) NH4Cl Б) NH3 В) NO Г) HNO2 Д) N2
18. В якій сполуці Сульфур може проявляти тільки відновні властивості?
A) Na2SO3 Б) H2S В) H2SO4 Г) S Д) SO2
19. Укажіть, який із оксидів виявляє амфотерні властивості
A) Na2O
Б) BaO
В) FeO
Г) MnO
Д) Al2O3
20. Під нормальними умовами (н.у.) в хімії розуміють наступні числові значення тиску та температури:
A) р=101,3 Па; Т=273К Б) р=101,3 атм; Т=298К
В) р=760 мм.рт.ст; Т=1000С Г) р=1,013 Па; Т=00С Д) р=760 мм.рт.ст; Т=250С
