
- •Письмова робота
- •8.Вказати вираз концентраційної константи рівноваги для оборотної реакції
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •17. До амфотерних оксидів належать:
- •18. Яка властивість ковалентного зв’язку зумовлює просторову структуру молекул?
- •Письмова робота
- •11. У ряду нf – hci – hBr – hi
- •12. Для якісного виявлення озону використовують реакцію взаємодії його з:
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •11. У ряду нf – hci – hBr – hi
- •12. Для якісного виявлення озону використовують реакцію взаємодії його з:
- •16. Максимальна ступінь окиснення елемента, як правило, дорівнює
- •Письмова робота
- •14. Сухий хлор можна зберігати у балонах з:
- •18. Яка властивість ковалентного зв’язку зумовлює просторову структуру молекул?
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
- •Письмова робота
Варіант № 21
1. Вказати елемент, атом якого у нормальному стані має сумарний спін рівний 1 :
А) Cr ; Б) Mn ; В) Fe ; Г) Co ; Д) Ni .
2. Вказати відносний заряд електрона:
А) +1 ; Б) -1 ; В) 1,6 ·10-19Кл ; Г) 1,6·10 -19 Кл/моль.
3.Вказати кратність зв’язку в іоні NO- :
А) 1; Б) 1,5 ; В) 2 ; Г) 2,5 ; Д) 3.
4.Назвати молекулу, в якій ковалентний зв'язок неполярний :
А) HF ; Б) HCl ; В) HBr ; Г) HI ; Д) H2.
5. В комплексі K4[Fe(CN)6] вказати ступінь окиснення, координаційне число, тип гібридизації орбіталей комплексоутворювача :
А) + 2; 6 ; sp3d3; Б)+2 ; 6 ; d2 sp3; В) +3; 6; sp3d2; Г) +3; 6; d2sp3.
6.Серед наведених окисно-відновних рівнянь реакцій вказати рівняння реакції внутрішньомолекулярного типу :А) CL2+H2O= HCl + HCl +HClO ; Б) S +O2=SO2; В) (NH4)2Cr2O7=Cr2O3+N2+ 4H2O;
Г) SO2 +2H2S=3S + 2H2; Д) Cl2 + 2KOH =KCl + KClO + H2O.
7.Серед наведених сполук вказати сполуку, що не є оксидом :
А) N2O ; Б) Cl2O; В) F2O; Г) NO ; Д) NO2.
8.Вказати вираз концентраційної константи рівноваги для оборотної реакції
Fe3O4 + 4H2(г) ↔3Fe + 4H2О
А)
Kc=[Fe2O3]
[H2]4
; Б) Kc=[Fe]3
[H2O]4
; В) Kc=
Г)
Kc=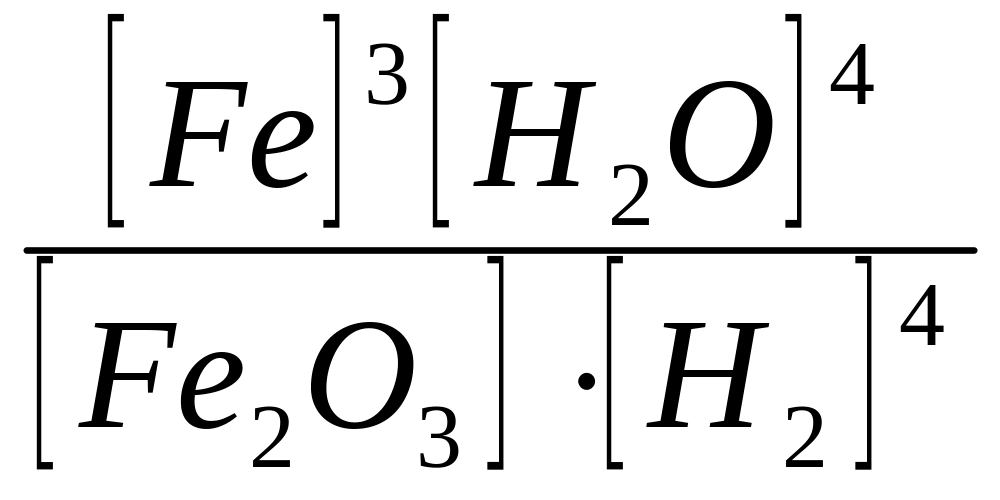 ; Д) Kc=
; Д) Kc=
9.Масова частка розчиненої речовини визначається в : А) моль/л Б) г/л В) моль/кг Г) %
10.Вказати одиниці вимірювання ДР( РbІ2 ):
А) моль/л; Б) моль2/л2 ; В) моль3/л3 ; Г) моль4/л4 ; Д) моль5/л5.
11. У ряду НF – HCI – HBr – HI
А) зменшується стійкість молекули, сила кислот зростає
Б) зростає стійкість молекули, сила кислот зростає
В) зменшується стійкість молекули, сила кислот спадає
Г) збільшується стійкість молекули, сила кислот спадає Д) сила кислот однакова
12. Для якісного виявлення озону використовують реакцію взаємодії його з:
А) Н2О2 Б) І2 В) КІ Г) H2SO4 Д) КMnО4
13. При наявності натрій хлориду розчинність хлору у воді:
А) зростає Б) спадає В) не змінюється
Г) спочатку збільшується, потім зменшується
Д) спочатку зменшується, потім збільшується
14. Сухий хлор можна зберігати у балонах з:
A) олова Б) цинку В) сурми Г) міді Д) заліза
15. Алюміній сульфід гідролізується з утворенням…
A) Аl(OH)3 та H2S Б) Аl(OH)S та H2S В) [Аl(OH)]2S та H2S
Г) Аl(OH)3 та AlHS2 Д) Аl(OH)S та AlHS2
16. Максимальна ступінь окиснення елемента, як правило, дорівнює
A) номеру підгрупи в періодичній системі В) номеру періоду
Б) номеру групи в періодичній системі Г) номеру ряду
Д) різниці між позитивним ступенем окиснення та цифрою 8
17. До амфотерних оксидів належать:
A) Оксиди d-елементів у їх проміжних ступенях окиснення
Г) Всі оксиди d-елементів
Б) Оксиди d-елементів у їх вищих ступенях окиснення
Д) Оксиди s i p - елементів
В) Оксиди d-елементів у їх мінімальних ступенях окиснення
18. Яка властивість ковалентного зв’язку зумовлює просторову структуру молекул?
A) Поляризованість Б) Насичуваність В) Полярність
Г) Направленість Д) Енергія
19. До якого типу солей належить хлорне вапно СаОСl2?
A) Кислого Б) Середнього В) Змішаного
Г) Основного Д) Подвійного
20. Закон діючих мас описує залежність швидкості хімічних реакцій від:
A) Концентрацій реагуючих речовин Б) Площі поверхні стикання
В) Природи реагуючих речовин Г) Температури Д) Каталізаторів
Письмова робота
При спалюванні 13,8г органічної речовини одержано 26,4г вуглекислого газу і 16,2г води. Густина пари цієї речовини за воднем 23. Знайти молекулярну формулу речовини.
Обчислити масу: а) 1 атома S; б) 1 молекули Н2; в) 100 молекул Н2О; г) 0,1моль NaCl.
Написати молекулярні рівняння наступних перетворень: ферум (ІІІ) нітрат → ферум (ІІІ) оксид → калій метаферит → ферум(ІІІ) сульфат → ферум(ІІІ) фосфат→ ферум(ІІІ) дигідрогенфосфат → натрій ортофосфат →∙ натрій гідроксид.
Знайти об’єм кисню (н. у.), що виділиться при термічному розкладі 17кг натрій нітрату.
Які елементи називають s-, p-, d-, f-елементами? Які елементи називають “перехідними”?
Сучасне формулювання Періодичного закону. Який фізичний зміст згідно з теорією електронної будови атома мають: 1) порядковий номер елемента; 2) номер періоду; 3) номер групи? Чим пояснити, що хімічні властивості елементів періодично змінюються?
Як метод В3 пояснює симетричну плоску геометрію молекули BF3? Як і чому змінюється геометрія частинок при переході від BF3 до BF4‾?
Визначати ковалентність, координаційне число та ступінь окиснення атомів в молекулах: СО2, НСООН, НNO2, C6H6.
Написати рівняння утворення комплексних сполук:
AgI
+ Na2S2O3(надл)![]()
Hg(NO3)2 + KI(надл)
CuSO4 + NH3(надл)
Назвати комплексні сполуки і їх складові частини.
В яких одиницях вимірюється швидкість хімічної реакції? Який порядок реакції за воднем в елементарній реакції 2NO + Н2 = N2O + Н2О? Який загальний порядок реакції?
Класифікувати окисно-відновні реакції. Написати рівняння реакцій:
H2SO4 + H2S → S + H2O;
Cl2 + KOH → KCl + KClO3 + H2O;
S + KOH → K2S + K2SO3;
Cu(NO3)2 → CuO + NO2 + H2O;
KClO3 → KCl + KClO4.
12. Які реакції належать до окисно-відновних? Які з наведених реакцій є окисно-відновними?
NH3 + O2 → NO + H2O;
NH4Cl + NaOH → NH4OH + NaCl;
KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
Скласти електронні рівняння і розставити коефіцієнти. Вказати окисник і відновник.
13. Користуючись значеннями стандартних окисно-відновних потенціалів, визначити окисник і відновник в реакції: H2SO3 + H2SeO3 =
14. Сформулювати закон Генрі-Дальтона. Як буде змінюватись концентрація кисню у воді, яку піднімають над поверхнею Землі? Як змінюється розчинність кисню в крові при зміні атмосферного тиску?
15.
Масова частка сульфатної кислоти у
розчині 0,98%. Визначити масову концентрацію
та молярну концентрацію еквівалента
сульфатної кислоти c(![]() H2SO4),
враховуючи, що густина розчину 1кг/л.
H2SO4),
враховуючи, що густина розчину 1кг/л.
16. Масова концентрація натрій гідроксиду 0,4г/л. Визначити рН розчину, враховуючи, що ступінь дисоціації електроліту 100%.
17. Насичений розчин барій хромату містить 1,5∙10‾5моль BaCrO4 в 1л. Обчислити добуток розчинності барій хромату.
Варіант № 22
1. Вказати відносний заряд протона:
А) +1 ; Б) -1 ; В) 1,6·10-19 кл ; Г) 1,6·10-19Кл /моль.
2. Вказати елемент, атом якого в нормальному стані має сумарний спін рівний 2,5 :
А) Ti ; Б) V ; В) Cr ; Г)Mn ; Д) Fe.
3.Вказати кратність зв’язку в молекулі NO :
А) 1 ; Б) 2 ; В) 1,5 ; Г) 2,5;
4.Назвати молекулу , в якій ковалентний зв'язок полярний :
А) N2 ; Б) O2 ; В) HCl ; Г) Cl2 ; Д) I2 .
5. В комплексі [Cr(H2O)6] (NO3)3 вказати ступінь окиснення, координаційне число, тип гібридизації орбіталей комплексоутворювача:
А) +3;6;sp3d2; Б) +2;6; sp3d2; В) +3;6;d2sp3; Г) +3;4;sp3; Д) +2;4; sp3.
6. Серед наведених окисно-відновних рівнянь реакцій вказати рівняння реакції диспропорціювання:
А) 4HNO3= 4NO2 + O2 + 2H2O; Б) Cl2 + H2O=HClO + HCl ;
В) SO2 +2H2S=3S + 2H2O ; Г) S + O2=SO2;
Д) NH4NO2=N2 + 2H2O.
7. Серед наведених сполук вказати супероксид :
А) Na2O; Б) Na2O2; В) K2O; Г) K2O2; Д) KO2.
