
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Химические виды веществ. Физические и химические свойства веществ.
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки: а) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Строение атома (ядро, элементарные частицы: протоны, нейтроны, электроны).
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Образец выполнения письменных заданий:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Изучив эти вопросы, выполните письменно следующие задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Вопросы для самостоятельной внеаудиторной подготовки к занятию:
- •Задания:
- •Литература для подготовки:
- •А) основная литература
- •Б) дополнительная литература
- •В) методические разработки
- •Электрохимический ряд напряжений (активности) металлов
- •Активность металлов уменьшается Названия химических элементов
- •Учебно-методическое пособие
Образец выполнения письменных заданий:
Напишите формулу КС: дифторотетрацианоферрат (III) калия.
Ответ:
Дифторотетрацианоферрат (III) калия - K3[Fe(CN)4F2]
Назовите КС:
[CrBr(H2O)5]SO4;
Na2[FeCl5NO].
Для анионного КС укажите ц.а.; лиганды, донорные атомы лигандов; координационное число ц.а.; внешнюю и внутреннюю сферы КС.
Для катионного КС напишите уравнения первичной и вторичной диссоциации и выражение для общей константы нестойкости.
Ответ:
[CrBr(H2O)5]SO4 – сульфат бромопентааквахрома (III);
Na2[FeCl5NO] – пентахлоронитрозилферрат (III) натрия.
Na2[FeCl5NO] – анионное КС:
Fe3+ – ц.а.; к.ч. – 6;
5Cl -, NО – лиганды,
донорный атом в лиганде Cl- – Cl, в NО – O;
2Na+ – внешняя сфера, [FeCl5NO]2- – внутренняя сфера.
[CrBr(H2O)5]SO4 – катионное КС:
[CrBr(H2O)5]SO4 [CrBr(H2O)5]2+ + SO42-
[CrBr(H2O)5]2+ Cr3+ + Br- + 5H2O
Кнест.
=
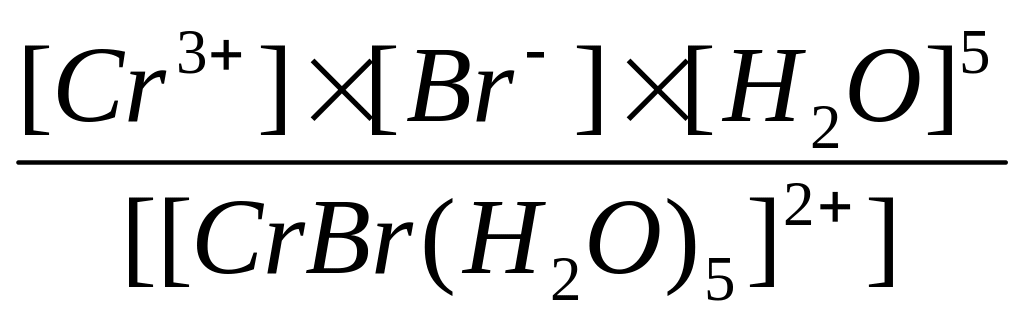
Литература для подготовки:
Лекция по теме занятия.
А) основная литература
Общая химия. Биофизическая химия. Химия биогенных элементов/
Ю.А. Ершов [и др.]. – М.: ВШ, 2002. – С. 191-203.
Б) дополнительная литература
Пузаков, С.А. Химия: учебник /С.А. Пузаков – М.: ГЭОТАР – Медиа, 2006. – 640 с. – [Электронный ресурс]. – Режим доступа: www. pharma. studmeblid. ru.
Слесарев, В.И. Химия. Основы химии живого / В.И. Слесарев. – СПб.: Химиздат, 2001. – С. 243-245.
Химия: общая и неорганическая [Электронный ресурс] / сост. Ю.Я. Харитонов, Т.К. Слонская; ГОУ ВПО Моск. мед. акад. им. И.М. Сеченова; Фармац. фак.; Центр. науч. мед. б-ка. – Электрон. дан. – М.: Русский врач, 2004. – 1 электрон. опт. диск (СD- версия). – Загл. этикетки диска. – (Электрон. б-ка для высш. мед. и фармац. образования).
Глинка, Н.Л. Общая химия: учебник/ Н.Л. Глинка – М.: КНОРУС, 2010. –
С. 354-378.
Ахметов, Н.С. Общая и неорганическая химия: учебник / Н.С. Ахметов. –
6-е изд. стер. - М.: ВШ, 2005.- С. 107-113, 206-208, 287-288.
В) методические разработки
Введение в неорганическую химию: учебное пособие для студентов фармацевтических вузов и факультетов/ В.А. Компанцев [и др.]. – Пятигорск: Пятигорская ГФА, 2009. – С. 54-62.
Тема. Элементы термодинамики. Химическая кинетика.
Химическое равновесие.
Вопросы для самостоятельной внеаудиторной подготовки к занятию:
Что изучает термодинамика, химическая термодинамика?
Что называется системой? Что такое система открытая, закрытая, изолированная? Какая из этих систем используется в термодинамике в качестве модели?
Что называется состоянием системы?
Что называется процессом? Изобарный, изохорный и изотермический процесс.
Что изучает термохимия? Что называется тепловым эффектом химической реакции, каким символом он обозначается, в каких единицах измеряется? В чём отличие термохимических уравнений, от химических и термодинамических?
Закон Гесса. Следствия из закона Гесса.
Что такое термодинамические параметры системы? Какие термодинамические характеристики называются функциями состояния системы?
Что называется внутренней энергией системы? Каким символом она обозначается, в каких единицах измеряется?
Что называется энтальпией, каким символом она обозначается, в каких единицах измеряется? Чему равна стандартная энтальпия образования простого вещества?
Что называется энтропией, каким символом она обозначается, в каких единицах измеряется? Что называется микро- и макросостоянием системы? Энтропия как мера термодинамической вероятности системы?
Изобарно-изотермический потенциал системы (энергия Гиббса). Уравнение Гиббса. Анализ уравнения. Условия, при которых процесс идет самопроизвольно.
Что изучает химическая кинетика (формальная и молекулярная)? Значение химической кинетики для фармации.
Гомо- и гетерогенные, простые и сложные реакции. Что такое "молекулярность" и "порядок" реакции?
Скорость химической реакции. Факторы, влияющие на скорость гомо- и гетерогенной реакции.
Закон действующих масс для скорости реакции. Физический смысл константы скорости, факторы, влияющие на константу скорости.
Правило Вант-Гоффа. Температурный коэффициент.
Понятие обратимые и необратимые реакции. Абсолютно необратимые и практически необратимые реакции.
Химическое равновесие. Константа равновесия.
Понятие "смещение" или "сдвиг" химического равновесия. Факторы, влияющие на смещение химического равновесия. Принцип Ле Шателье.
