
- •Раздел 1. Основы механики
- •Задачи, рекомендуемые для решения:
- •Задачи, рекомендуемые для решения:
- •Задачи, рекомендуемые для решения:
- •Задачи, рекомендуемые для занятий:
- •Занятие 5. Всемирное тяготение.
- •Задачи, рекомендуемые для занятий.
- •Задачи, рекомендуемые для занятий.
- •Занятие 7. Механические колебания и волны.
- •Задачи, рекомендуемые для занятий.
- •Раздел 2. Молекулярная физика и термодинамика.
- •Задачи, рекомендуемые для решения:
- •Занятие 2 . Реальные газы.
- •Задачи, рекомендуемые для решения.
- •Задачи, рекомендуемые для решения:
- •Задачи, рекомендуемые для решения:
Задачи, рекомендуемые для решения:
Некоторая масса молекулярного водорода занимает объем 1 м3 при температуре 250 К и давлении 2 атм. Какое давление будет иметь та же масса водорода при 5000 К в объеме 10 м3, если при такой температуре молекулы водорода диссоциируют на атомы?
Некоторое количество водорода находится в закрытом сосуде при температуре 200 К и давлении 400 Па. Газ нагревают до такой температуры, что молекулы распадаются на атомы. При этом давление становится равным 40 кПа. Во сколько раз возросла при этом средняя квадратичная скорость частиц газа?
3. Определить плотность смеси, содержащий 4 г водорода и 32 г кислорода при температуре 27оС и общем давлении 105 Па.
Сможет ли воздушный шар, наполненный гелием, удержать груз массой 100 кг, если объем шара 150 м3, а масса оболочки 8 кг? Давления и температуры гелия внутри шара и воздуха снаружи одинаковы и равны соответственно 105 Па и 15оС.
В баллоне объемом 10 л содержится водород при температуре 20оС и под давление 107 Па. Какую массу водорода выпустили из баллона, если при полном сгорании оставшегося газа образовалось 50 г воды?
6. Смешали 1 м3 воздуха влажностью 20 % и 2 м3 воздуха влажностью 30 %. При этом обе порции были взяты при одинаковых температурах. Определите относи тельную влажность смеси
Чему равна энергия теплового движения молекул двухатомного газа, заключенного в сосуд объемом 2 л и находящегося под давлением 1,5105 Па?
Чему равны удельные теплоемкости сV, сp некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна 1,43 кг/м3?
Какая часть молекул азота при 150о С обладает скоростями от 300 до 325 м/с?
В сосуде находится 8 г кислорода при температуре 1600о С. Какое количество молекул имеет кинетическую энергию поступательного движения, превышающую значение 6,6510-20 Дж?
Занятие 2 . Реальные газы.
Уравнение Ван-дер-Ваальса. Изотермы.
Эффект Джоуля-Томсона. Сжиженные газы.
Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движения.
Следствия из закона распределения: наиболее вероятная скорость, средняя арифметическая, средняя квадратичная скорости.
Барометрическая формула.
Уравнение
состояния реального газа (уравнение
Ван-дер-Ваальса) имеет вид
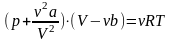 ,
где
,
где
 и
и
 –постоянные, различные для разных
газов. Они определяются из соотношений
–постоянные, различные для разных
газов. Они определяются из соотношений
 ,
,
 ,
где
,
где
 и
и
 - критические температура и давление
газа.
- критические температура и давление
газа.
Закон
распределения молекeл
по скоростям (закон Максвелла) позволяет
найти число молекул
 ,
относительные скорости которых лежат
в интервале
,
относительные скорости которых лежат
в интервале
 :
:
 .
.
Барометрическая
формула показывает убывание давления
газа с высотой в поле силы тяжести
 .
.
Задачи, рекомендуемые для решения.
10 г гелия занимают объем 100 см3 при давлении 108 Па. Найти температуру газа, рассматривая его как: 1)идеальный и 2) реальный.
Какую температуру имеют 2 г азота, занимающего объем 820 см3 при давлении в 2 ат.? Газ рассматривать как: 1)идеальный и 2) реальный.
1 кмоль углекислого газа находится при температуре 100о С. Найти давление газа, считая его: 1)идеальным и 2) реальным. Задачу решить для объемов 1 м3; 0,05 м3.
В закрытом сосуде объемом 0,5 м3 находится 0,6 кмоля углекислого газа при давлении 3106 па. Пользуясь уравнением Ван-дер-Ваальса, найти, во сколько раз надо увеличить температуру газа, чтобы давление увеличилось вдвое.
Найти эффективный диаметр молекулы азота двумя способами; 1) по данному значению средней длины свободного пробегав молекул при нормальных условиях =9,510-6 см, 2) по известной величине постоянной b в уравнении Ван-дер-Ваальса.
Найти среднюю длину свободного пробега молекулы углекислого газа при нормальных условиях. Эффективный диаметр молекулы вычислить, считая известными для углекислого газа критические температуры Тк и давление рк.
0,5 кмоля трехатомного газа адиабатически расширяется в пустоту от 0,5 м3 до 3 м3. Температура газа при этом понижается на 12,2о. Найти из этих данных постоянную a, входящую в уравнение Ван-дер-Ваальса.
Во сколько раз плотность насыщенных паров воды при температуре 200о С больше плотности насыщенных паров воды при 100о С?
Найти удельный объем воды в жидком и парообразном состояниях при нормальных условиях.
Какую работу нужно совершить против сил поверхностного натяжения, чтобы разбить сферическую каплю ртути радиусом 3 мм на две одинаковые капли?
Занятие 3. Основы термодинамики.
Первое начало термодинамики.
Работа газа.
Количество теплоты.
Внутренняя энергия газа.
Применение первого начала термодинамики к изопроцессам.
Адиабатический процесс.
Уравнение Пуассона.
Первое
начало термодинамики
 ,
где
,
где
 –
количество теплоты, полученное газом,
dU
– изменение внутренней энергии газа,
–
количество теплоты, полученное газом,
dU
– изменение внутренней энергии газа,
 d
– работа, совершаемая газом при изменении
его объема.
d
– работа, совершаемая газом при изменении
его объема.
Изменение
внутренней энергии газа
 .
.
Работа,
совершаемая при изотермическом изменении
объема газа:
 .
.
Давление
газа и объем связаны при адиабатическом
процессе уравнением Пуассона
 ,
то есть
,
то есть
 ,
где
,
где
 .
.
