- •1. Теория химического строения а.М. Бутлерова. Электронное строение атома углерода и виды гибридизации.
- •2.Классификация и номенклатура органических соединений. Виды изомерии.
- •4.Конформации молекул алифатического ряда : этана, бутана, этаноламина. Проекции Ньюмена. Энергетика образования конформеров.
- •7. Молекулы с двумя центрами хиральности (диастереомерия). Оптическая изомерия винных кислот.
- •8. Электронные эффекты в молекулах: виды и механизм передачи. Классификация органиче-ских реакций.
- •Вопрос 9
- •1. Зависимость кислотности от гетероатома.
- •2. Влияние углеводородного радикала и присутствующих в нем заместителей
- •10. Спирты. Номенклатура и классификация спиртов. Химические свойства предельных одноатомных спиртов.
- •12. Фенолы.Общая характеристика.
- •14. Реакции присоединения – отщепления (реакции с гидроксиламином, аминами, гидразином и его производными). Реакции окисления, восстановления, полимеризации карбонильных со-единений.
- •18.Аминоспирты: аминоэтанол (коламин), холин, ацетилхолин. Аминофенолы: дофамин, норадреналин, адреналин. Биологическая роль этих соединений.
- •20. Оксокислоты. Характерные хим. Свойства.
- •23. Пептиды. Строение пептидной связи. Гидролиз пептидов. Первичная структура белка и методы её установления. Вторичная и третичная структура белка.
- •24. Моносахариды и их классификация. D- и l-стереохимические ряды. Формулы Фишера и Хéуор-са. Фуранозы и пиранозы; α- и β-формы. Циклооксотаутомерия. Конформации пиранозных форм.
- •25. Строение наиболее важных пентоз (рибоза, ксилоза), гексоз (глюкоза, манноза, галактоза, фрук-тоза), аминосахаров (глюкозамин, маннозамин), дезоксисахаров (2-дезоксирибоза). Их биороль.
- •27. Олигосахариды. Дисахариды: мальтоза, лактоза, целлобиоза, сахароза. Строение, циклооксотаутомерия. Восстановительные свойства, гидролиз, биологическая роль.
- •29. Салициловая кислота и её производные (ацетилсалициловая кислота, фенилсалицилат). П-амино-бензойная кислота и её производные (новокаин, анестезин). Биологическая роль этих соединений.
- •31. Гетероциклы с несколькими гетероатомами. Пиразол, имидазол, пиразин, пиримидин, тиазол, пурин. Барбитуровая кислота и её производные. Гидроксипурины (ксантин, мочевая кислота, витамин в1).
- •33. Лактим-лактамная таутомерия
- •34.Нуклеозиды и их гидролиз. Строение и гидролиз мононуклеотидов. Первичная структура нуклеиновых кислот. Фосфодиэфирная связь. Днк и рнк: состав и гидролиз. Вторичная структура рнк и днк
- •35Строение атф, адф, амф
- •36. Омыляемые липиды (жиры). Понятие о фосфолипидах. Их биороль.
- •37. Неомыляемые липиды. Понятие о терпенах (мирцен, гераниол, цитраль, лимонен, ментол, пинены, камфора). Сопряжённые полиены (витамин а). Их биороль.
- •21. Стероиды.
1. Теория химического строения а.М. Бутлерова. Электронное строение атома углерода и виды гибридизации.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, которая состоит из следующих основных положений.
В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Атом
углерода в возбужденном состоянии
содержит четыре неспаренных электрона
на внешнем энергетическом уровне и
способен образовать четыре ковалентных
связи.

В образовании связей участвуют гибридные орбитали.
Первое валентное состояние – sp3-гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp3-гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5о:
В состоянии sp3-гибридизации атом углерода образует четыре s -связи с четырьмя заместителями и имеет тетраэдричекую конфигурацию с валентными углами, равными или близкими 109,5о. (например, метан)
Второе валентное состояние – sp2-гибридизация. В результате гибридизации с участием одной s- и двух p-орбиталей атома углерода образуются три эквивалентные sp2-гибридные орбитали, лежащие в одной плоскости под углами 120о, а не участвующая в гибридизации p-орбиталь расположена перпендикулярно плоскости гибридных орбиталей.
В состоянии sp2-гибридизации атом углерода образует три s -связи за счет гибридных орбиталей и одну p -связь за счет не участвующей в гибридизации p-орбитали и имеет три заместителя. (например, этилен)
Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p–орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 1800, а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу. В состоянии sp-гибридизации атом углерода образует две s -связи за счет гибридных орбиталей и две p -связи за счет не участвующих в гибридизации p-орбиталей и имеет два заместителя. (например, ацетилен)
2.Классификация и номенклатура органических соединений. Виды изомерии.
Номенклатура – совокупность правил составления названий химических веществ, классов, групп и др.
Главное место в органической химии занимает международная систематическая номенклатура, разрабатываемая комиссией Международного союза теоретической и прикладной химии (ИЮПАК).
Название органического соединения отражает особенности его строения.
У соединений жирного ряда корень слова обозначает число углеродных атомов главной цепи. Главной считают самую длинную и непрерывную цепь атомов углерода, имеющую наибольшее число заместителей или связанную со старшей функциональной группой.
















3.Понятие о сопряженных системах. Понятие об ароматичности.Правило Хюккеля. Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р-орбиталей.
π-π – сопряжение: делокализованная МО образуется за счет двух или более двойных связей:

р-π – сопряжение: в сопряжении участвуют соседние с π-связью атомы, имеющие негибрилизованные р-орбитали:

В результате сопряжения выделяется энергия, внутренняя энергия уменьшается, и молекула становится термодинамически более устойчивой.
Энергия сопряжения – это энергия, выделяющаяся в результате сопряжения (т.е. это энергетический выигрыш в результате сопряжения)
- с увеличением цепи сопряжения энергия сопряжения увеличивается.
Различаются линейные и циклическиесистемы сопряжения, последние в отличие от первых имеют замкнутую цепь сопряжения, в которой все входящие в неё атомы имеют негибридизованную р-орбиталь.
АРОМАТИЧНОСТЬ
Ароматичность – это понятие, обозначающее совокупность особых свойств некоторых циклических сопряженных систем.
Ароматические соединения, несмотря на высокую степень ненасыщенности: 1) предпочтительно вступают в реакции замещения, а не присоединения;
2) устойчивы к мягкому окислению.
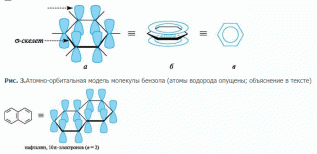
Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения ароматических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ-связи (C-C и C-H) лежат в одной плоскости.
Ароматические системы (молекулы)– системы, отвечающие критериям ароматичности:
1) наличие плоского σ-скелета, состоящего из sp2-гибридизованных атомов;
2) делокализация электронов, приводящая к образованию единого π-электрон-ного облака, охватывающего все атомы цикла (циклов);
3) соответствие правилу Э. Хюккеля, т.е. электронное облако должно насчитывать 4n+2 π-электронов, где n=1,2,3,4… (обычно цифра указывает на количество циклов в молекуле);
4) высокая степень термодинамической устойчивости (высокая энергия сопряжения).
Правило Хюккеля:
N= 4n+ 2, гдеN– число π- и р-электронов в сопряженной системе;
n = 0,1,2,3 …
Ароматическая система– это циклическая сопряженная система, удовлетворяющая правилу Хюккеля.
сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения(энергию делокализации). С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Конденсированные бензоидные ароматические системы

Небензоидные ароматические системы