
- •ГЛава I. Общие вопросы эколого-аналитической 10
- •Глава II. Объекты иследования, материалы и 52
- •Глава III. Результаты и их обсуждение 69
- •3.2. Исследование равновесных характеристик реакций образования 70
- •3.2.1. Исследование влияния рН и температуры растворов на реакции 70
- •3.3.1. Влияние на сорбцию рН и температуры растворов 80
- •Введение
- •ГЛава I. Общие вопросы эколого-аналитической химии ряда поверхностно-активных веществ
- •Классификация ингибиторов коррозии
- •1.2. Азотсодержащие ингибиторы коррозии
- •Влияние структуры азотсодержащих ингибиторов на ингибирующие действие
- •1.2.2. Представители азотсодержащих ингибиторов коррозии (Токунов в.И., 2004)
- •Механизм защитного действия ингибиторов коррозии
- •1.4. Адсорбция ингибиторов
- •1.4.1. Изотермы адсорбции ингибиторов
- •Применение ингибиторов коррозии
- •Методы идентификации и определения ингибиторов кислотной коррозии и катионных поверхностно-активных веществ
- •1.7. Очистка сточных вод от ряда поверхностно-активных веществ
- •1.7.1. Пористая структура активных углей и пригодность их для очистки сточных вод от пав
- •1.7.2. Адсорбция пав на природных сорбентах и золе
- •1.7.3. Технологические схемы очистки сточных вод от пав
- •1.8 Общая характеристика опок и сорбента св-2
- •Минеральный и химический состав опок
- •Основные параметры сорбента св-2
- •Глава II. Объекты иследования, материалы и методы
- •2.1. Методы определения и объекты исследования
- •2.2.2. Стехиометрия компонентов образования ткс
- •2.3. Исследование сорбции икк и их ткс на сорбенте св-2
- •Влияние на сорбцию рН и температуры растворов
- •2.3.2. Изотермы статической сорбции икк на сорбенте св-2
- •Кинетика сорбции икк сорбентом св-2
- •2.4. Обработка результатов
- •Расчет константы равновесия и диаграмм распределения форм ионов алюминия и реагента
- •Расчет термодинамических характеристик сорбции (Алыков н.М., 1999)
- •2.4.3. Расчет основных метрологических характеристик результатов прямых равноточных измерений (Булатов м.И., 1986)
- •2.4.3.1. Оценка воспроизводимости результатов измерений
- •2.4.3.2. Оценка правильности результатов измерений
- •2.4.4. Расчет уравнения градуировочного графика, его метрологических
- •2.4.4.1. Вычисление метрологических характеристик линейного графика
- •2.4.4.2. Вычисление метрологических характеристик результатов анализа
- •2.4.5. Расчет определяемого минимума реакции
- •Глава III. Результаты и их обсуждение
- •3.1. Применение, используемых органических реагентов для образования ткс
- •3.2. Исследование равновесных характеристик реакций образования трехкомпонентных соединений
- •3.2.1. Исследование влияния рН и температуры растворов на реакции
- •3.2.2. Стехиометрия компонентов образования ткс
- •3.2.3. Состояние в растворе ионов алюминия и органических реагентов, образующих ткс
- •3.2.4. Характеристики реакций образования трехкомпонентных соединений
- •3.3. Сорбция ингибиторов кислотной коррозии и их трехкомпонентных соединений на сорбенте св-2
- •3.3.1. Влияние на сорбцию рН и температуры растворов
- •3.3.2. Степень извлечения и коэффициент распределения
- •3.3.3. Изотермы статической сорбции икк на сорбенте св-2
- •Кинетика сорбции икк сорбентом св-2
- •3.4. Методики определения кпав и икк и способ очистки сточных вод
- •3.4.1. Методика определения икк, основанная на их способности к адсорбции на сорбенте св-2
- •3.4.2. Сорбционно-фотометрическое определение кпав в воде
- •3.4.3. Способ очистки воды от икк и кпав
- •Глава IV. Квантово-химическое изучение адсорбции
- •4.1. Квантово-химические методы
- •4.2. Кластерное приближение
- •4.3. Модели и методы расчета
- •Перспективы дальнейших исследований
- •Публикации автора по теме диссертации
- •Литература
3.1. Применение, используемых органических реагентов для образования ткс
Широко используются в аналитической химии реагенты трифенилметанового ряда, такие, как пирокатехиновый фиолетовый (3.1), хромазурол S (3.2), а также фталексоны: ксиленоловый оранжевый (3.3) и его производные и метилтимоловый синий (3.4). Эти реагенты в присутствии катионных ПАВ и ИКК образуют ТКС с РЗЭ, подгруппой титана, подгруппой алюминия, а также с бериллием и магнием. При взаимодействии этих реагентов с ионами металлов и катионными ПАВ образуются соединения с максимумами полос поглощения в красной области спектра, в то время как максимумы полос поглощения реагентов находятся в синей, а комплексов в зеленой областях спектра соответственно.


(3.1) Пирокатехиновый (3.2). Хромазурол S
фиолетовый


(3.3). Ксиленоловый оранжевый (3.4). Метилтимоловый синий
3.2. Исследование равновесных характеристик реакций образования трехкомпонентных соединений
На образование трехкомпонентных соединений, содержащих ионы металла, ИКК и органические реагенты (ОР), существенное влияние оказывают многие факторы: рН, температура раствора, а также порядок приливания реагентов. Порядок приливания реагентов оказывает влияние на скорость образования ТКС. При приливании ИКК в раствор двухкомпонентного соединения, содержащего металл и органический реагент, это происходит достаточно быстро, при других сочетаниях реакция идет крайне медленно, но со временем все равно устанавливается равновесие.
3.2.1. Исследование влияния рН и температуры растворов на реакции
образования ТКС
Влияние рН растворов на образование ТКС. Графические зависимости «оптическая плотность рН», представлены на рис. 3.1 – 3.4.


Рис. 3.1. Зависимость оптической плотности от рН для КО (1), его комплексов с Аl (2) и с Аl и ИКК (3). ИКК – Геркулес. Концентрации реагентов: СКО = 410-4М; СAl = СИКК = 110-4М. Т = 298К. = 0,1 (KCl) |
Рис. 3.2. Зависимость оптической плотности от рН для ХАС (1), его комплексов с Аl (2), с Аl и ИКК (3) и системы ХАС – ИКК (4). ИКК – Додиген. Концентрации реагентов: СХАС = 310-4М; СAl = СИКК = 110-4М. Т = 298К. = 0,1 (KCl) |


Рис. 3.3. Зависимость оптической плотности от рН для ПФ (1), его комплексов с Аl (2), с Аl и ИКК (3). ИКК – Камеликс. Концентрации реагентов: СПФ = 410-4М; СAl = СИКК = 110-4М. Т = 298К. = 0,1 (KCl) |
Рис. 3.4. Зависимость оптической плотности от рН для МТС (1), его комплексов с Аl (2), с Аl и ИКК (3). ИКК – Геркулес. Концентрации реагентов: СМТС = 410-4М; СAl = СИКК = 110-4М. Т = 298К. = 0,1 (KCl) |
Как видно из рисунков, образование трехкомпонентных комплексных соединений начинается при рН около 3,5, достигает максимума при рН 6 – 7, далее комплексы начинают разлагаться, а с рН около 9 практически неразличимы кривые поглощения реагентов и ТКС. Оптимальным рН является рН 6. Мешающее влияние остальных компонентов на аналитические характеристики комплекса незначительно.
Спектры поглощения всех соединений исследовали в интервале от 400 до 700 нм. На рис.3.5 – 3.8 приведены спектры поглощения реагентов и их трехкомпонентных соединений. Наиболее ярко проявляется изменение полосы поглощения ТКС при участии ИКК, Al и хромазурола S. Как видно из рисунков максимумы полос поглощения находятся в следующих областях: ХАС – 435 нм, ХАС + Al – 550 нм, ХАС + ИКК – 450 нм, ХАС + Al + ИКК – 640 нм. Аналогичная картина наблюдается и в спектрах ТКС, содержащих и другие изученные органические реагенты. Исследование спектров поглощения всех видов соединений находящихся в растворе убедительно свидетельствует о том, что полоса поглощения ТКС находиться в длинноволновой области и на ней всегда можно найти участок, использование которого исключает влияние других компонентов, находящихся в растворе. Поэтому удобным для дальнейшего изучения ТКС является спектральный диапазон в области от 600 до 640 нм.

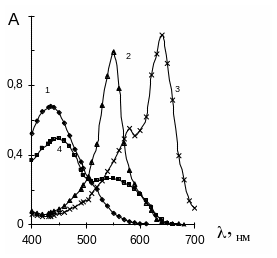
Рис. 3.5. Спектры поглощения ХАС (1) и его двухкомпонентных комплексов с алюминием (2), с ИКК (4) и трехкомпонентного комплекса с Аl и ИКК (3). ИКК – Додиген. Концентрации реагентов: СХАС = 310-4М; СAl = СИКК = 110-4М. Т = 298К, рН 6. |
Рис. 3.6. Спектры поглощения КО (1) и его двухкомпонентных комплексов с алюминием (3), с ИКК (2) и трехкомпонентного комплекса с Аl и ИКК (4). ИКК – Геркулес. Концентрации реагентов: СКО = 410-4М; СAl = СИКК = 110-4М. Т = 298К, рН 6. |

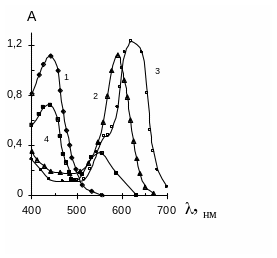
Рис. 3.7. Спектры поглощения ПФ (1) и его двухкомпонентных комплексов с алюминием (3), с ИКК (2) и трехкомпонентного комплекса с Аl и ИКК (4). ИКК – Камеликс. Концентрации реагентов: СПФ = 410-4М; СAl = СИКК = 110-4М. Т = 298К, рН 6. |
Рис. 3.8. Спектры поглощения МТС (1) и его двухкомпонентных комплексов с алюминием (3), с ИКК (2) и трехкомпонентного комплекса с Аl и ИКК (4). ИКК – Геркулес. Концентрации реагентов: СМТС = 410-4М; СAl = СИКК = 110-4М. Т = 298К, рН 6. |
Высокий аналитический эффект достигается, за счет того, что ТКС имеет максимумы полос поглощения, сдвинутые далеко в красную область, одновременно наблюдается и резкое увеличение поглощения раствора трехкомпонентных комплексов. Таким образом, образование ТКС связано с резким батохромным сдвигом максимальной полосы поглощения комплекса по сравнению с полосами поглощения реагента и двухкомпонентных соединений и при этом для ТКС наблюдается гиперхромный эффект.
Влияние температуры растворов на образование ТКС. Результаты опытов представлены на рис. 3.9. – 3.12.


Рис. 3.9. Влияние температуры на образование ТКС, образованного Al, ИКК и КО. ИКК – Геркулес. СКО = 410-4 М; СAl = СИКК = 110-4М. = 0,1 (KCl). 1 – 278 К, 2 – 295К, 3 – 315К. |
Рис. 3.10. Влияние рН на сорбцию ТКС, образованного Al, ИКК и ХАС. ИКК – Додиген. СХАС = 310-4 М; СAl = СИКК = 110-4М. = 0,1 (KCl). 1 – 278 К, 2 – 295К, 3 – 315К. |

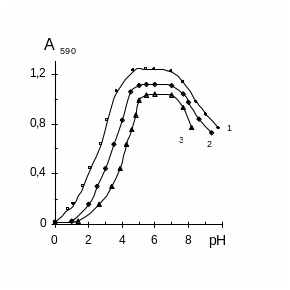
Рис. 3.11. Влияние температуры на образование ТКС, образованного Al, ИКК и ПФ. ИКК – Камеликс. СПФ = 410-4 М; СAl = СИКК = 110-4М. = 0,1 (KCl). 1 – 278 К, 2 – 295К, 3 – 315К. |
Рис. 3.12. Влияние рН на сорбцию ТКС, образованного Al, ИКК и МТС. ИКК – Геркулес. СМТС = 310-4 М; СAl = СИКК = 110-4М. = 0,1 (KCl). 1 – 278 К, 2 – 295К, 3 – 315К. |
Как видно из рисунков оптические плотности при низких температурах более высокие, чем при повышенных температурах. Это можно объяснить следующим образом: ион металла и поверхностно-активное вещество, также как и органический реагент, окружены достаточно плотными сольватными оболочками; при действии света на отдельные компоненты и комплексные соединения в целом происходит частичная деформация сольватных оболочек, а при низких температурах сольватные оболочки более плотные, и их деформация требует большей затраты энергии.
