
- •Завдання й розділи фізичної хімії
- •Основні термодинамічні поняття й визначення
- •Перший закон термодинаміки
- •Робота розширення при різних процесах
- •Закон гесса.
- •Теплоємність.
- •Тепоємність рідин і твердих речовин.
- •Залежність теплоємності від температури
- •Залежність теплового ефекту хімічної реакції від температури
- •Другий закон термодинаміки. Ентропія.
- •Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
- •Розрахунок зміни ентропії для різних процесів. Постулат планка.
- •Енергія гіббса, енергія гельмгольца. Рівняння гіббса-гельмгольца.
- •Самодовільне протікання хімічної реакції. Розрахунок зміни енергії гіббса в хімічних реакціях.
- •Хімічний потенціал. Активність і летючість. Розрахунок хімічного потенціалу
- •2. Для суміші ідеальних газів:
- •Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
- •Принцип ле-шателье.
- •Ізотерма хімічної реакції.
- •Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
- •Рівновага в гетерогенних реакціях
- •Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
Якщо робота виконується системою тільки проти зовнішнього тиску, то перший закон термодинаміки подається таким математичним виразом:
![]() .
.
Другий
закон термодинаміки для оборотних
процесів набирає вигляду
![]() .
.
Об’єднавши
два рівняння, дістанемо вираз, що поєднує
обидва закони термодинаміки:
![]()
Розрахунок зміни ентропії для різних процесів. Постулат планка.
Розрахунок ентропії для рівноважних (оборотних) процесів.
Другий
закон термодинаміки у вигляді
![]() ,
записаний для рівноважних процесів,
дозволяє обчислити не абсолютне значення
ентропії, а тільки різниця ентропій у
двох станах системи.
,
записаний для рівноважних процесів,
дозволяє обчислити не абсолютне значення
ентропії, а тільки різниця ентропій у
двох станах системи.
![]() . (4)
. (4)
а) Ізотермічні процеси (T = const).
При
постійній температурі протікають
процеси фазових перетворень речовин:
плавлення, випаровування і інші.
Розглянемо
для 1 моля речовини при
рівноважному протіканні цих процесів
тиск зберігається звичайно постійним,
тому
![]() і
і
![]() , (5)
, (5)
де
![]() – ентальпія фазового переходу.
– ентальпія фазового переходу.
Ентропія при фазових переходах змінюється стрибкоподібно. При цьому якщо фазовий перехід відбувається в напрямі зростання температури, ентропія також зростає, а при зворотних процесах( конденсація, кристалізація) зменшується.
б) Ізобарні процеси (р = const).
Якщо нагрівання відбувається при постійному тиску, то
![]() , (6)
, (6)
де n – число молів речовини. Тоді
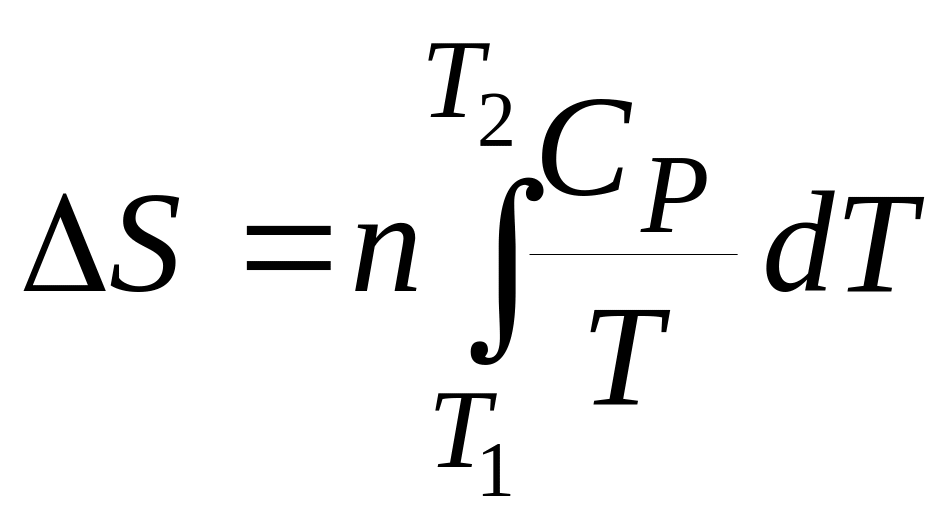 . (7)
. (7)
с) Ізохорні процеси (V = const).
Якщо нагрівання відбувається при постійному об'ємі, то
![]() . (8)
. (8)
Тоді
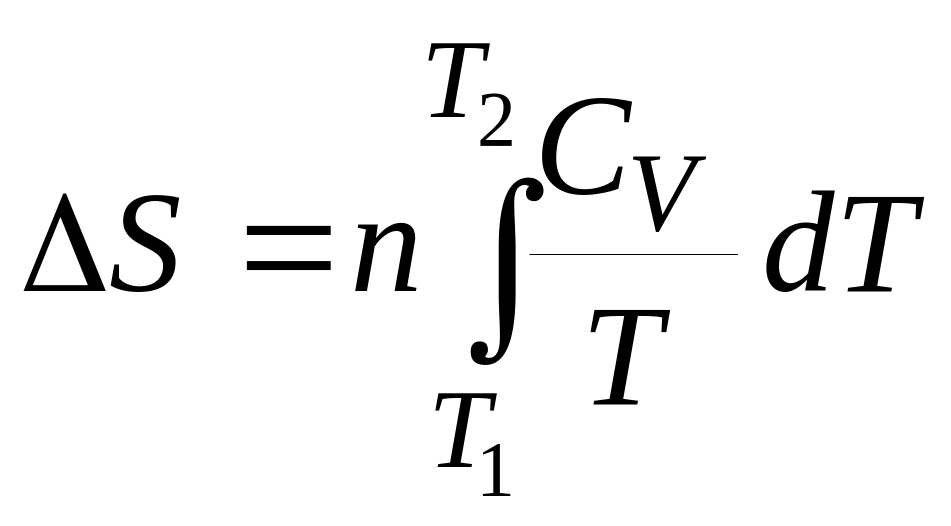 . (9)
. (9)
Для 1 молячи ідеального газу справедливо:
а) При зміні об'єму й температури
![]() , (10)
, (10)
с
обліком, що
![]() .
.
б) При зміні тиску й температури
![]() . (11)
. (11)
(12)
Розрахунок зміни ентропії в ході хімічної реакції.
Розрахунок зміни ентропії в ході хімічної реакції проводиться по формулі:
![]() , (13)
, (13)
де
![]() - стандартні ентропії речовин при Т
= 298 К.
- стандартні ентропії речовин при Т
= 298 К.
Кожна
речовина характеризується стандартною
ентропією
![]() – ентропією 1 моль речовини при 298.15 К
и тиску 1 атм. Значення ентропії мають
розмірність Дж/(моль∙К) або кал/(моль∙К).
Стандартні
ентропії простих речовин не дорівнюють
нулю.
– ентропією 1 моль речовини при 298.15 К
и тиску 1 атм. Значення ентропії мають
розмірність Дж/(моль∙К) або кал/(моль∙К).
Стандартні
ентропії простих речовин не дорівнюють
нулю.
Розрахунок зміни ентропії в ході мимовільних (необоротних) процесів.
Для
необоротних процесів
![]() і рівняння (2.4) не застосовне. Ентропія
– функція стану і її зміна не залежить
від шляху процесу, а визначається
кінцевим і початковим станом системи.
Зміна ентропії в будь-якому нерівновагому
процесі можна обчислити, заміняючи його
деякою сукупністю рівноважних процесів,
що відбувається між тими ж початковими
й кінцевими станами, для кожного з яких
можна розрахувати значення
і рівняння (2.4) не застосовне. Ентропія
– функція стану і її зміна не залежить
від шляху процесу, а визначається
кінцевим і початковим станом системи.
Зміна ентропії в будь-якому нерівновагому
процесі можна обчислити, заміняючи його
деякою сукупністю рівноважних процесів,
що відбувається між тими ж початковими
й кінцевими станами, для кожного з яких
можна розрахувати значення
![]() .
Тоді:
.
Тоді:
![]() . (14)
. (14)
Для будь-якої речовини при будь-якій температурі можна визначити й абсолютне значення ентропії, якщо скористатися постулатом Планка (третій закон термодинаміки): ентропія правильно утвореного кристала чистої речовини при температурі абсолютного нуля дорівнює нулю.
Абсолютним значенням ентропії речовини при температурі Т називається значення ентропії, обчислене згідно з постулатом Планка (тобто розраховане від нуля, якому дорівнює ентропія при Т = 0 К). Абсолютне значення ентропії додатне. Коли температура прямує до абсолютного нуля, не тільки ентропія прямує до нуля, а й її похідні за всіма термодинамічними параметрами. Це означає, що поблизу абсолютного нуля всі термодинамічні процеси відбуваються без зміни ентропії. Це твердження називають тепловою теоремою Нернста.
Для розрахунку абсолютного значення ентропії речовин у стандартному стані потрібно знати залежності теплоємності Ср від температури для кожної з фаз, а також температури та ентальпії фазових переходів. Наприклад, абсолютне значення ентропії речовини в газоподібному стані при температурі Т може бути обчислена по формулі:
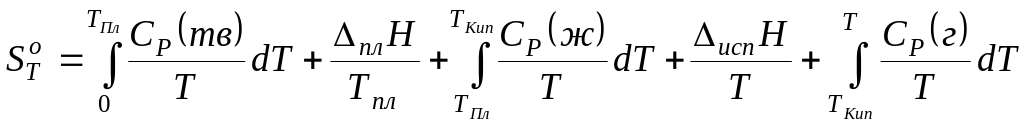 .
.
У термодинамічних таблицях звичайно наводять значення абсолютної ентропії в стандартному стані при температурі 298 К.
