
- •Завдання й розділи фізичної хімії
- •Основні термодинамічні поняття й визначення
- •Перший закон термодинаміки
- •Робота розширення при різних процесах
- •Закон гесса.
- •Теплоємність.
- •Тепоємність рідин і твердих речовин.
- •Залежність теплоємності від температури
- •Залежність теплового ефекту хімічної реакції від температури
- •Другий закон термодинаміки. Ентропія.
- •Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
- •Розрахунок зміни ентропії для різних процесів. Постулат планка.
- •Енергія гіббса, енергія гельмгольца. Рівняння гіббса-гельмгольца.
- •Самодовільне протікання хімічної реакції. Розрахунок зміни енергії гіббса в хімічних реакціях.
- •Хімічний потенціал. Активність і летючість. Розрахунок хімічного потенціалу
- •2. Для суміші ідеальних газів:
- •Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
- •Принцип ле-шателье.
- •Ізотерма хімічної реакції.
- •Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
- •Рівновага в гетерогенних реакціях
- •Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Тепоємність рідин і твердих речовин.
Нині існують точні методи вимірювання теплоємності в широкому інтервалі температур. Досягнуто певних успіхів у розробці теорії теплоємності для простої твердої речовини і для газоподібного її стану при невисоких тисках. Що ж для задовільної теорії теплоємності складної твердої або рідкої речовини, то її досі не існує.
У тому разі, коли для конденсованих речовин відсутні експериментальні дані щодо теплоємності. То користуються двома наближеними емпіричними правилами.
1. Правило Дюлонга і Пті. Атомна теплоємність при постійному об’ємі для будь-якої твердої простої речовини наближено дорівнює 25,94 Дж/моль К.
Це правило більш чи менш поширюється на елементи, атомна маса яких вища ніж у калію. І при порівнянно високих температурах, близько до температур плавлення твердої речовини.
Якщо припустити незмінність теплоємності елементів при утворенні хімічної сполуки, то теплоємність такої сполуки, Дж/моль К:
![]() =
25n,
=
25n,
де n– кількість атомів, що входять у молекулу даної сполуки.
Для легких елементів значення атомних теплоємностей, відмінні від 25,94 Дж/моль К.
Правило адитивності. Молярна теплоємність складних твердих і рідких речовин дорівнює сумі молярних теплоємностей усіх елементів, тобто є величиною адитивною:
![]() ,
,
де С-атомна теплоємність і-го елемента; n – кількість атомів і-го елемента в молекулі.
Для
твердих і рідких речовин
![]() ≈
.
≈
.
Залежність теплоємності від температури
Теплоємність твердих, рідких і газоподібних речовин (за винятком інертних газів і парів лужних металів) зі зростанням температури збільшується. У результаті фазових переходів теплоємність змінюється стрибкоподібно. Теплоємність рідин мало залежить від температури
Якщо в хімічній системі відбувається реакція, то зміна теплоємності дорівнює алгебраїчної сумі теплоємностей продуктів реакції мінус алгебраїчна сума теплоємностей реагентів з урахуванням стехіометричних коефіцієнтів.
![]() (33)
(33)
При цьому теплоємність речовини завжди додатна, а зміна теплоємності може бути як додатною, так і від’ємною чи близько нуля.
Залежність теплового ефекту хімічної реакції від температури
Розглянемо рівняння Кірхгофа, що описує залежність ентальпії реакції від температури:
![]() , (34)
, (34)
![]() – різниця
між сумою теплоємностей продуктів
реакції й вихідних речовин помножених
на стехіометричні коефіцієнти.
– різниця
між сумою теплоємностей продуктів
реакції й вихідних речовин помножених
на стехіометричні коефіцієнти.
Для обчислення інтеграла необхідно знати залежність теплоємності від температури для всіх речовин, що не завжди можливо. Тому рівняння Кірхгофа застосовують у трьох наближеннях.
При найбільш грубому наближенні Сp = 0, тобто вважають рівними сумарні теплоємності продуктів і вихідних речовин. Тоді
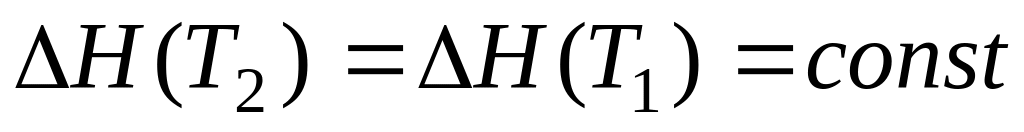 ,
,
т.ч. тепловий ефект уважається не залежним від температури. Цим наближенням користуються, якщо теплоємності деяких учасників реакції невідомі.
У другому наближенні вважають різницю теплоємностей постійною величиною СР = const. Тоді
![]() . (35)
. (35)
Це рівняння застосовують тільки для невеликого інтервалу температур Т2 – Т1, у якому відомі величини теплоємностей.
У найбільш точному наближенні використовують залежність всіх СРi від температури. Якщо теплоємності речовин дані у вигляді поліномів, наприклад (34), то рівняння Кірхгофа можна проінтегрувати, після чого воно буде мати такий вигляд:
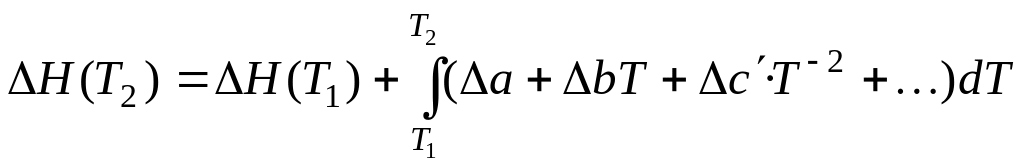 . (36)
. (36)
Другий закон термодинаміки. Ентропія. Обчислення зміни ентропії для різних процесів. Постулат Планка. Енергія Гіббса й енергія Гельмгольца. Рівняння Гіббса-Гельмгольца. Мимовільне протікання хімічних реакцій. Розрахунок зміни енергії Гіббса в хімічних реакціях. Хімічний потенціал. Активність і летючість.
