
- •Завдання й розділи фізичної хімії
- •Основні термодинамічні поняття й визначення
- •Перший закон термодинаміки
- •Робота розширення при різних процесах
- •Закон гесса.
- •Теплоємність.
- •Тепоємність рідин і твердих речовин.
- •Залежність теплоємності від температури
- •Залежність теплового ефекту хімічної реакції від температури
- •Другий закон термодинаміки. Ентропія.
- •Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
- •Розрахунок зміни ентропії для різних процесів. Постулат планка.
- •Енергія гіббса, енергія гельмгольца. Рівняння гіббса-гельмгольца.
- •Самодовільне протікання хімічної реакції. Розрахунок зміни енергії гіббса в хімічних реакціях.
- •Хімічний потенціал. Активність і летючість. Розрахунок хімічного потенціалу
- •2. Для суміші ідеальних газів:
- •Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
- •Принцип ле-шателье.
- •Ізотерма хімічної реакції.
- •Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
- •Рівновага в гетерогенних реакціях
- •Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Принцип ле-шателье.
Як відзначалося раніше, хімічні рівноваги є динамічними й рухливими. При зміні зовнішніх умов може відбуватися зрушення рівноваги убік утворення або продуктів реакції, або вихідних речовин. Уперше принцип зсуву рівноваги сформулював Ле-Шателье.
Принцип Ле-Шателье: якщо на систему, що перебуває в рівновазі, робити зовнішній вплив, то рівновага зміщається убік того процесу, що зменшує цей вплив.
Теоретично цей принцип був заснований Ф. Брауном і тепер відомий, як принцип Ле-Шателье - Брауна.
Математично цей принцип може бути представлений у вигляді:
![]() ,
,
![]() , (11)
, (11)
де
![]() – константа рівноваги, xi–
узагальнена сила, yi–
узагальнена сполучена даній силі xi
координата. Нерівність (4.11) має наступний
сенс: зміна узагальненої сили (інтенсивний
параметр) при сталості інших сил зміщає
рівновага в такому напрямку, при якому
зміна сполученої узагальненої координати
перешкоджає зміні узагальненої сили.
Якщо розглядають вплив
температури
(узагальненої сили) при сталості інших
інтенсивних параметрів на хімічну
рівновагу, то як сполучена координата
використовують тепловий
ефект реакції.
Чим більше по величині тепловий ефект
реакції, тим сильніше впливає на положення
рівноваги зміна температури. При
зміні тиску
– узагальненої сили – сполученою
узагальненою координатою буде зміна
об'єму в ході реакції, узяте зі зворотним
знаком.
– константа рівноваги, xi–
узагальнена сила, yi–
узагальнена сполучена даній силі xi
координата. Нерівність (4.11) має наступний
сенс: зміна узагальненої сили (інтенсивний
параметр) при сталості інших сил зміщає
рівновага в такому напрямку, при якому
зміна сполученої узагальненої координати
перешкоджає зміні узагальненої сили.
Якщо розглядають вплив
температури
(узагальненої сили) при сталості інших
інтенсивних параметрів на хімічну
рівновагу, то як сполучена координата
використовують тепловий
ефект реакції.
Чим більше по величині тепловий ефект
реакції, тим сильніше впливає на положення
рівноваги зміна температури. При
зміні тиску
– узагальненої сили – сполученою
узагальненою координатою буде зміна
об'єму в ході реакції, узяте зі зворотним
знаком.
Отже, підвищення (або зниження) температури системи зміщує рівновагу у тому напрямку, у якому поглинається (або виділяється) теплота. Підвищення тиску зміщає рівновага в напрямку зменшення об'єму системи.
Ізотерма хімічної реакції.
Рівняння ізотерми (або просто ізотерма) хімічної реакції дозволяє зв'язати можливий напрямок хімічної реакції з вихідною сполукою реагуючих речовин. При дослідженні хімічних процесів частіше користуються величиною G, що є індикатором реакційної здатності речовин у процесах при Т, р = const.
Зміна енергії Гіббса в ході протікання хімічної реакції між газоподібними речовинами дорівнює
![]()
![]()
![]()
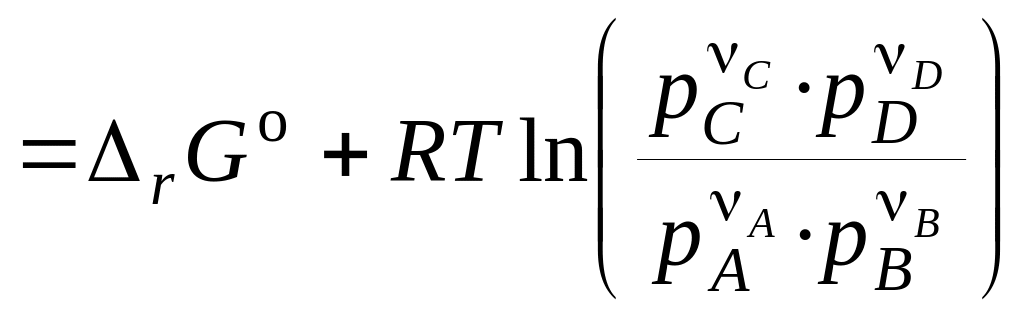 . (12)
. (12)
При
настанні рівноваги в системі
![]() ,
тоді
,
тоді
![]() , (13)
, (13)
де
![]() — стандартна зміна енергії Гіббса
хімічної реакції (коли всі речовини
перебувають у стандартних умовах).
Виходить,
— стандартна зміна енергії Гіббса
хімічної реакції (коли всі речовини
перебувають у стандартних умовах).
Виходить,
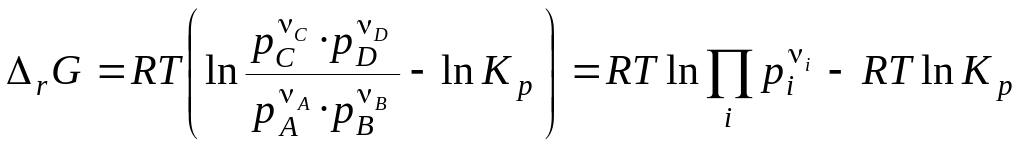 , (14)
, (14)
![]() , (15)
, (15)
де pi — початкові (задані) парціальні тиски учасників реакції.
Останні рівняння називають рівняннями ізотерми хімічної реакції або рівняннями Вант–Гоффа. Вони виражають залежність r від сполуки системи, тобто залежність між термодинамічним потенціалом реакції r, константою хімічної рівноваги (Кp) і умовами проведення реакції.
По рівнянню ізотерми хімічної реакції можна розрахувати зміна енергії Гіббса при відповідних умовах, тобто визначити можливість, напрямок і межа протікання мимовільного процесу. Щоб мимовільно здійснювалася пряма реакція, зміна енергії Гіббса (r) повинне бути негативним, а це можливо за умови:
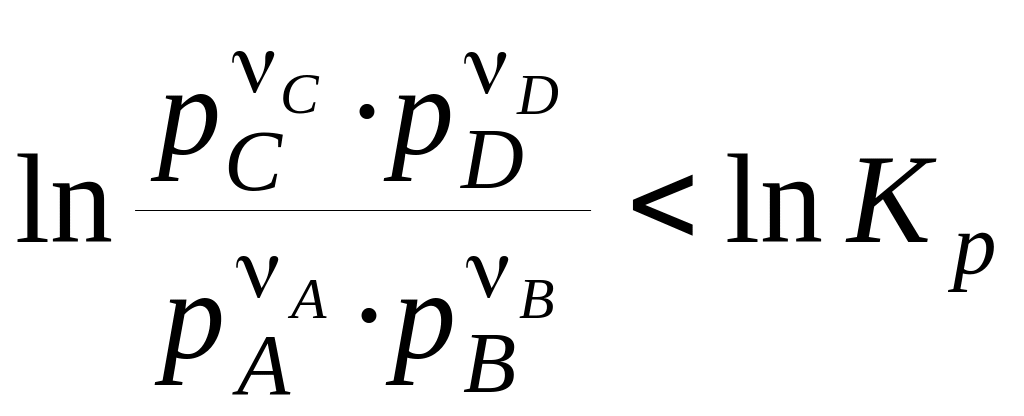 . (16)
. (16)
Якщо
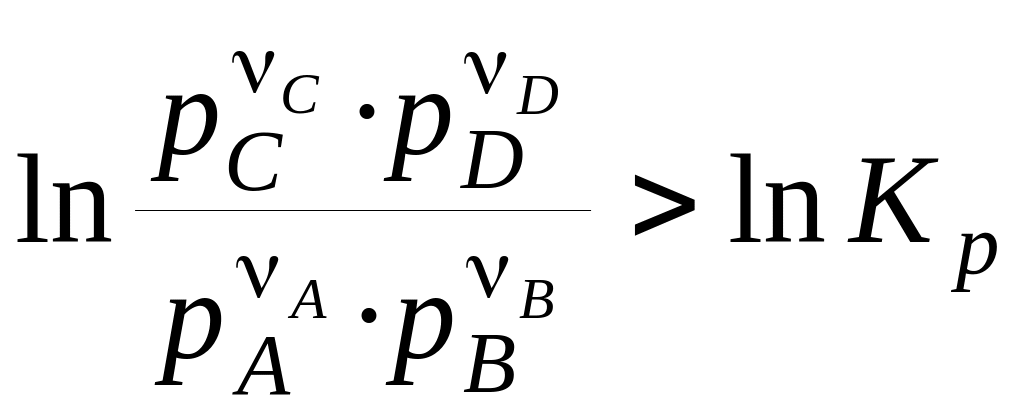 , (17)
, (17)
те мимовільно піде зворотна реакція.
При встановленні рівноваги:
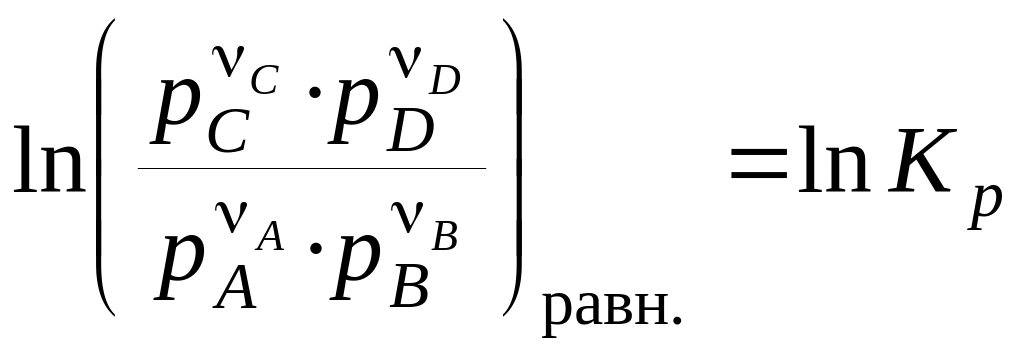 , (18)
, (18)
де pi — рівноважні парціальні тиски учасників реакції.
Аналогічним способом одержують вираження для зміни енергії Гельмгольца для процесів, що протікають при T, V = const:
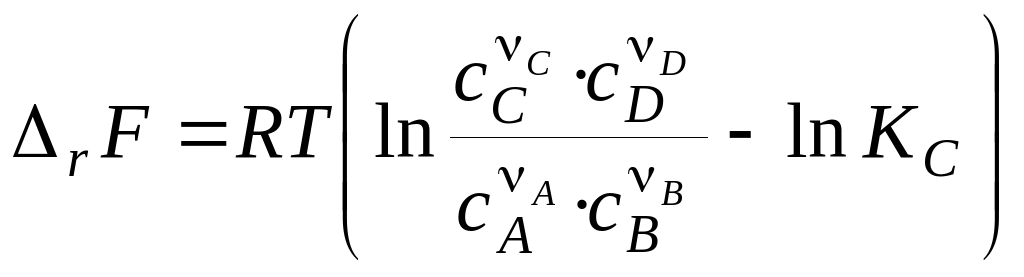 . (19)
. (19)
