
- •Завдання й розділи фізичної хімії
- •Основні термодинамічні поняття й визначення
- •Перший закон термодинаміки
- •Робота розширення при різних процесах
- •Закон гесса.
- •Теплоємність.
- •Тепоємність рідин і твердих речовин.
- •Залежність теплоємності від температури
- •Залежність теплового ефекту хімічної реакції від температури
- •Другий закон термодинаміки. Ентропія.
- •Математичне об’єднання першого і другого законів термодинаміки для термодинамічно оборотних процесів
- •Розрахунок зміни ентропії для різних процесів. Постулат планка.
- •Енергія гіббса, енергія гельмгольца. Рівняння гіббса-гельмгольца.
- •Самодовільне протікання хімічної реакції. Розрахунок зміни енергії гіббса в хімічних реакціях.
- •Хімічний потенціал. Активність і летючість. Розрахунок хімічного потенціалу
- •2. Для суміші ідеальних газів:
- •Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
- •Принцип ле-шателье.
- •Ізотерма хімічної реакції.
- •Зв'язок стандартної зміни енергії гіббса реакції з константою рівноваги. Розрахунок rG и rG0.
- •Рівновага в гетерогенних реакціях
- •Вплив температури на хімічну рівновагу. Рівняння ізохори й ізобари хімічної реакції.
Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас.
Хімічною рівновагою називається такий стан оборотного процесу
![]() ,
,
при
якому швидкість прямої реакції (![]() ) дорівнює швидкості зворотної (
) дорівнює швидкості зворотної (![]() ) реакції, і внаслідок цього
сполука
системи
згодом не змінюється.
Рівновага встановлюється не тому, що
процес припинився, а в результаті
протікання процесу у двох напрямках з
однаковою швидкістю, тобто рівновага
має динамічний характер. Крім того,
стійкі рівновага характеризуються:
незмінністю рівноважного стану системи
при збереженні зовнішніх умов; можливістю
підходу до стану рівноваги із двох
протилежних сторін; рухливістю рівноваги.
) реакції, і внаслідок цього
сполука
системи
згодом не змінюється.
Рівновага встановлюється не тому, що
процес припинився, а в результаті
протікання процесу у двох напрямках з
однаковою швидкістю, тобто рівновага
має динамічний характер. Крім того,
стійкі рівновага характеризуються:
незмінністю рівноважного стану системи
при збереженні зовнішніх умов; можливістю
підходу до стану рівноваги із двох
протилежних сторін; рухливістю рівноваги.
По основному постулаті кінетики швидкості прямого й зворотного процесів виражаються в такий спосіб:
![]() , (1)
, (1)
![]() , (2)
, (2)
т.ч. швидкість хімічної реакції прямо пропорційна концентрації реагуючих речовин, зведених у ступені, які дорівнюють їх стехіометричним коефициентам.
kпр і kобр — константи швидкості прямій і зворотної реакцій.
У рівновазі:
![]() , (3)
, (3)
![]() . (4)
. (4)
Константи швидкості прямій і зворотної реакцій не залежать від концентрацій і при постійній температурі є постійними величинами. Тому їхнє відношення є деяка постійна величина КС -константа хімічної рівноваги:
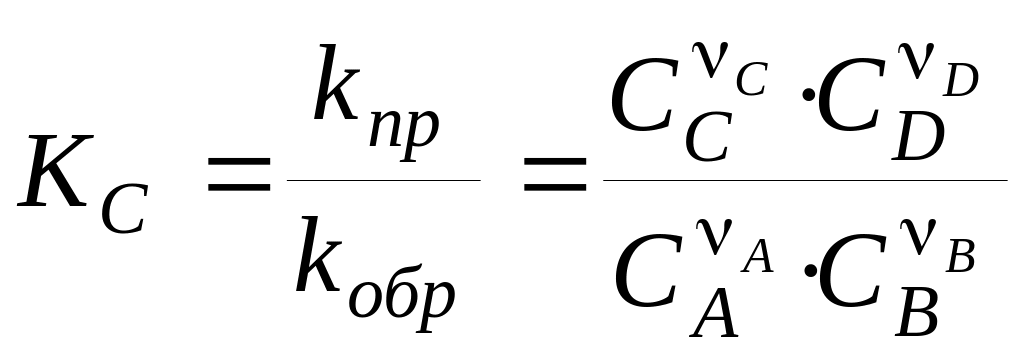 , (5)
, (5)
Термодинамічні константи рівноваги.
У випадку реальних систем рівноважні концентрації у вираженні (5) заміняють на рівноважні активності (аi) і одержують термодинамічну константу хімічної рівноваги:
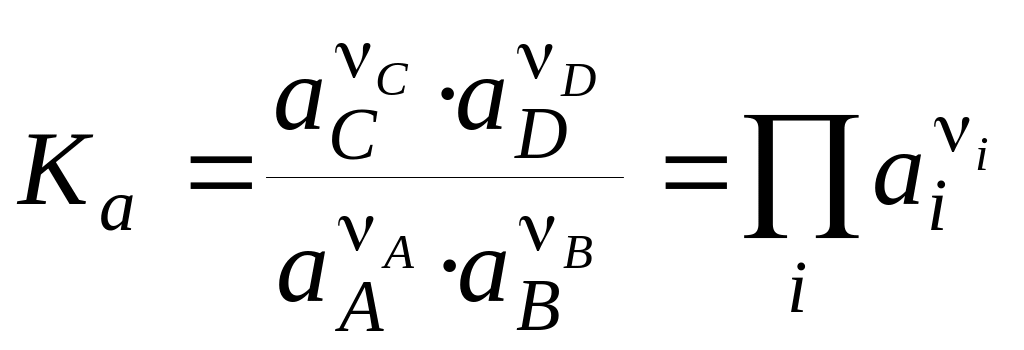 , (6)
, (6)
де
i
– стехіометричні коефіцієнти рівняння
реакції. Величини
![]() позитивні для продуктів реакції й
негативні для вихідних речовин.
позитивні для продуктів реакції й
негативні для вихідних речовин.
Константи хімічної рівноваги, виражені через рівноважні парціальні тиски рi або рівноважні фугитивності fi учасників реакції, мають вигляд:
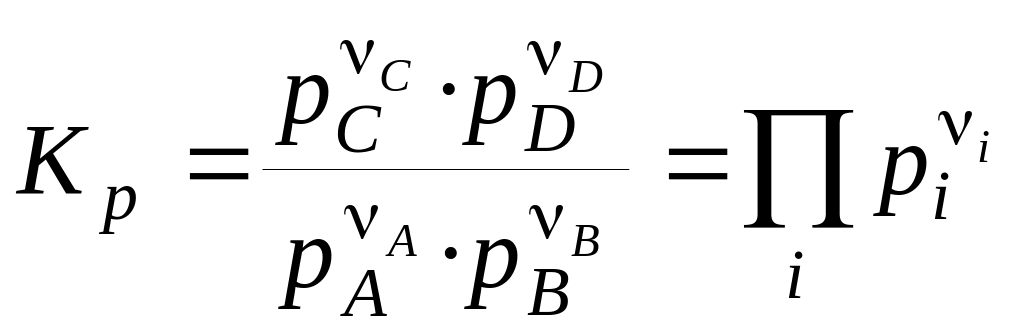 , (7)
, (7)
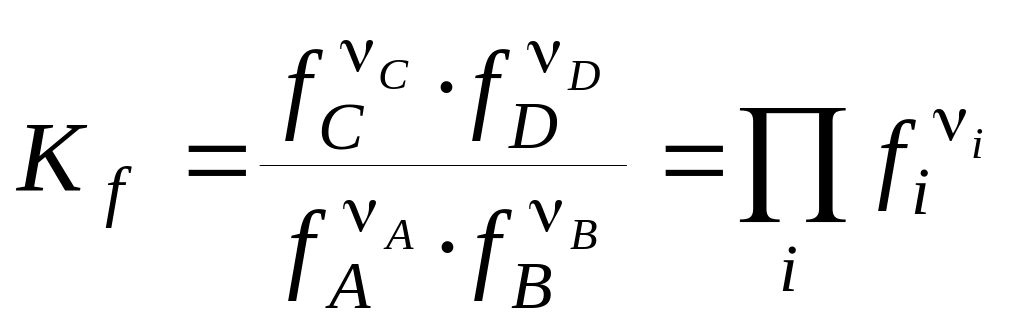 . (8)
. (8)
Наведені вище рівності для констант рівноваги виражають закон, що був сформульований К. Гульдбергом і П. Вааге – закон діючих мас, тобто відношення добутку рівноважних парціальних тисків (концентрацій) продуктів реакції, узятих у ступенях, рівних їх стехіометричним коефіцієнтам, до такого ж добутку рівноважних парціальних тисків (концентрацій) вихідних речовин при даній температурі є величина постійною, називаною константою хімічної рівноваги. Одним з важливих висновків із закону дії мас полягає у встановленні взаємозв'язку парціальних тисків (або концентрацій) всіх речовин, які беруть участь у реакції. В умовах рівноваги парціальні тиски (або концентрації) всіх речовин, що беруть участь у реакції, зв'язані між собою. Не можна змінити парціальний тиск (або концентрації) жодного з них, щоб це не спричинило такої зміни парціальних тисків (або концентрацій) всіх інших речовин, що беруть участь у реакції, що не привело б до колишнього чисельного значення константи рівноваги за даних умов.
Знайдемо зв'язок між КР і КС для реакцій між ідеальними газами. Виразимо рівноважні парціальні тиски за допомогою рівняння Менделєєва-Клапейрона:
![]()
![]() . (9)
. (9)
Тоді, на підставі рівнянь (5) і (7), маємо
![]() , (10)
, (10)
де ∆ν- зміна числа молей газоподібних речовин у ході реакції.
