
- •38. Де Бройль гипотезасы.Де Бройль толқындары. Анықталмағандық принцип
- •37. Резерфорд тәжірибелері.Атомның құрылысы. Атомның планетааралық моделі
- •35. Бор постулаттары. Франк және Герц тәжірибелері.Бор постулаттарының тәжірибелік расталуы.
- •1. Электрондар ядро айналасында дискреттік стационарлық орбиталар бойымен қозғалады, осындай орбиталарда қозғалғанда сәуле шығарылмайды.
- •2. Электрондар бір стационарлық орбитадан екінші стационарлық орбитаға ауысқанда сәулелер -энергия кванты түрінде шығарылады немесе жұтылады. (1.2)
- •34. Сутегі атомының Бор ұсынған моделі. Бор теориясының кемшіліктері. Сутегі атомының энергия деңгейлерінің диаграммасы.
- •33. Шредингер теңдеуі.Стационарлық күйлер.Квантталу. Бір өлшемді потенциалдық шұңқырдағы бөлшек. Сызықтық гармоникалық осциллятор
- •Функциясы мына шартты қанағаттандырады
- •30. Бір электронды атомның толқындық функциялары. Энергия деңгейлерінің азғындалу дәрежесі. Күйлердің белгіленуі, сұрптау ережелері.
- •29. Паули принципі. Атомдардың электрондық қабаттары мен қабықтары. Элементтердің периодтық жйесінің негізгі заңдылықтары
- •Берілген электрондық конфигурацияның ең кіші энергиясына мүмкін болатын ең үлкен s спині мәні бар және осындай s жағдайында мүмкін болатын ең үлкен l мәні бар терм ие болады.
- •Осы жағдайда, егер қабықтың толтырылуы жартысынан аз болса, онда , қалған басқа жағдайларда болады.
- •28. Сілтілік элемент атомның құрлымы. Энергия деңгейлері кванттық ақау. Сілтілік элемент атомының спектрі
- •27. Сілтілік элемент атомдарының энергетикалық деңгейі және аса нәзік түзіліс
- •26. Атомдар мен молекулалардың сыртқы электр өрісімен әсерлесуі. Штрак эффектісі
- •25. Атомдардың сыртқы магнит өрісімен әсерлесуі. Зееман эффектісі
- •24. Атомдардың электрондар арасындағы байланыс түрлері
- •23. Молекуланың электрондық спектрі. Франк-Кондон принципі.
- •22. Молекулалардың айналысы тербелісі. Екі атомды молекуланың айналыс тербеліс спектірі
- •5.1 Сурет. Екі атомды молекуланың
- •21. Молекула құрлысы мен қасиеттері. Екі атомды молекуланың энергетикалық күйі
- •5.4 Сурет
Берілген электрондық конфигурацияның ең кіші энергиясына мүмкін болатын ең үлкен s спині мәні бар және осындай s жағдайында мүмкін болатын ең үлкен l мәні бар терм ие болады.
Осы жағдайда, егер қабықтың толтырылуы жартысынан аз болса, онда , қалған басқа жағдайларда болады.
28. Сілтілік элемент атомның құрлымы. Энергия деңгейлері кванттық ақау. Сілтілік элемент атомының спектрі
Сутегі атомы-ең қарапайым атом, сондықтанда оны қарапайым аналитикалық әдістермен есептеу мүмкін болады. Басқа атомдар үшін есеп едәуір күделенеді де жуық және сандық әдістерді пайдалануға тура келеді. Бірақта сілтілік металдар үшін көптеген маңызды нәтижелерді едәуір оңайырақ алуға мүмкіндік бар екен. Бұл олардың атомдарының электрондық құрылымының ерекшелігіне байланысты.
Сілтілік
металдар элементтердің периодтық
жүйесінде инертті газдардан кейін
орналасады:
![]() ,
,
![]() ,
,
![]() т.т. және алдыңғы инертті газдарға
қарағанда бір электроны артық болады.
Инертті газдардың атомдары өте орнықты.
Бұларды иондау үшін едәуір үлкен энергия
қажет. Сілтілік металдар бір валентті
және бұларды өте оңай иондауға болады.
Бұл сілтілік металл атомының электрондық
құрылымының ерекшелігіне байланысты.
Егер сілтілік металл атомында барлығы
Z электрон болса, атомның Z-1 электроны
инертті газ атомының электрондық
құрылымын құрайды, ал соңғы электрон
осы электрондармен және ядромен өте
әлсіз байланысқан деп қарастыруға
болады. Сонымен, ядро мен алғашқы Z-1
электрон бірігіп заряды +е атомдық тұлға
(қалдық) құрап тұрады, мұның тиімді
өрісінде валенттік деп аталатын электрон
қозғалады. Сонымен сілтілік метал
атомдары сутегі тәрізді атомдар болып
табылады, бірақ толық емес. Мәселе
мынада: сыртқы электрон алғашқы Z-1
электрондар қабығын біршама деформациялайды
осыдан бұлардың өрісі біршама бұрмаланады.
Сондықтан валенттік электрон қозғалатын
өрістің потенциалдық энергиясын мына
түрге келтіріп жазуға болады:
т.т. және алдыңғы инертті газдарға
қарағанда бір электроны артық болады.
Инертті газдардың атомдары өте орнықты.
Бұларды иондау үшін едәуір үлкен энергия
қажет. Сілтілік металдар бір валентті
және бұларды өте оңай иондауға болады.
Бұл сілтілік металл атомының электрондық
құрылымының ерекшелігіне байланысты.
Егер сілтілік металл атомында барлығы
Z электрон болса, атомның Z-1 электроны
инертті газ атомының электрондық
құрылымын құрайды, ал соңғы электрон
осы электрондармен және ядромен өте
әлсіз байланысқан деп қарастыруға
болады. Сонымен, ядро мен алғашқы Z-1
электрон бірігіп заряды +е атомдық тұлға
(қалдық) құрап тұрады, мұның тиімді
өрісінде валенттік деп аталатын электрон
қозғалады. Сонымен сілтілік метал
атомдары сутегі тәрізді атомдар болып
табылады, бірақ толық емес. Мәселе
мынада: сыртқы электрон алғашқы Z-1
электрондар қабығын біршама деформациялайды
осыдан бұлардың өрісі біршама бұрмаланады.
Сондықтан валенттік электрон қозғалатын
өрістің потенциалдық энергиясын мына
түрге келтіріп жазуға болады:
![]() (1.2.16)
(1.2.16)
Мұндағы
![]() ,
,
![]() және т.т. мүшелер сілтілік метал атомдары
өрісінің сутегі атомы өрісінен өзгешелігін
ескеретін түзетулер. Есептеулерде тек
бірінші түзетуді ескерумен шектелеміз.
Сонда (1.2.5а) теңдеуінің орнына мына
теңдеу алынады
және т.т. мүшелер сілтілік метал атомдары
өрісінің сутегі атомы өрісінен өзгешелігін
ескеретін түзетулер. Есептеулерде тек
бірінші түзетуді ескерумен шектелеміз.
Сонда (1.2.5а) теңдеуінің орнына мына
теңдеу алынады
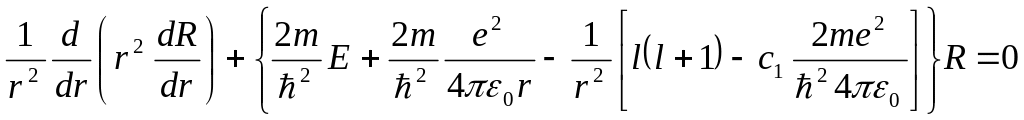 (1.2.5б)
(1.2.5б)
Осы теңдеу, егер
![]() (1.2.17)
(1.2.17)
деп алынса, онда ол (1.2.5а) теңдеуімен толық дәл келеді. Сонда бұрынғы есептеулерге l шамасының орнына (1.2.17) формуласымен анықталатын l′ шамасы енеді. (1.2.17) квадраттық теңдеуді шешкенде, l′ үшін мына өрнек алынады
![]() .
(1.2.18а)
.
(1.2.18а)
Сутегі
атомы үшін жүргізілген барлық есептеулер
сілтілік метал атомдары үшін өзгеріссіз
қолданылады. Сонда l
орнына барлық формулаларға l′
шамасы енеді.
![]() бас кванттық саны
бас кванттық саны
![]() (1.2.19)
(1.2.19)
санымен алмастырылады, мұндағы
![]() (1.2.18б)
(1.2.18б)
кванттық ақау деп аталады, ал энергия деңгейлері үшін (1.2.7) формула мына формуламен алмастырылады:
![]() ,
(1.2.20)
,
(1.2.20)
Мұнда енді энергия n бас кванттық санға ғана емес, l орбиталық кванттық санға да тәуелді болады. Энергияның орбиталық кванттық санға тәуелділігі сілтілік металл атомдары энергия деңгейлерінің сутегі атомы энергия деңгейлерінен принциптік айырмашылығы болып табылады.
