
- •Лекция № 1 основы строения органических соединений. Номенклатура органических соединений
- •I. По типу углеродного скелета
- •II. По типу связи
- •III. По наличию функциональных групп
- •Названия важнейших углеводородных радикалов
- •Префиксы и суффиксы применяемые для обозначения важнейших характеристических групп (в порядке падения старшинства)
- •Метан метаналь этан этаналь
- •Лекция № 2 сопряжение. Ароматичность. Электронные эффекты заместителей
- •Лекция №3 изомерия органических соединений
- •Лекция №4 кислотность и основность органических соединений
- •Природа элемента в кислотном центре
- •Стабильность аниона за счёт сопряжения
- •Влияние радикала на стабильность аниона
- •Влияние растворителя на стабильность аниона
- •Лекция №5 гидроксисоединения, их реакционная способность
- •По количеству –он групп спирты делятся на:
- •1) Одноатомные спирты (r-oh)
- •2) Многоатомные спирты (полиолы)
- •2. Реакция нуклеофильного замещения (sn):
- •3. Реакции дегидратации
- •4. Реакция этерификации с образованием сложных эфиров:
- •5. Качественная реакция на многоатомные спирты
- •Реакции окисления фенолов:
- •Реакции электрофильного замещения: (sе )
- •Лекция № 6 карбонильные соединения, их реакционная способность
- •2. Восстановление альдегидов и кетонов
- •4. Альдоновая и кротоновая конденсация:
- •Лекция № 7 карбоновые кислоты и их функциональные производные
- •1. Гидроксикислоты, содержащие группу –он:
- •1. Предельные высшие жирные кислоты:
- •2. Непредельные высшие жирные кислоты:
- •Строение карбоксильной группы
- •Химические свойства карбоновых кислот
- •Реакции галогенирования (реакции в сн-кислотном центре):
- •Пути превращения ацетоуксусной кислоты в организме:
- •Медико-биологическое значение карбоновых кислот
- •Лекция № 8 биологически важные гетероциклические соединения
- •Производные пиррола:
- •Лекция № 9 углеводы. Моносахариды
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы:
- •II. По числу атомов углерода в цепи:
- •Альдогексозы
- •1)Глюкоза (виноградный сахар). Энантиомером d-ряда углеводов соответствует энантиомер l-ряда с противоположной конфигурацией всех центров хиральности.
- •6) К специфическим свойствам относятся различные виды окисления моносахаридов, реакции изомеризации и брожения.
- •Сахарные кислоты
- •Лекция № 9 сложные углеводы. Олигосахариды. Полисахариды
- •Невосстанавливающие дисахариды
- •2) Реакции окисления
- •Гомополисахариды. Крахмал, строение и биологическая роль
- •Гетерополисахариды. Гиалуроновая кислота
- •Гликопротеины
- •Лекция № 10 аминокислоты, их реакционная способность
- •Классификация -аминокислот по составу боковой цепи
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные)
- •Лекция № 11 пептиды и белки
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Лекция № 12 нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Третичная структура днк представляет собой многократную спирализацию вторичной структуры, обеспечивая плотную упаковку днк в ядре клетки.
- •Лекция№13 липиды
- •Жиры и масла (триацилглицеролы, триацилглицерины) – это сложные эфиры глицерола (глицерина) и высших жирных кислот, в которых все три гидроксида ацилированы.
- •Простые Смешанные
- •2. Гидрогенизация:
- •3. Присоединение иода:
- •Щелочной гидролиз:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
Лекция № 1 основы строения органических соединений. Номенклатура органических соединений
ЦЕЛИ ЛЕКЦИИ
Обучающая – Формирование знаний о строении, номенклатуре органических соединений.
Развивающая – Расширение кругозора обучающихся на основе интеграции знаний; развитие логическое мышление.
Воспитательная – Содействие формированию у обучающихся устойчивого интереса к изучению дисциплины «Биоорганическая химия».
ПЛАН ЛЕКЦИИ
Основы строения органических соединений.
Номенклатура органических соединений.
СОДЕРЖАНИЕ ЛЕКЦИИ
Основы строения органических соединений
Органическая химия – это химия соединений углерода.
Особенности органических веществ:
Многообразие в природе: около 27 млн. (неорганических веществ – около 100 тысяч).
Образуются небольшим количеством атомов-неметаллов, которые получили названия органогены: С, Н, О, N (реже S, Р, галогены).
Атомы в составе молекулы соединены между собой в определенном порядке, в соответствии с их валентностью. Атом углерода четырехвалентен.
Порядок соединения атомов называется химическим строением молекулы и отображается с помощью структурных формул.

Основные связи – ковалентные:
По полярности различают:
С–С – неполярные ковалентные связи;
С–Н – малополярные ковалентные связи;
С–О; С–N – полярные ковалентные связи.
По симметрии орбиталей различают:
σ-Cвязь – ковалентная связь, образованная при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов:

π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных p-орбиталей. При этом локализованные p-атомные орбитали делокализуются, образуя π-орбитали:

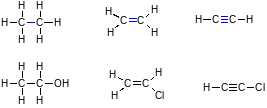
По порядку связи различают:
О
 динарные
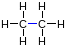
(1 σ-связь), например, в молекуле этана
(длина связи 0,154 нм):
динарные
(1 σ-связь), например, в молекуле этана
(длина связи 0,154 нм):
Двойные (1 σ-связь и 1 π-связь), например, в молекуле этилена (0,134 нм):

Т
 ройные
(1
σ-связь и 2 π-связи), как например, в
молекуле ацетилена (0,120 нм):
ройные
(1
σ-связь и 2 π-связи), как например, в
молекуле ацетилена (0,120 нм):
Ионная связь встречается в органических соединениях редко:

В одородные
связи поддерживают вторичную структуру
белков. В α-структуре белков каждый
первый и пятый остатки аминокислот
образуют между собой водородные связи,
формируя спираль:
одородные
связи поддерживают вторичную структуру
белков. В α-структуре белков каждый
первый и пятый остатки аминокислот
образуют между собой водородные связи,
формируя спираль:
В основном органические вещества имеют молекулярное строение.
Для них характерна низкая температура плавления, соединения не прочны.
Атом углерода образует связи в состоянии:
sp3-гибридизации (характерна для алканов): С–С;
sp2-гибридизации (характерна для алкенов): С=С;
sp-гибридизации (характерна для алкинов): С≡С.
Гибридизация – процесс выравнивания энергии и образование равноценных по форме и энергии орбиталей.
Электронное строение атома углерода: 1s22s22p2

sp3-Гибридизация. В этом случае выравниваются энергии одной 2s и трёх 2p-орбиталей, при этом образуются 4 одинаковые sp3-орбитали:


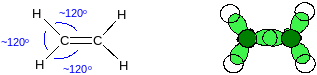
sp2-Гибридизация. Энергии одной 2s и двух 2p-орбиталей выравниваются, при этом образуются 3 одинаковые sp2-орбитали и остаётся одна негибридная p-орбиталь:

Гибридные орбитали отталкиваются друг от друга, образуя треугольную (тригональную) структуру, поэтому атом углерода в состоянии sp2-гибридизации называется тригональным:

Негибридная p-орбиталь располагается перпендикулярно плоскости, проходящей через три гибридные орбитали:

Три sp2-гибридные орбитали участвуют в образовании трёх σ-связей: например в этилене:
Две негибридные орбитали перекрываются с образованием π-связи:
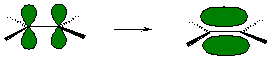
sp-Гибридизация. В этом случае выравниваются энергии одной 2s и одной 2π-орбиталей, при этом образуются 2 одинаковые sp-орбитали и остаются негибридными две p-орбитали.
Две sp-гибридные орбитали отталкиваются друг от друга, при этом максимумы электронной плотности располагаются на одной прямой:

Две негибридные p-орбитали располагаются перпендикулярно друг другу в одной плоскости, которая перпендикулярна этой прямой x:
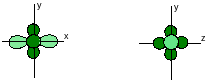

Классификация органических соединений
