
Дистанционные лекции / Лекция растворы
.pdfРАСТВОРЫ
Раствор – термодинамически устойчивая гомогенная система, состоящая не менее чем из двух компонентов.
Классификация растворов
по агрегатному состоянию растворы делят на:
-газовые,
-жидкие,
-твердые.
по числу компонентов – на:
-бинарные,
-многокомпонентные.
по способности проводить электрический ток:
-электролиты,
-не электролиты.
термодинамическая классификация:
-идеальные (совершенные),
-предельно разбавленные,
-неидеальные (реальные).
Все компоненты раствора равноценны. Принято преобладающий по количеству компонент называть растворителем (обозначают подстрочным индексом 1).
Компоненты с меньшим содержанием называют растворенными веществами
(подстрочные индексы 2, 3 и т.д.).
В случае, если растворенное вещество газ или твердое, а раствор жидкий, растворителем считают жидкость.
Важнейшей характеристикой раствора является его состав (концентрации компонентов).
Известны различные способы выражения концентрации. Состав раствора часто выражают как количество растворенного вещества, отнесенное к молю раствора, к единице массы раствора или растворителя, или к единице объема раствора. Наиболее распространённые способы выражения концентрации растворов перечислены в следующей таблице.
1
Массовая доля |
|
|
|
|
|
|
|
||||
|
|
= |
|
|
|
|
|||||
|
|
|
∑ |
||||||||
|
|
|
|
|
|
|
|
|
|||
Молярная доля |
|
|
|
|
|
|
|
||||
|
= |
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
∑ |
||||||
|
|
|
|
|
|
|
|
|
|||
Моляльность |
|
|
|
1000 ∙ |
|||||||
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||||
|
|
|
|
|
|
|
|||||
Молярность |
|
|
|
|
|
|
|
||||
= |
|
||||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Один моль раствора – такое количество раствора, в котором число молей каждого компонента равно его мольной доле. В моле раствора сумма молей всех компонентов равна единице.
Термодинамическое условие образования раствора
Процесс образования раствора рассматривается при , = . Если при данных условиях энергия Гиббса смешения компонентов ∆раст. < 0, то раствор существует, процесс его образования из чистых компонентов является самопроизвольным.
Раствор характеризуется определенными термодинамическими свойствами, которые подразделяются на экстенсивные (зависящие от количества раствора) и интенсивные (не зависящие от количества раствора).
Вещество, переходя в раствор, становясь компонентом, теряет свою индивидуальность.
Характеристики относя к раствору как целому, а не к составляющим его веществам. Каждый компонент вносит свой вклад в экстенсивные свойства раствора.
Парциальные молярные величины
Чтобы оценить вклад каждого компонента в экстенсивное свойство раствора применяют парциальные величины.
Парциальное свойство, отнесенное к 1 молю компонента, называют парциальной молярной величиной. Обозначается горизонтальной чертой над буквенным обозначением свойства.
Рассмотрим на примере объема.
Парциальный молярный объем вещества в растворе – это изменение общего объема при добавлении одного моля вещества к бесконечно большому объему раствора (или, если раствор бинарный, к бесконечно большому объему чистого жидкого второго компонента).
При этом первоначальный состав раствора остается неизменным. Это можно осуществить двумя способами:
2
-прибавить 1 моль компонента к бесконечно большому количеству раствора и определить изменение объема;
-прибавить к конечному количеству раствора бесконечно малое количество компонента
ипересчитать полученное изменение объема на 1 моль прибавляемого вещества.
Определенное таким образом изменение объема при условии постоянства давления и
температуры является парциальным молярным объемом компонента раствора.
̅ |
|
|
|
|
|
|
) |
|
= ( |
|
|
|
|
|
|
, , |
|
|
|
|
|
|
≠ |
Таким образом, |
|
|
Парциальной молярной (мольной) |
величиной (или парциальным мольным |
|
̅ |
|
|
|
|
|
|
|
свойством) компонента раствора называют частную производную экстенсивного свойства |
|||||||
|
|
|
|
|
|
|
|
раствора L по числу молей этого компонента при постоянных давлении, температуре и числе |
|||||||
молей остальных компонентов. |
|
|
|
|
|
|
|
|
|
̅ |
|
|
) |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
= ( |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
, , |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≠ |
|
где L – экстенсивное свойство раствора. Для указания на то, что речь идет о парциальном |
|||||||
мольном свойстве, ставят горизонтальную черту над буквенным обозначением свойства. |
|||||||
Для чистого вещества парциальная молярная величина равна свойству 1 моля чистого |
|||||||
вещества. |
|
|
|
|
|
|
|
Одной из важнейших парциальных молярных величин является химический потенциал. |
|||||||
|
̅ |
|
|
) |
= |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|||
|
= ( |
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
, , |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
≠ |
|
Все парциальные молярные величины |
являются интенсивными характеристиками |
||||||
состояния компонента в растворе, они зависят от температуры, давления и концентрации других компонентов, т.е. состава раствора.
Зависимость парциальных молярных величин от состава раствора.
Уравнения Гиббса-Дюгема
Полный дифференциал экстенсивного свойства раствора можно представить уравнением
= ∑ ̅
=1
Интегрируя это уравнение при постоянном составе раствора, получаем 1-е уравнение
Гиббса-Дюгема:
3
= ∑ ̅
=
Любое экстенсивное свойство раствора является аддитивным относительном парциальных молярных свойств компонентов, образующих раствор.
Дифференцируя 1-е уравнение Гиббса-Дюгема по обеим переменным, получим 2-е
уравнение Гиббса-Дюгема:
∑ ̅ =
=
Из уравнения следует, что изменение состава раствора при постоянных температуре и давлении приводит к изменению обеих парциальных молярных величин, причем они изменяются в противоположных направлениях. Если первая возрастает, то вторая убывает, если первая имеет минимум, то вторая –максимум и наоборот.
Методы определения парциальных молярных величин
Парциальные молярные величины находят в результате математической обработки экспериментальных данных о зависимости экстенсивного свойства раствора от его состава.
Метод касательных
Аналитический вариант Для аналитического вычисления парциальных молярных величин необходимо выразить
зависимость экстенсивного свойства от числа молей растворенного вещества при неизменном числе молей растворителя.
Например,
= + ∙ 2 + ∙ 22
Дифференцируя уравнение по числу молей растворенного вещества и подставляя значение 2, определяют парциальное молярное свойство растворенного вещества.
̅ |
|
|
|
|
|
|
|
|
|
2 |
= ( ) |
= + 2 ∙ 2 |
||
|
|
2 |
, , |
|
|
|
|
|
1 |
Графический вариант Если зависимость экстенсивного свойства раствора от числа молей растворенного
вещества представлена в виде графической зависимости, то, определяя тангенс угла наклона касательной, проведенной к кривой при заданном количестве растворенного вещества 2 ,
рассчитывают парциальную молярную величину растворенного вещества.
4
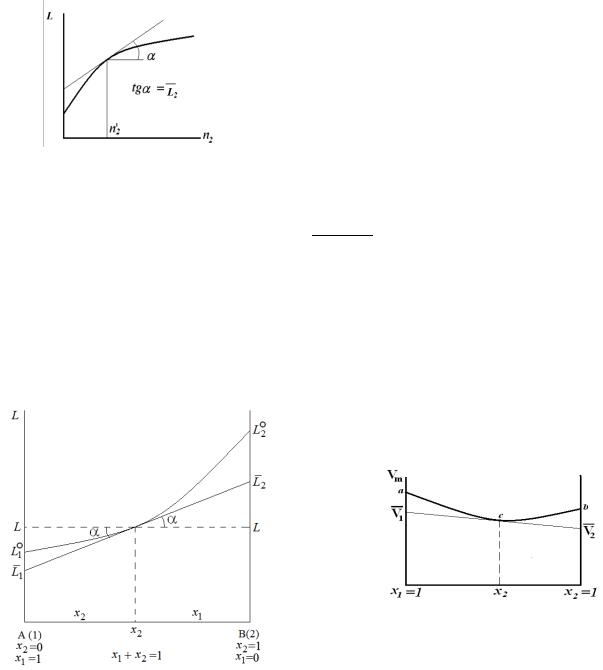
Парциальную молярную величину другого компонента можно найти по 1-му уравнению Гиббса-Дюгема.
̅1 = − ̅2 2
1
Метод пересечений (отрезков)
Этот метод особенно пригоден для веществ, смешивающихся в любых отношениях.
Строят график зависимости экстенсивного свойства одного моля раствора от мольной доли компонентов.
Вточке, отвечающей заданному составу, проводят касательную, которая при пересечении
сординатами дает значение парциальных молярных величин первого и второго компонентов в растворе при данном составе.
Относительные парциальные молярные величины
Разность между парциальной молярной величиной компонента в растворе и молярной
величиной компонента в стандартном состоянии называют относительной парциальной
мольной величиной.
∆̅ = ̅ −
5
Когда за стандартное состояние вещества принято его состояние в чистом виде,
относительная парциальная молярная величина является функцией смешения, т.е. изменением данного свойства в процессе растворения.
Функции смешения
Функция смешения – изменение термодинамической функции при образовании растворов из чистых веществ – разность значений этой функции для раствора и суммы значений для чистых исходных веществ:
∆см = р−ра − ∑ °
В термодинамике растворов рассматривают также мольные функции смешения,
отнесённые к 1 молю раствора, – разность мольного свойства раствора и суммы свойств чистых компонентов:
∆см = р−ра − ∑ °
Функции смешения двухкомпонентных идеальных растворов:
Энергия Гиббса смешения
∆см = р−ра − (10 1 + 20 2) = (1̅ 1 + ̅2 2) − (10 1 + 20 2)
учитывая, что ̅= и = 0 + , получим
∆см = 1 1 + 2 2
Энтропия смешения
∆см = −1 1 − 2 2
Энтальпия смешения
∆см = 0
Идеальные (совершенные) растворы
Идеальный раствор определяют как раствор, при образовании которого из компонентов взятых в одинаковом состоянии в любых соотношениях выполняются следующие условия:
не изменяется объем;
не изменяется энтальпия;
изменение энтропии равно изменению энтропии при смешении идеальных газов;
изменение энергии Гиббса равно изменению энергии Гиббса при смешении идеальных газов;
химический потенциал i-го компонента идеального раствора равен = 0 + ;
для каждого из компонентов во всем диапазоне концентраций справедлив закон Рауля.
6
В идеальном растворе, в отличие от идеального газа, между молекулами существует равновесие, но энергии взаимодействия между однородными и разнородными молекулами примерно равны.
Условием равновесия жидкости и пара является равенство химических потенциалов в обеих фазах каждого компонента раствора.
(ж)= (п)
Пусть пар – идеальный газ, а жидкость – идеальный раствор.
|
(ж) |
= 0 |
+ |
|
|
(ж) |
|
||
|
(п) |
= 0 |
+ |
|
|
|
(п) |
|
|
После ряда преобразований получим уравнение, называемое законом Рауля.
=
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Другая формулировка закона Рауля: относительное понижение пара компонента 1 над раствором равно молярной доле второго компонента.
|
|
− |
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Растворы, для которых выполняется закон Рауля, называют идеальными растворами. |
||||
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы,
компоненты которых существенно различаются по физическим и химическим свойствам,
подчиняются закону Рауля лишь в области бесконечно малых концентраций.
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе – пар относительно богаче компонентом, температура кипения которого ниже). Рассмотрим бинарный раствор, состоящий из компонентов A и B, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
= + = 0 + 0
7
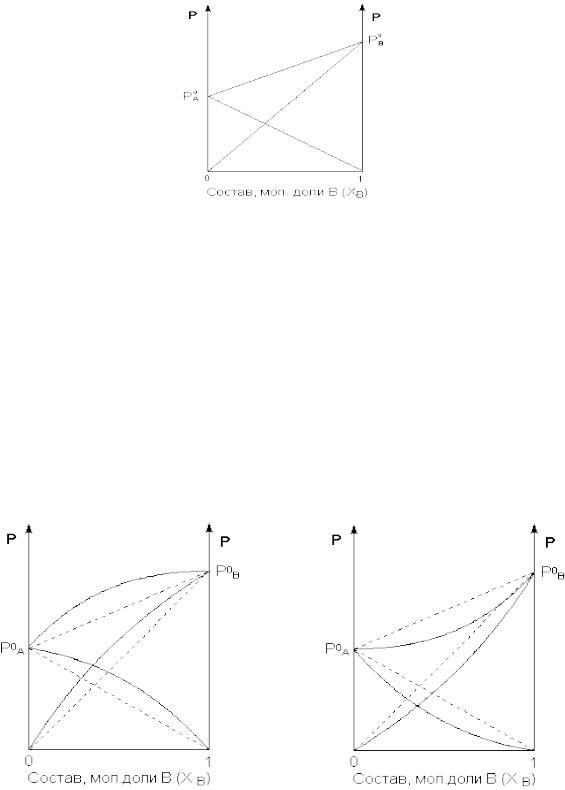
Таким образом, для идеальных бинарных растворов зависимость общего и парциального давления насыщенного пара от состава раствора, выраженного в мольных долях компонента В,
является линейной при любых концентрациях.
Неидеальные (реальные) растворы
Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты ( Нраств > 0), растворы с отрицательными отклонениями образуются с выделением теплоты ( Нраств < 0).
8
Предельно разбавленные растворы
(компоненты раствора неограниченно растворимы друг в друге)
Впредельно разбавленных растворах один компонент в избытке (растворитель), а
концентрация второго компонента очень мала по сравнению с растворителем.
Впредельно разбавленных растворах закону Рауля подчиняется только растворитель.
Крастворимому веществу применим закон Генри: парциальное давление пара растворенного вещества над предельно разбавленным раствором пропорционально молярной доле растворенного вещества.
= г
Константа Генри не является свойством только растворенного вещества, она является свойством раствора и определяется экспериментально.
Стандартное состояние компонентов раствора
При рассмотрении реальных растворов вводят понятие активности и коэффициента активности. Значения активности и коэффициента активности зависят от выбора стандартного состояния.
Стандартное состояние – такое состояние компонента в растворе, с которым сравнивается поведение этого компонента в растворах любой концентрации.
Наибольшее распространение получили две системы стандартных состояний:
симметричная и несимметричная.
В симметричной системе для всех компонентов за стандартное состояние принимают состояние чистого вещества при заданных значениях давления и температуры. В симметричной системе все компоненты равноправны. Симметричная система применима, когда компоненты смешиваются друг с другом в любых соотношениях.
Если растворенное вещество является твердым, газообразным или имеет ограниченную растворимость, а раствор жидким, применяют несимметричную систему. В этом случае в качестве стандартного состояния компонентов выбирают их состояние в гипотетическом растворе, обладающим свойствами бесконечно разбавленного, но имеющего конечную концентрацию.
9
Разбавленные растворы нелетучих веществ в летучем растворителе.
Коллигативные свойства
Нелетучими считают вещества, давление паров которых ничтожно мало по сравнению с давлением пара растворителя.
Если растворенное вещество нелетуче, то пар над раствором содержит только пары растворителя. Для таких растворов закон Рауля применим только к растворителю.
0 |
− |
|
1 |
1 |
= |
|
0 |
|
|
2 |
|
|
1 |
|
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Относительное понижение давления пара растворителя над раствором является коллигативным свойством раствора.
Коллигативные свойства зависят от природы растворителя и концентрации растворенного вещества и не зависят от природы растворенного вещества.
К коллигативным свойствам относят:
-относительное понижение давления насыщенного пара растворителя над раствором;
-понижение температуры замерзания раствора;
-повышение температуры кипения раствора;
-осмотическое давление.
Понижение температуры замерзания раствора
Раствор в отличие от чистой жидкости не отвердевает целиком при постоянной температуре; при некоторой температуре, называемой температурой начала кристаллизации,
начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой замерзания раствора всегда понимают именно температуру начала кристаллизации). Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания Тзам (или Тотв), равной разности между температурой замерзания чистого растворителя T°зам и температурой начала кристаллизации раствора.
Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации, на которой кривая ОF есть зависимость давления пара над твердым растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно. Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда
10
