
Дистанционные лекции / Лекция растворы
.pdf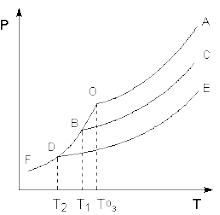
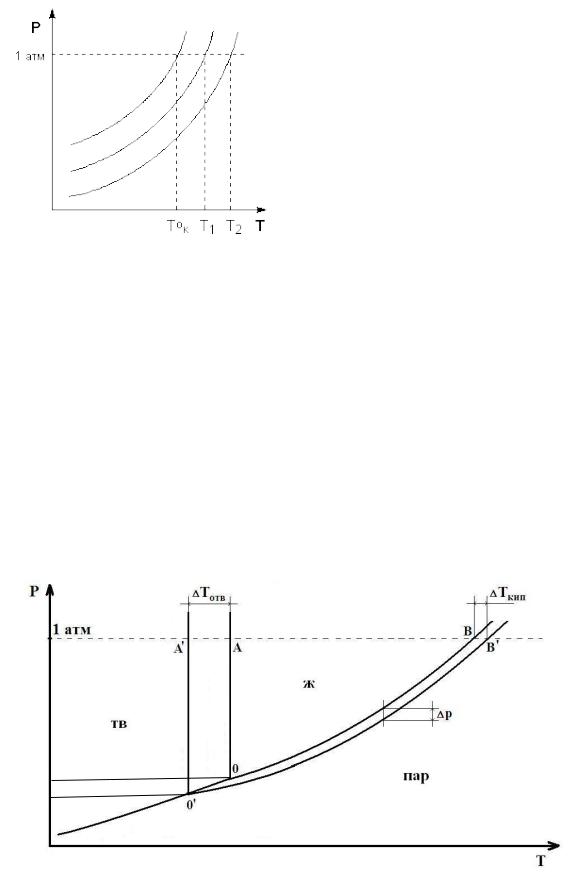
будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
∆зам =
Коэффициент пропорциональности KK – криоскопическая постоянная растворителя – определяется природой растворителя.
Повышения температуры кипения раствора
Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении. Рассмотрим Р – T диаграмму состояния растворителя и растворов различной концентрации. Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно температуры,
при которых изобара Р = 1 атм, пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей.
Повышение температуры кипения растворов нелетучих веществ ΔTкип. = Tкип. – T°кип.
пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности
Кэ – эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
∆кип. = Э
11
Таким образом,
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Эбулиоскопическая и криоскопическая константы имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг.
Таким образом, три из четырёх коллигативных свойств разбавленных растворов можно изобразить на p-T-диаграмме состояния растворителя.
∆
12
Осмотическое давление разбавленных растворов
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой,
пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора количественно характеризуются величиной осмотического давления.
Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть
осмотическое давление π. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению:
=
Это уравнение является так называемым принципом Вант-Гоффа:
Осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
Применение закона Рауля и следствий из него к растворам электролитов
Электролиты – вещества, которые в растворе распадаются на ионы – электрически заряженные частицы, способные к самостоятельному существованию в растворе.
В растворах электролитов все рассмотренные коллигативные свойства выше, чем для растворов неэлектролитов. Причиной этого является электролитическая диссоциация. Ионы в растворе действуют как отдельные частицы. Следовательно коллигативные свойства зависят от общей концентрации молекул и ионов в растворе.
Вант-Гофф ввел поправку, связанную с диссоциацией, называемую изотоническим коэффициентом Вант-Гоффа:
= 1 + ( − 1)
α – степень диссоциации электролита; ν – число ионов, на которые диссоциирует 1 молекула электролита.
Применение криоскопических и эбулиоскопических измерений и измерений
осмотического давления для определения молекулярной массы растворенного вещества
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора.
∆зам. =
13

∆кип. = Э
Оба метода заключаются в точном до тысячных долей градуса определении изменения температуры. Для таких измерений предназначен специальный термометр Бекмана. Применяя растворители с известными криоскопическими и эбулиоскопическими константами и измеряя изменение температуры кипения и замерзания, можно определить молярную массу растворенного вещества.
= |
|
∙ ∙ 1000 |
|
|
2 |
||
2 |
|
|
1∆зам |
|
|
|
|
|
= Э ∙ 2 ∙ 1000 |
||
2 |
|
|
1∆кип |
|
|
|
|
Более точным считают криоскопический метод, так как криоскопические постоянные больше эбулиоскопических и эффект понижения температуры замерзания больше,
следовательно, меньше погрешность, и аппаратура для криоскопических измерений проще.
Эбулиоскопический метод применяют для веществ, у которых мала растворимость при низких температурах.
Измерение осмотического давления также можно использовать для определения молярной массы растворенного вещества, в частности для определения молярной массы высокомолекулярных соединений.
2 = 2
р−ра
Молярная масса растворённого вещества, определённая по коллигативным свойствам,
называется кажущейся. Она может не совпадать с истинной из-за эффектов диссоциации или ассоциации растворённого вещества (формулы не учитывают коэффициент i).
14
