
- •Зертхана ұйымдастырылатын бөлмелерге қойылатын талаптар.
- •Зертханаларды ұйымдастырудың негізгі принциптері.
- •4. Лабораторияларда өрттен сақтану және еңбекті қорғаудың қауіпсіздік ережелері.
- •5. Алғашқы медициналық көмек.
- •8.Химиялық ыдыстар, олардың классификациясы.
- •9)Химиялық құрамына байланысты ыдыстардың жіктелуі: шыны, фарфор, пластмасса және темірден жасалған ыдыстар.
- •10)Қолданылу салаларына байланысты шыны ыдыстардың жіктелуі: жалпы, арнайы зерттеулер үшін қолданылатын және өлшеуіш ыдыстар
- •Химиялық ыдыстардың көлемдерін тексеру (нақты мысал: есеп келтіре отырып).
- •12)Химиялық ыдыстарды тазалау, жуу әдістері мен сақтау жолдары.
- •Жууға арналған арнайы реактив қоспаларының түрлері, құрамы және оларды дайындау.
- •14) Химиялық реактивтер, олардың классификациясы
- •15) Құрамының тазалығы бойынша реактивтердің жіктелуі
- •16. Әртүрлі зерттеулер үшін пайдаланылатын химиялық реактивтер (оқу процесі, ғылыми зерттеулер, аналитикалық жұмыстар).
- •17. Химиялық реактивтерді тазалау (кристаллизация) әдістері мен сақтау жолдары.
- •20. Оңай және қиын еритін реактивтер.
- •21. Ерітінділердің классификациясы
- •22. Ерітінділерді дайындау техникасы
- •23.Ерігіштікке әсер етуші факторлар
- •24. Ерітінді концентрациялары: проценттік, нормальды, молярлы және моляльді ерітінділер.
- •25. Тұздардан, сілтілілерден және қышқылдардан ерітінділер дайындау.
- •26. Концентрлі қышқылдардан ерітінділер дайындау, оның ережелері мен сақтық жолдары.
- •27. Фиксаналдар.
- •28. Ареометрлер.
- •29. Дәлдігі шамалы, дәл және эмпирикалық ерітінділер.
- •30. Ерітінділерді сұйылту.
- •31. Буферлік ерітінділер.
- •39. Титрлеу әдісі, оған қажетті құрал-жабдықтар.
- •40. Титрлеу әдісін биологиялық зерттеулерде қолдану (мысалдар).
- •41. Индикаторлар.
- •42. Титриметриялық (көлемдік) анализдер әдісіне сипаттама беріңіз.
- •43. Қышқыл-негіздік, тұнбаға түсіру және кешенді қосылыс түзілу және тотығу-тотықсыздану әдістерін түсіндіріңіз.
- •44. Тікелей титрлеу, алмастыру және кері титрлеу әдістерін түсіндіріңіз.
- •45. Титрленген ерітінділерді дайындаудағы жалпы ережелерді түсіндіріңіз.
- •46. Фиксаналдар туралы және олардың қолданылу аспектілерін көрсетіңіз.
- •47. Сутектік көрсеткіш деген не?
- •Зерттеу жұмыстарындағы бұл көрсеткіштің орны қандай?
- •Хроматография әдістері: хроматография принциптері, қолдану салалары. Хроматография түрлеріне қысқаша сипаттама беріңіз.
- •Колонкадағы хроматография, принципі. Төменгі қысым жағдайындағы хроматография техникасы.
- •67.Гель-фильтрация әдісі.
- •64.Жоғары қысым жағдайындағы хроматография техникасы.
- •70.Адсорбциялы қроматография, принципі, қолданылу салаларын көрсетіңіз
- •71.Ионалмасу хроматографиясы.
- •72.Хроматографиялық жүйенің компоненттері: ионалмастырушылар, элюенттер, хроматографияланатын заттар туралы мағлұмат беріңіз.
- •73.Аффинді хроматография, принципі.
- •74.Аффинді сорбенттердің компоненттері: матрицалар, матрицалардың активациясы, спейсерлер, лиганд түрлері.
- •75.Қолданылу салалары мен жұмыс барысын түсіндіріңіз.
- •76.Қағаздағы хроматография: принципі.
- •77.Хроматография жүргізуге арналған қажетті материалдар.
- •78. Хроматографиялық фракцияларды анықтау.
- •80. Әдістің биологиялық және биотехнологиялық зерттеулерде қолданылуын көрсетіңіз.
- •81. Зертхана ұйымдастырылатын бөлмелерге қойылатын талаптар.
- •82. Зертханаларды ұйымдастырудың негізгі принциптері.
- •83. Зертханаларда жұмыс жасау кезіндегі техника қауіпсіздігінің және өрттен сақтану ережелерін түсіндіріңіз.
Зерттеу жұмыстарындағы бұл көрсеткіштің орны қандай?
Сутектік көрсеткіш (рН) – теріс таңбамен алынған сутегі иондарының концентрациясының ондық логарифмін айтады. рН= -lg[Н + ]
Мысалы: [Н + ]=10-4 болғанда, рН- -lg[Н + ]= -lg[10-4]=4.
Сутектік көрсеткіш түсінігін 1909 ж. дат химигі Соренсен енгізді. Р-əрпі дат тіліндегі «роtens» – математикалық дəреже бастапқы əрпі, Н –сутегі символы.
Ерітіндінің қышқылдығын немесе сілтілігін жоғарыда қолданылғандай теріс мәнді көрсеткіші бар сандармен жазу, жұмыс кезінде қиындық туғызады, сондықтан оған басқа ыңғайлырақ әдісті қолданады:сутек иондарының нақты концентрациясының орнына ,оның теріс таңбамен алынған ондық логарифм көрсетеді.Ол сутектік көрсеткіш деп аталып,РН арқылы белгіленеді. Ерітіндінің рН білу химиялық зерттеу жұмыстарында да,әр түрлі өндірістік процестерде де,тірі органимдерде де жүретін құбылыстарды түсіндіруде өте керек.Көпшілік жағдайда рН дәл мәнін емес ,ерітіндінің реакциясы қандай,қышқыл ма,немесе сілтілік пе-соны сапалық турде білу жеткілікті болады, олүшін индикатор деп аталатын арнаулы реактивтерді пайдаланылады.Ол индикаторлар сутек иондарының концентрациясына қарай өз түсін өзгертіп ,ерітінді –қышқыл ,бейтарап не сілтілік екенін көрсетеді.Жиі қолданатын индикаторлар : лакмус, фенол-фталейн, метилоранж.
Ерітіндінің рН-ын анықтау әдісін түсіндіріңіз. Ерітіндінің қышқылдығы немесе сілтілігіне сипаттама беруге бір ионның концентрациясын есептеу жеткілікті. Негізінде Н+ ионының (халықаралық конвенция бойынша қабылданған) концентрациясын (г экв/л) анықтайды. Сутегі ионының концентрациясы кіші сан болғандықтан, ерітіндінің реакциясын есептегенде және жазғанда рН символымен өрнектейді. рН = - lg[H+]мұндағы сутектік көрсеткіш – сутегі ионы концентрациясының теріс ондық логарифмі. Бұл символды 1909 жылы Серенсон енгіздірген. Барлық ерітінділердің күшті қышқылдықтан күшті сілтіге дейінгі реакция ортасын 0-ден 14-ке дейінгі аралықта жатқан рН шкаласымен көрсетуге болады.Мысалы, рН = 0 болғанда, [H+] = 100 = 1 тең, яғни 1 л сұйықтықта 1 г сутегі ионы болатынын көрсетеді.Ортаның реакциясын анықтағанда рН шамасына температураның әсер ететінін ұмытпаған жөн, температура жоғарылаған сайын судың диссоциациялану деңгейі де арта түседі.Әрбір иондардың биологиялық және химиялық процестерде белгілі бір рөлі бар. Басқа иондармен салыстырғанда сутегі ионының алатын орны ерекше. Оның ферменттік белсенділікте мәні айтарлықтай. Ферменттік реакцияның жылдамдығы максималды болғанда әрбір ферменттің белгілі бір рН кезінде өзінің әсер ету белсенділігі болады. Кейде рН тез әсер етуінен ферменттің әрекеті рН мәнінің сол аймағында ғана көрініс алады. Ферменттер белок секілді электр зарядына қабілетті, сондықтанда оның құрылысы рН шамасына тәуелді. Сутегі ионы концентрациясының ағзалардың тіршілік әрекетіне, жануарлар мен адамдардың функционалды әрекеттеріне әсері зор. Дифтерия микробы 7,3-7,6 рН аралығында, ішек таяқшалардың микробы рН=6-7 аралығында дамиды; топырақ микробының азоттық белсенді фиксациясы рН=7,2 кезінде жүреді. Жылы қанды жануарлардың өлімі қанның рН 0,03-0,04 бірлікке (қалыпты жағдайда рН=7,350,02) ауытқығанда байқалады. Қалыпты жағдайда араласқан тамақтанудан несеп реакциясы қышқылды немесе бейтарапты (рН=5,0-7,0). Несеп реакциясын жаңа несепте анықтайды. Тамақтануда жануар белогы басым болса қышқыл ортаға, ал өсімдік тамағынан – сілтілі ортаға жылжиды. Бірден болатын қышқылды реакция безгекте, диабетте, аштыққанда байқалады. Несептің сілтілі реакциясы циститте, пиелитте, гематурияда, құсқанда, іш өткенде, сода мен минералды суды пайдаланғанда байқалады. Сутегі иондарының әсерінен заттардың және ерітінділердің негізгі физико-химиялық қасиеттері өзгеруі мүмкін: ерігіштігі, беттік керілу, тұтқырлығы, тұрақтылығы, осмостық қысымы, ісінуі т.б. Бұл айтылғандардың барлығы химияда, биологияда, медицинада, ауылшаруашылығында және техникада сутегі иондарының концентрациясын анықтаудан алынған.рН шамасын өлшеуге шынылы және қосымша электродтардан тұратын жүйе қолданады (сурет 2.1). Электродты ерітіндіге салғанда шыны электродтың шарик беті мен ерітінді арасында ион алмасу жүреді, Нәтижесінде шынының беттік қабатындағы литий ионы сутегі ионымен орын ауыстырады, электрод сутегі электродының қасиетіне ие болады.
Буферлік ерітінділердің ерекшеліктері неде? Буферлі ерітінділер − бұл қышқыл немесе сілтінің аз мөлшерін қосқанда немесе сұйылту кезінде рН мәндерін өзгертпейтін ерітінділер. Буферлі ерітінділердің құрамында әлсіз қышқыл және оның тұзы немесе әлсіз негіз және оның тұзы болады, мысалы:
CH3COOH+CH3COONa − ацетатты буферлі ерітінді;
NH 4OH+NH 4Cl − аммиакты буферлі ерітінді.
Ацетатты буферлі ерітіндіні мысал ретінде қарастырып, әлсіз қышқыл және оның тұзынан құралған буферлі ерітіндінің рН-ын есептеу формуласын шығарайық:
CH3COOH↔CH3COO-+H+ реакциясы үшін:
Kд=

Осыдан сутек иондарының концентрациясын табайық:
[H+
]=Kд ∙
∙
Теңдеудің екі жағын логарифмдесек:
lg[H+] = lgKд + lg ,
Таңбаларды керілерге ауыстырсақ:
−lg[H+] = − lgKд –lg ,
pH = pK CH3COOH − ∙
Жалпы түрде, әлсіз қышқыл және оның тұзынан құрылған буферлі ерітінді үшін:
pH
= pK HAn
− lg
Бұл жерде рК теріс таңбамен алынған әлсіз қышқылдың диссоциациялану константаның ондық логарифмі.Теңдеу Гендерсон-Гассельбах теңдеуі деп аталады.Әлсіз негіз және оның тұзынан құрылған буферлі ерітінді үшін:
NH 4OH ↔ NH 4+ + OH-
Әлсіз негіздің диссоциациялану константасы келесі теңдеу арқылы өрнектеледі:
K
=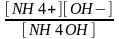
Диссоциациялану константасының теңдеуінен гидроксил иондарының концентрациясын анықтайық:
[OH-]=
Kд
Теңдеудің екі жағын логарифмдесек және таңбаларын керілерге ауыстырсақ, онда
−lg [OH-]= −lg Kд − lg ;
pOH=pKNH4OH −lg ;
Жалпы түрде, pH+pOH=14 екенін ескерсек:
pH
=14 − pKKtOH
+ lg .
.
Адам организмінде жүретін физиологиялық және биохимиялық үдерістерді үйлестіретін және ішкі ортадағы тұрақтылықты (температура, қан қысымы, рН-тың оптималды мәндері, т.б.) қамтамасыз ететін механизмдер бар. Осы үйлестіру үдерісі Кеннонның ұсынуы бойынша гомеостазис деп аталған (“гомео” деген сөз тұрақтылықты білдіреді). Гомеостазис биологиялық активті заттар арқылы (ферменттер, гормондар) жүйке реттеуші механизмдердің қатынасында іске асырылады және организмдегі қанда, ұлпа сұйықтықтарында, лимфада жүретін үдерістер гуморальды реттеу деп аталады. Гуморальды және жүйке компоненттері бір бірімен тығыз байланысқан және бірыңғай нейро гуморальды комплексті түзеді.
Қанның және ұлпа сұйықтықтардың рН-ын тұрақты деңгейде ұстап тұру қандағы буферлі жүйелер арқылы іске асырылады. Олардың ішінде келесілер негізгілер болып табылады:
Гидрокарбонатты буферлі жүйе, әлсіз көмірқышқыл молекулалар мен оның диссоциациялану нәтижесінде түзілетін гидрокарбонат иондары арасындағы тепе теңдікпен сипатталады:
HCO3- + H+ ↔ HCO-3
HCO3- + H2O ↔ H2CO3 + OH-
Адаморганизмінетағамментүсетінкөмірсулар, белоктар, майлартотыққандакөмірқышқылгазыбөлінеді, олсуменәрекеттескендекөмірқышқылытүзіледі. Бұлүдеріскекарбоангидразаферментініңәсеріболғандажылдамжүреді.
Фосфаттыбуферліжүйегидрофосфатжәнедигидрофосфатиондарыныңарасындағытепетеңдіккенегізделген:
HPO42-+H+ ↔ H2PO-4
HPO42-+H+↔ H2PO -4+OH-
Оксигемоглобин-гемоглобин буферлі жүйесі қанның буферлік сыйымдылығының 75%-ынқұрайды. Бұл буферлі жүйе Hb- гемоглобин иондары мен өте әлсіз қышқыл болып табылатын HHb-гемоглобин арасындағы, сондай ақ оксигемоглобин иондары HbO2 және гемоглобинмен салыстырғанда күштілеу оксигемоглобиннің арасындағы тепе-теңдіктерге негізделген (KHHb=6,3∙10-9, pKHHb=8,2, KHHbO2=1,12∙10-7, pKHHbO2=6,95):
Hb-+H+↔HHb
Оларды дайындаудың ерекшеліктерін мысал келтіре отырып түсіндіріңіз. Диаметрі бірдей 6 пробиркаға 0,1н сірке қышқылы және 0,1 н натрий ацетаты ерітінділерінен кестеде көрсетілгендей мөлшерде құйыңыздар.
Ерітінділер, мл |
№ пробиркалар |
|||||
1 |
2 |
3 |
4 |
5 |
6 |
|
0,1н сірке қышқылы, мл |
4,5 |
4 |
2,5 |
1,5 |
1 |
0,5 |
0,1 н натрий ацетаты, мл |
0,5 |
1 |
2,5 |
3,5 |
4 |
4,5 |
Есептелген рН мәні |
3,7 |
4,0 |
4,6 |
5,0 |
5,2 |
5,6 |
Тәжірибе кезінде табылған рН мәні |
|
|
|
|
|
|
Пробиркалардағы ерітінділерді араластырып, әрқайсысының үстіне 2 тамшы универсалдық индикатордан қосады. Универсалдық индикатор − бұл рН мәнін анықтауға мүмкіндік беретін индикаторлардың қоспасы. Пайда болған ерітінді бояуларын универсал индикаторлардағы түсті кестемен салыстырып, әрбір пробиркадағы буферлік жүйенің рН мәнін табады және кестеге енгізеді.
Тәжірибе кезінде анықталған рН мәндерін есептелген рН мәндерімен салыстырады.
Сутек иондарының концентрациясы мынадай формуламен есептеледі:
[H+] = K[қышқыл] /α ∙[тұз]
Осыдан кейін ерітіндінің рН мәні анықталады.
Сірке қышқылының диссоциациялану константасы 1,86∙10-5, ал 0,1н натрий ацетатының диссоциациялану дәрежесі 0,79-ға тең.
[H+]=1,85∙10-5∙ 2,5/2,5∙0,79=2,3∙10-5
рН = − lg[H+] екенін ескере отырып, оның мәнін табамыз:
−lg[H+] = −lg2,3+5 = − 0,36+5=4,6 pH=4,6
pH мәндері мен тұздың көлемдері бойынша буферлік қисықтың градиенттік көрінісін, яғни буферлік қоспаның рН мәні мен қышқыл және оның тұзының көлемі арасындағы қатынасқа тәуелді қисық тұрғызамыз. 9-cуретте көрсетілгендей ордината осіне рН мәні салынады.

9-сурет. Буферлі қисық
Буферлі қисықтың көмегімен сутегі иондарының кез келген концентрациясынан тұратын буферлік қоспадағы қышқыл мен тұздың көлемін есептеп табуға болады. Бұл үшін абсцисса өсінен рН-тың берілген мәнін табады және осы нүктеден буферлік қисықты қиып өткенше перпендикуляр жүргізеді. Қисықтағы табылған нүктені абсцисса өсіне параллель түзу арқылы ордината өсімен қосады. Осылайша, қышқыл мен тұздың көлемін анықтайды. Мысалы, рН=4,7- ге тең ацетатты буфер дайындау үшін қажетті қышқыл мен тұзды 5,6:4,4 қатынаста алу керек суреттегі графикте көрсетілгендей
Титрлеу техникасы. Титрлеу — зерттеліп отырған заттың титрін анықтау процессі. Титрлеу 0 таңбасына дейін титрантпен толтырылған бюретка (сурет-1) арқылы жасалады. Кейде бюретканың шкаласы дұрыс емес болуы мүмкін, сондықтан 0-ден тыс таңбалардан бастап титрлеу қолайсыз. Бюретканы воронка немесе басқа да арнайы құралдар арқылы ерітіндімен толтырады. Титрлеудің шеткі нүктесін сәйкес индикатор көмегімен анықталады.


Сурет-1.Титрлеуге арналған бюретка. Сурет-2.Титрлеу кезіндегі қолдың
орналасуы.
Титрлеудің маңызы
Ерітіндінің концентрациясын басқа концентрациясы белгілі ерітінді арқылы анықтау үшін, бюретканың ішінде орналақан ерітіндіні басқа ерітіндіге тамызу процессін титрлеу дейміз. Титрлеу кезінде сол қолмен колбаны ұстау керек, ал оң қолмен бюретканың құбырын сұықтықты біргелкі тамызу үшін реттеу керек. Титрлеу кезінде жылдамдық өте маңызды рөл атқарады. Сондықтан ерітіндіні қайталап титрлеу кезінде, біріншідегіндей жылдамдықпен сұйықтықты тамызуды қадағалау керек. Анықталатын зат пен реактивтің арасындағы әрекеттер белгілі бір стехиометриялық қатынаста жүруі қажет. Кей жағдайда осы талаптан ауытқуы байқалады. Көбінесе осы тежеулер себептері келесі қағидалармен түсіндіріледі:Негізгі реакцияның бір теңдеуі арқылы ғана емес, яғни негізгі реакциямен қатар қосымша процесстер жүретін риактивпен әрекеттесетін анықталатын заттың ерекшеліктері.Басқа риактивтермен әрекетке ұшырайтын бөгде заттардың қатысуы. Анықталатын зат пен риактивтің арасындағы реакция үлкен жылдамдықпен жүруі қажет, бұл туру титрлеу кезінде өте маңызды.Реакцияны қолдануындағы маңызды шарттардың бірі – титрлеудің шеткі нүктесін анықтау кезіндегі қолданылатын сәйкес индикатор табу. Титрлеу кезінде ерітіндінің анықталатын заттың көлеміне эквивалентті жұмыс көлемін анықтау қажет. Бұл үшін эквиваленттік қатынасқа жеткенге дейін, анықталатын ерітіндіге ақырындап титрантты тамызамыз. Бұл – эквиваленттік нүкте. Эквиваленттік нүктеге жетуі ерітіндінің белгілі бір рН алынуымен дәлелденеді. Сондықтан бейтараптау әдісінің индикаторлары ретінде рН-тың өзгеруіне байланысты түсі өзгеретін заттар қолданылады. Оларға лакмус, метилоранж, фенолфталеин және көптеген басқа заттар жатады. Олардың әрқайсысының түсі белгілі бір рН-тың қысқа интервалының ішінде өзгереді. Сонымен қатар осы интервал берілген индикаторға ғана байланысты және өзара әрекеттесетін қышқыл мен негізгдің табиғатына мүлдем тәуелсіз. Осыған байланысты индикатор түсінің өзгеруі дәл эквиваленттік нүктеде болмай, одан белгілі ауытқуы арқылы жүреді. Мұндай ауытқу кейбір қателікке әкеледі, оны біз титрлеу кезіндегі индикаторлық қателік деп атаймыз. Осы қателіктің көлемі қандай индикатор алынғанына байланысты және қандай қышқыл мен негіз өзара әрекеттесетініне байланысты үлкен шамалардың арасында теңселеді. Индикаторды дұрыс таңдаған кезінде қателік кәдімгі аналитикалық дәлсіздіктің шегінен тыс шықпайды және оны есепке алмауға да болады. Керісінше, индикатор дұрыс алынбаса, онда қателік өте үлкен болады. Индикатор өзінің түсін өзгергендегі титрлеу кезін - титрлеу соңы нүктесі деп аталады. Титрлеу соңы нүктесі мен эквивалент нүктесі бір-біріне сәйкес немесе жақын болатындай етіп индикатор мен титрдің шартын таңдау қажет.
Титриметриялық анализдің нәтижелерін есептеу принципін мысал келтіре отырып түсіндіріңіз. Титриметриялық анализ әдістерін анализде пайдаланылатын химиялық реакциялардың түріне қарай бөледі. Бұл реакциялар: протондар алмасатын, электрондар алмасатын, аз диссоциацияланатын (комплекстік) бөлшектер түзетін және нашар еритін қосылыстар түзетін реакциялар. Осыған байланысты титриметриялық анықтауды мынадай әдістерге бөлуге болады:
қышқыл-негіздік титрлеу (протолитометрия);
тотығу-тотықсыздану титрлеуі (редоксиметрия);
комплексометриялық титрлеу (комплексометрия);
тұнба алып титрлеу (седиметрия).
Титриметриялық әдістерді титрлеу жолына қарап та бөледі;
1. тікелей титрлеу әдісі – анықтайтын зат концентрациясы белгілі ерітіндімен титрленеді;
2. ауыстыру (жанама) әдісі – бұл әдіс анықтайтын зат пайдаланатын реагентпен әрекеттеспейтін, не реакция стехиометриялық жолмен жүрмейтін жағдайда пайдаланылады. Мысалы, кальций иондарын перманганатометрия әдісімен анықтау. Кальций иондарын қымыздық қышқылы аниондарымен тұнбаға түсіреді:
Ca2++C2O42-→CaC2O4↓
Жуылған тұнбаны күкірт қышқылында ерітеді:
CaC2O4↓+2H3O+→H2C2O4+Ca2++2H2O
Пайда болған қымыздық қышқылын калий перманганаты ерітіндісімен титрлейді:
5H2C2O4+2MnO4-+6H3O+ 10CO2+2Mn2++14H2O
3. кері титрлеу әдісі – анализдейтін ерітіндіге артық мөлшерде алынған титранттың белгілі көлемін құяды, яғни анықтайтын компонентпен реакция толық жүргеннен кейін ерітіндіде титранттың бос мөлшері қалады. Реакцияласпай қалған титранттың мөлшерін концентрациясы белгілі басқа ерітіндімен титрлейді. Алғашқы қосылған титранттың көлемі мен оның реакцияласпай артық қалған көлемінің арасындағы айырмашылық титранттың анықтайтын затпен әрекеттесуге кеткен көлемін көрсетеді.
Физика-химиялық әдістер химиялық реакциялар жүру кезінде байқалатын физикалық шамаларды өлшеуге негізделген. Олар бірнеше топқа бөлінеді:
оптикалық әдістер (фотометрлік, СФ, люмин., ИК, ААС).
электрохимиялық әдістер (потенциометрлік, ионометрлік, вольтметрлік, хроматографиялық, кулонометрлік т.б. әдістер)
Физикалық әдістерде анықталатын заттың концентрациясымен байланысты физикалық шамалар өлшенеді (спектрлік, рентген-фазалық). Титриметрлік талдау анықталатын компонентті анықтауға қажетті реактивтің мөлшерін (көлемін, массасын) өлшеуге негізделген. Анализ орындау үшін концентрациясы белгілі ерітінділер дайындалады. Титриметрлік талдауда жиі пайдаланатын концентрация түрлері: проценттік, мольдік концентрация, эквиваленттің мольдік концентрациясы және титр.
Биологиялық объектілерден белоктық заттарды бөліп алу, тазарту жолдарын түсіндіріңіз. Протоем – жасушадағы барлық ақуыздар бірлігі. Бұрынғы көптеген ғылыми жұмыстарында əрбір жасуша протоемын жекелей сипаттап беруге талпыныстар жасалған болатын. Протоем сараптауы қазіргі компютерлік технологияларды пайдалану мүмкіндігінің өзінде де өте күрделі жұмыс болып табылады жəне əрдайым сирек ақуыз түрлерін анықтауға мүмкіндік бере бермейді. Протеомиканың мақсаты – ДНҚ-чипіне ұқсас микросараптауларын жасау. ДНҚ-чипінде матрикске бекітілген (байланған) белгілі жасушаның гені болатыны белгілі. Матрикске байланған гендер екі үзікті (цепь) ДНҚ молекуласының тек бір үзігі ғана чиптің құрамына кіретіндей болып денатурацияға ұшырайды. Мұнда, ДНҚ-ның бір үзігі екінші үзігін комплементарлық принципі бойынша байлап тұрады. Комплементарлық үзікке белгіні «тігу» арқылы чиптегі генді байқауға болады. Алайда, ақуызда ДНҚ молекуласындағы комплементарлық үзігіне ұқсас нəрсе жоқ. Чиптегі əртүрлі ақуыздарды түстеп-тану (идентификация) үшін, олардағы əрбір жеке ақуызға арналған моноклональді антиденелері қажет болады. Протеомадағы көптеген санды ақуыздардың қызметтерін анықтау – биоинженерлердің жақын болашақта зерттеуі қажет болатын үлкен жұмыстары қатарына жатады. Бұрыннан мұндай сараптаулар, қалыпты жəне мутантты жасушаларының жəне индивидуумдардың протоемдарын салыстыру немесе жекелеген ақуыздарға биохимялық сараптаулар жүргізіп, олардың құрылымын – қызметі белгілі болған ақуыздың құрылымымен салыстыру жолымен жасалынып келінді. ДНҚ молекуласындағы нуклеотидтер реттілігін анықтаудың да маңызы жоғары, өйткені қызметтері ұқсас келетін коделенетін ақуыздар, туыстық картасы бойынша бір-біріне жақын орналасады. Кейбір жағдайларда, қарапайым ағзаларда бір-біріне жақын орналасқан гендер, эволюциялық тұрғыдан жоғары дамыған түрлерде – алыс орналасады. Антисенс-технологиясын қолданып (антимағыналы реттілігін қолдану) гендерді ажырату мүмкіндігі белгілі-бір ген коделейтін ақуыздың қандай қызмет атқаратындығын анықтауға мүмкіндік береді. Антисенс-технологиясын қолдану нəтижесінде, осы жүйеге РНҚ молекуласын, комплементарлы мРНҚ молекулаларын ендіру арқылы, мРНҚ-ның дезактивизациясы жүреді. Мұнда ақуыз синтезінің алдын алып, РНҚ-ның комплементарлық молекуласы, мРНҚ-ның бір үзікті молекуласымен байланысқа түседі. Осындай сараптаулар жүргізу үшін көптеген мəліметтер қоры (базасы) жасақталған. Осындай қорлар арасынан Шиковски бастаған бір топ ғалымдардың (2000 ж) жасаған ашытқылардағы ақуыз-ақуыз жүйесін айтуға болады. Осындай жүйелерді пайдалану арқылы жасалған сараптаулар нəтижесінде, əлі де толық сипатталмаған ақуыздардың қызметтерін анықтауға мүмкіндіктер туылады.
Биологиялық және биотехникалық зерттеулер үшін пайдаланылатын жануарларды өсіру. Мал шаруашылығы биотехнологиясын – молекулалық жəне жасушалық биотехнология əдістерін қолданып, генотипін «түзету» арқылы қарқынды өсіп- жетіле алатын, резистенттілігі мен өнімділік қасиеттері жоғары малдарды шығару тəсілдерін зерттейтін ғылым деп айтуға болады. 147 Малдардың биотехнологиялық қорларын танып, оларды іске асыру мақсатында мал шаруашылығында молекулалық биотехнология, жасушалық жəне көбею биотехнологиялары пайдаланылады. Көбею биотехнологиясы деп – малдың генетикалық потенциалдарын арттыру мақсатында асыл тұқымды малдардан көп ұрпақтар алудың қорларын (ресурстарын) ұтымды пайдалану əдістері айтылады. Көбею биотехнологиясы мал шаруашылығында өз төлінен көбеюін қамтамасыз етіп, асылдандыру жұмыстарының тиімділігін арттыруға мүмкіндік береді. Көбею биотехнологиясы əдістерін қолдана отырып біздер популяция құрамына əсер ете аламыз. Көбею биотехнологиясының зерттеу аясы ретінде малдардың көбею қабілеттіліктері алынатын болса, зерттеу зерзаты ретінде: 1. Гипоталамус, гипофиз бен гонадалар арасындағы өзара əрекеттілік нəтижесінде көбею гормондары арқылы мал ағзасында көрініс беретін гормональді статусы. 2. Көбею мүшелерінің морфологиялық жəне физиологиялық жағдайы бола алады. Көбею биотехнологиясында келесі əдістер қолданылады: 1. Суперовуляция – ұрғашы донорда қосымша фолликулалардың өсіп-жетілуін қамтамасыз ету мақсатында гормональді əсер ету (егу). 2. Қолдан ұрықтандыру – мал тобының генотипін қарқынды түрде өзгерту мақсатында жоғары өнімді аталық ұрығымен аналықтарды жаппай ұрықтандыру жұмыстары. Генетика мен қолдан ұрықтандыру технологиясындағы қол жеткен жетістіктердің арқасында, мал тұқымын жақсарту бағытында үлкен мүмкіндіктер ашылды, атап айтқанда, жоғары өнімділікті жəне генетикалық потенциалы бар аталықтарды таңдап алу мен қолдану нəтижесінде, бүтіндей популяциялардың генетикалық құрылымын жедел өзгертуге қол жеткізілді. Сондықтан мал тұқымын жақсартуда аталықтардың ролі артты. Қазіргі кезде қолдан ұрықтандыру нəтижесінде генетикалық құнды бір аталықтан алынатын ұрпақ саны бірнеше мыңдаған басқа дейін жетеді. 3. Эмбриондар тасымалдау (трансплантация) – эмбриондарды аналық-донордан (жоғары өнімді, құнды аналық эмбриондарын) аналық-реципиетке (құндылығы төмендеу, яғни басқаша айтқанда, суррогаты ене жатырына) тасымалдау əдісі. Мал шаруашылығындағы эмбриондарды тасымалдаудың негізгі мақсаты – жоғары өнімді аналықтардың генетикалық мүмкіндігін (резервін) толығынан пайдалану. Эмбриондар тасымалдау əдісінің арқасында, жоғары өнімді малдардың аналық бездерінде көптеген аналық жасушаларының қоры болатындықтан, оларды пайдалану арқылы, ұрғашы даралардың биологиялық ерекшелігін мейлінше пайдалану мүмкіндігі артты. Сондықтан, генетикалық потенциалы бар малдарды толықтай пайдалану мақсатында, жоғары өнімді аналықтың эмбриондарын олардың дамуының ерте сатыларында өнімділігі төмен болғанымен, көбею қабілеттіліктері жақсы малдар жатырына тасымалдап қондыру əдістері зерттелді. Осындай технологияның арқасында: 1) жоғары өнімді аналықтың ұрпақ санын жедел арттыруға; 148 2) организмдерді (зиготаларды) гамета жəне эмбриондар түрінде тасымалдау мен сақтау мүмкіндігіне; 3) гаметалар мен эмбриондарды іріктеу нəтижесінде керек жынысты жəне қажетті физиолого-биохимиялық қасиеттері бар ұрпақтар алуға қол жеткізіледі. Жалпылай алғанда мал тұқымын көбейту технологиясында атқарылатын жұмыстарды келесі кезеңдерден тұрады деп айтуға болады: донорларды, ұрықтық аталықтарды жəне реципиенттерді іріктеу, донорлардың суперовуляциясын шақыру жəне донор мен реципиент араларында күйге келу мерзімдерін синхронизациялау, донорды ұрықтандыру (табиғи жолмен немесе қолдан), эмбриондарды шайыу жолымен (смыв) бөліп алу, шайылып алынған эмбриондардың сапасын бағалау, дайын эмбриондарды реципиент жатырына орналастыру. Қазіргі кезде малдарды көбейтуге бағытталған биотехнологиялық əдістер молекулалық жəне жасушалық биотехнология салаларымен өте тығыз байланыста. Жасушалық биотехнология – жасушалармен əртүрлі микроманипуляциялар жасау нəтижесінде, бағалы биологиялық қасиеттері бар организмдерді алуға бағытталған ғылым саласы. Бұл мақсатта мал шаруашылығында пайдаланылатын негізгі зерттеу зерзаты ретінде ағзаның көбеюге арналған жасушалары (гонадалар) алынады. Мал шаруашылығындағы жасушалық биотехнологиясы өз құрамында бір- бірін толықтырып тұратын екі ғылыми бағыттан құралады: 1. Эмбриокультуральдық зерттеулер – бөлініп алынған жасушалардың (гаметалар мен эмбриондар) тіршілігі мен ары қарай өсіп-дамуына қажетті жағдайларды толықтай қамтамасыз етуге бағытталады. Эмбриокультуральдық зерттеулердің негізгі міндеттеріне: А) гаметалар мен эмбриондарды өсіру (культивирование), Б) гаметаларды экстракорпоралды ұрықтандыру, В) гамета мен эмбриондар банкін жасақтау, Г) қоректік орталар жасау мен оларды жетілдірулер кіреді. 2. Жасушалық технологиялар – бағалы, яғни генотипі «құрастырылған» малдар шығару мақсатында ядро мен жасушалық деңгейінде атқарылатын жұмыстар. Жасушалық технологиялардың мал шаруашылығындағы негізгі міндеттері қатарына: А) денелік жасушаларын (соматикалық) гибридтеу; Б) клондау; В) химерлі жануарлар жасау жұмыстары жатады. Молекулалық биотехнология – мал организмінде жаңа генетикалық бағдарламалар алу мақсатында тұқым қуалаушылық белгілеріне молекулалық деңгейде «түзетулер» енгізу. Мұндағы негізгі зерттеу зерзаты ретінде нуклейн қышқылдары (ДНҚ жəне РНҚ молекулалары) алынады. Молекулалық биотехнология екі бөлімнен құралады: 1. Генетикалық инженерия – тек қана жекелеген генге (немесе гендерге) қатысы бар. Генетикалық инженерияның негізгі міндеттері қатарына мыналар жатады: А) гендерді синтездеу немесе бөліп алу мен модификациялау; Б) рекомбинантты молекулаларды құрастыру жəне клондау; 149 В) генотип банкін (геном библиотекасын) жасақтау. 2. Генетикалық трансформация – гендерді тасымалдауға негізделеді. Бұл жұмыстардың негізгі міндеттеріне: А) реципиентке генді ендіру; Б) трансфоранттарды іріктеу мен сараптау; В) гендер интеграциясы мен экспрессиясы; Г) бағалы заттарды продуценттеушілерді жəне трансгенді хайуандар жасау жатады. Мал шаруашылығындағы биотехнологиялық жұмыстарының орындалу реті жоғарыда аталған үш əдістердің (суперовуляция, қолдан ұрықтандыру мен эмбрион тасымалдау) тығыз байланыстылығы арқылы жүзеге асырылады. Мысалы, малдардың генетикалық жағынан бағалы эмбриондарын алу үшін, көбейтуге бағытталған биотехнологиялық əдістері (суперовуляция, ұрықтандыру мен эмбрионды шайып алу) қолданылғаннан кейін, алынған эмбриондар сұрыптаудан өткізіліп, кейіннен молекулярлық (трансгеноз) жəне жасушалық (клондау) микроманипуляцияларына ұшыратылады. Кейіннен «құрастырылған» эмбриондарға in vitro жағдайында «реанимациялық» жағдай туғызылып, сапалық белгілері бойынша бағаланғаннан кейін (жасушалық селекция), соңғы кезеңі – генетикалық бағалы ұрпақ алу үшін дайын эмбрионды реципиент аналығының жатырына қондырылуымен (трансплантация) аяқталады. Сонымен, молекулалық биотехнология, жасушалық биотехнология мен көбею биотехнологиялары, мал шаруашылығында малдардың гаметаларында, эмбриондары мен ағзаларында жинақталған биотехнологиялық қорларын анықтау мен пайдалануға мүмкіндік беретін жаңа ғылыми бағыттарының – эмбриоинженерия, эмбриокультура мен эмбриотрансплантацияларының пайда болуына алып келді. Эмбриоинженерияны – генетикалық жағынан «құрастырылған» жəне экономикалық тұрғыдан тиімді организмдерді алу мақсатында, молекулалық жəне жасушалық биотехнологияларының тəсілдерін қолдану арқылы мал организміндегі генетикалық ресурстарын алудың мүмкіндіктері мен жолдарын қарастыратын биотехнологиялық əдіс деп қарауға болады. Эмбриокультураны – малдардың гаметасы мен эмбриондарынан физиологиялық қорларын (ресурс) алудың мүмкіндіктері мен жолдарын қарастыратын жəне олардың тіршілігінің сақталып қалуы мен in vitro жəне in vivo кездерінде қолайлы жағдайлар тудыруға бағытталған мал шаруашылығында қолданылатын биотехнологиялық əдісі деп айта аламыз. Эмбриотасымалдау (трансплантация) – бағалы генотипті малдарды барынша тез көбейту мақсатында, жануарлардың репродуктивті 56. Олардың санитарлық-гигиеналық жағдайларына қойылатын талаптарды көрсетіңіз. Сыртқы немесе қоршаған орта — бұл жануарды қоршаған ауа, су, топырақ, азықтар мен ғимараттар. Қоршаған орта ағза үшін пластикалық (құрылыс), энергетикалық және ақпараттық материалын алу көзі болып табылады. Қоршаған орта мен ағзаның бірлігі олардың арасында үздіксіз өтетін зат және энергия алмасу үрдісімен нақтыланады. Сыртқы орта факторлары ағзаға тікелей және жанама: тыныс алуға, қоректенуге, жылу реттелуіне әсерін тигізеді. Сондықтан сыртқы орта факторлары тірі ағза үшін патогенді болып табылуы мүмкін. Мысалға, ауаның төменгі температурасында және суық су ішкенде суық тиюі мүмкін; ауру туғызатын ағзалармен зарараланған ауа, су және азық жануарларда жұқпалы және инвазиялық ауруларды туғызуға жағдай жасайды; ауа, су және азықтың химиялық құрамының сәйкессіздігі зат алмасу бұзылуына, улануға душар етуі мүмкін.Жануарларға арналған қоралардағы микроклиматты бақылау әдістері. Мал қораларының микроклиматы деп жануарларға арналған белгілі бір жеке орынның климатын айтады.Микроклиматтың аса маңызды көрсеткіштері – температура, ылғалдылық, ауа қозғалысы жылдамдығы, атмосфералық қысым, жарық, шу, көмірқышқыл газының, аммиак пен күкіртсутегінің концентрациясы, ауадағы шаң мен микроағзалар мөлшері болып табылады. Топырақты санитарлық-гигиеналық бағалау.Топырақ – бұл өнімділік, яғни өсімдіктерді қоректік заттармен қамтамасыз ету қасиетіне ие жер қыртысының (литосфераның) беткі қабаты. Топырақ – бұл үнемі физикалық-химиялық үрдістер, биохимиялық реакциялар, әртүрлі айналымдар жүріп отыратын ең күрделі табиғи зертханалардың бірі.Топырақ – әртүрлі өсімдік, жануар, шаруашылықтық –тұрмыстық және өндіріс қалдықтарын қабылдаушы және сіңіруші, көптүрлі микрофлора мен микрофаунаның көзі мен қоры. Ол малдардың денсаулығы мен өнімділігіне үлкен тікелей және жанама әсер көрсетеді. Топырақтың гигиеналық мәні зор, және ол оның механикалық құрамымен, физикалық, химиялық және биологиялық қасиеттерімен анықталады.Топырақты зоогигиеналық бағалау мақсатымен жер учаскелеріне физикалық, химиялық, бактериологиялық және гельминтологиялық зерттеу әдістерінен тұратын зертханалық талдау үшін топырақ сынамасын ала отырып, санитарлық-топографиялық зерттеу жүргізеді.Cуды санитарлық-гигиеналық бағалау
Судың санитарлық-гигиеналық мәні зор. Қоғамдық мал шаруашылығы жағдайында суды жүйелі түрде ауыз су ретінде және техникалық қажеттіліктерге жұмсайды. Судың сапасы біршама дәрежеде малдардың денсаулығы мен өнімділігіне, фермалардың, өндісітік кешеннің санитарлық жағдайына, шығарылатын өнімдердің сапасына және оларды өңдей кәсіпорындарының жағдайына әсерін тигізеді. Қазір біздің елемізде ауыз су сапасының МЕМСТ 2874-82 сапа стандарты бар. Судың сапасын су көзінің санитарлық-топографиялық тексеру, физикалық және химиялық-бактериологиялық талдау нәтижесінде анықтайды.Азықты санитарлық-гигиеналық тұрғыдан бағалау .Азық сапасы мен құндылығын бақылау малдәрігері мен зооинженердің міндетіне енеді. Мал мен құсты құнды әрі сапалы азықпен қамтамасыз ету сапасыз азықпен азықтандыру және азықтандырудың тәртібі мен ережелерінің бұзылуы нәтижесінде пайда болатын асқорыту мүшелерінің, орталық жүйке жүйесі мен жүрек қантамыр жүйесінің ауруларының алдын алу үшін негіз болып табылады.
57. Электрофорез әдісі, принципі, жұмысының орындалу барысын, электрофрез әдісінің ғылыми және практикалық маңызын түсіндіріңіз.Көптеген белоктардың құрамында, керісінше, негіздік амин қышқылдардың саны басымдау болады. Сондықтан олар электр өрісінде катодқа (−) қарай жылжиды. Мұндай белоктар негіздік белоктар деп аталады. Белоктардың осындай қасиеттерін пайдалана отырып, тұрақты электр өрісінде оларды құрамдық бөлшектерге бөліп, ажыратуға болады. Зарядталған бөлшектердің электр өрісіндегі қозғалысы электрофорез әдісі деп аталады. Әртүрлі белоктардың жалпы зарядында айырмашылығы болатындықтан, олардың электр өрісіндегі қозғалыс жылдамдығы да әртүрлі болады.
Белок молекуласының иондалуына ортаның рН өте күшті әсер етеді. Егер белокты қышқыл ортада бөліп алып, электр өрісіне орналастырса, ол катод жаққа қарай қозғалады. Ал сілтілі ортада ол теріс зарядталады да, анодқа қарай жылжиды. Белок молекуласының зарядтарының бейтараптанып, электр өрісінде не анодқа, не катодқа қарай жылжымайтын кездегі рН мәнін белоктың изоэлектрлік нүктесі (ИЭН) деп атайды. Изоэлектрлік нүктеге жеткен кезде белок тұнбаға түседі. Изоэлектрлік нүкте рН түрінде белгіленеді. Мысалы, бидай глиадинінің изоэлектрлік нүктесі 7,2-ге (рН = 7,2) тең болса, пепсиннің изоэлектрік нүктесі 1-ге (рН = 1) тең.
рН мәні ИЭН-нен жоғары болған кезде белок теріс зарядталып, катион ретінде анодқа қарай жылжиды. Ал рН мәні ИЭН-нен төмен болған жағдайда белок оң зарядталып, катодқа қарай жылжиды. Электр өрісіндегі белок молекуласының орын ауыстыру жылдамдығына тек қана жалпы заряд шамасы ғана емес, сондай-ақ потенциал айырмашылығы, белоктың молекулалық массасы және белоктың тасымалданатын ортадағы (буфердегі) молекулалармен немесе иондармен әрекеттесуі де әсер етеді. Соңғы фактордың әсер етуі белок молекуласының формасына, табиғатына және буферлік ерітіндінің концентрациясына байланысты. Сондықтан, потенциал айырмашылығы бірдей электр өрісінде әр белок әртүрлі жылдамдықпен жылжиды. Электрофорез әдісі бойынша белоктарды бөлшектерге фракциялауға аталған осы факторлар әсер етеді.
Электрофорез әдісімен белоктарды фракцияға бөлудің бірнеше түрлері бар:
Тизелиус ұсынған сұйық ортадағы электрофорез немесе еркін электрофорез әдісі. Бұл жағдайда электр өрісіндегі белок компоненттерінің қозғалу бағыты мен жылдамдығы оның молекула зарядына тікелей тәуелді болады.
Қағаздағы электрофорез.
Электр өрісіндегі белоктардың қозғалуы үшін крахмал, агарагар, поликариламидті немесе басқа да гельдерді пайдалана отырып жүргізілетін электрофорез әдісі.
Осы аталған әдістердің ішінде полиакриламид геліндегі (ПААГ) электрофорез әдісі жиі қолданылады. Себебі, басқа материалдармен салыстырғанда полиакриламид гелінде белоктар көбірек фракцияларға бөлінеді, әрі ол фракциялар гельде айқын боялады.
Поливакриламидті гель түссіз (мөлдір), механикалық мықтылығымен ерекшеленеді, құрамы біртекті және химиялық инертті. Гельдің бұл қасиеті ерітіндінің азғантай көлеміндегі (0,001 мл-ге дейін) концентрациясы әртүрлі белоктардың фракцияларын анықтауға мүмкіншілік береді, әрі электрофорезді төменгі температурада жүргізуге болады (себебі, электрофорез жүрген кезде буферді салқындатып отырмаса, температура жоғарылап, белоктың химиялық қасиеттері өзгереді). Оның үстін белоктарды бөлуге кететін уақытты бірнеше есе қысқартуға болады.
Электрофорез әдістерінің ішіндегі жиі қолданылатыны – вертикальды электрофорез. Электрофорездің бұл түрінің полиакриламидте гелі екі системадан (бөліктен) тұрады: ірі поралы (үстіңгі бөлігі) және ұсақ поралы (астыңғы бөлігі). Гельдің ірі поралы қабатында белок тығыздалып, концентрленеді, ал ұсақ поралы бөлігінде белоктың фракцияларға бөліну процесі жүреді. Сонымен қатар ұсақ поралы гельдің молекулалық-сүзгі қызметін атқаратын қасиеті бар. Гельдің бұл қасиеті әсіресе зарядтарының мөлшері бірдей, бірақ молекулалық массалары әртүрлі белоктарды бөлуде маңызды роль атқарады. Молекулалық-сүзгі эффектісі тіпті молекулалық массалары бірдей, бірақ формалары әртүрлі белоктарды бір-бірінен ажыратуға мүмкіншілік береді. Мысалы, формалары әртүрлі фибриллярлы (жіп тәрізді, талшықты белоктар) және глобулярлы (дөңгелек, шар тәрізді белоктар) белоктардың молекулалық массалары бірдей болғанымен электр өрісінде әртүрлі жылдамдықпен қозғалады.
Соңғы жылдары электрофоретикалық әдіс жануарлар мен қатар өсімдіктер белоктарын да зерттеуде жиі қолданылып келеді. Бір ескерте кететіні, электрофорез әдісімен белоктардың тазартылған препараттарымен қатар оның ұлпалардан тазартылған экстрактілерін де зерттеуге болады.
58-59. Гель-фильтрация әдісі, принципі, түрлері, компоненттері. Жұмысының орындалу барысын түсіндіріңіз.Өткір (проникающая) хроматография әдісі тығыз молекулалық елеуіштен өткізу кезенде молекулалардың мөлшерлері бойынша бөлінуінде негізделеді.Заттарды осы принцип бойынша гельдің көмегімен бөлу әдісі гель-фильтрлеу деп аталады.Өткір хроматографияда молекулалық елеуіш ретінде көлденеңінен тігілген (сефадекстер), арагозды гельдер (сефароза, биогель-А), полиамидтік гель (биогель-Р) және полистиролдар (биобидз-S) қолданылады. Сонымен бірге жай шыны шариктері (биоглас) және поралы кварц (поросил) қолданылады. Көлденең тігістердің санын өзгерте отырып, сефадекстердің бірнеше, частицаларының пористостьтерінің әр түрлігімен ажырасатын типтерін алуға болады.Өткір хроматографияда да колонкалар пайдаланылады. Соңғы кезде амин қышқылдарын, көмірсуларды, стероидтерді және липофильді қосылыстарды бөлу үшін пластиналарда жұқа қабатта гель-фильтрлеу қолданылады. Гель-өткінші хроматография (гель-фильтрация) молекулалардың мөлшеріне негізделген бөлу әдісі. Бұл әдіс бойынша қозғалмайтын фаза ретінде саңылаулы бөлшектер қолданылады. Қозғалмалы фазаның ролін сулы немесе органикалық реагенттер атқарады. ГӨХ механизмі бойынша зерттелетін заттар сорбенттің саңылауларындағы қозғалмайтын еріткіш пен қозғалмайтын фаза арқылы өтетін еріткіштің арасында бөлінеді. Заттардың түтіктен шығуы олардың молекулалық массаларының төмендеу бағытында орындалады. ГӨК қолданылатын сорбенттер жұмсақ, жартылай қатты және қатты болып бөлінеді. Жұмсақтарға полисахаридтер негізінде дайындалған гельдер (крахмал, декстран, целлюлоза) жатады. Жартылай қатты гельдер стирол мен дивинилбензолдың қоса полимерленуі (стирогельдер) немесе винилацетаттың полимерленуі нәтижесінде алынады. Қатты гельдерге саңылауларының мөлшері белгілі шыны немесе силикагельдер жатады. Олар жоғары адсорбциялаушы қабылет көрсететіндіктен, арнайы химиялық заттармен өңделеді. ГӨХ биологияда полипептидтерді, белоктарды және басқа макромолекулаларды бөлу және тазалау үшін қолданылады. Өсімдіктердің вегетативті мүшелерінен белоктарды бөліп алу. Майдалап туралған 0,5-1,0 г өсімдік ұлпасын (жапырақ, өскін, тамыр және т.б.) езіп, 1-2 мл трис-глицинді буферде (рН 8,3) 1 сағат бойы 2-4°С-да экстракциялайды. Ерітіндідегі белоктар фенол және т.б. қосылыстардың әсерінен бұзылып кетпесі үшін буферге «қорғағыш» қоспалар қосылады. Көрсетілген уақыттан кейін экстрактты 2 қабат капрон матасының арасына салып, сығады да фильтратты (сұйық бөлігін) 2-4°С-да 10 минут бойы 7-8 мың айналым)/мин жылдамдықта центрифугалайды. Белоктарды өзге қоспалардан (тұздар, фенол қосылыстары, қышқылдар және т.б.) тазарту үшін центрифугадан шыққан белок ерітіндісін (центрифугат) іші G-25 немесе G-50 сефадекстерімен, немесе G-25 молселектпен толтырылған колонкадан өткізеді. Алдын ала дайындалған колонкадағы гельге белок экстрактісі құйылады (белок ерітіндісінің колонкадағы қозғалысын бақылау үшін, оған бірнеше мкг бромфенол бояуын қосып, ерітіндіні бояйды). Сонан кейін колонканың төменгі кранын ашып, белок ерітіндісі гельге сіңген мезетте кранды жабады да, колонкаға жайлап буфер ерітіндісін құяды. Осыдан кейін кранды ашады да, буфер ерітіндісін колонкадан тамшылатып ағызады. Бояу колонканың төменгі шетіне жеткен кезден бастап, пробиркаларға бірдей көлемде (0,5-1,0 мл-ден) колонкадан шыққан ерітінділерді жинайды. Пробиркалардағы белок мөлшерін спектрофотометр көмегімен анықтауға болады. Егер белок концентрациясы төмен болса, онда оған аздаған мөлшерде гель салады (сефадекс G-25 немесе молселект G-25).
