
- •10. Біркомпонентті жүйелердегі қаныққан бу қысымының температураға тәуелділігін көрсететін теңдеулерді талдаңыз және 1-ші текті фазалық ауысу жылуларын есептеу жолдарын көрсетіңіз.
- •16. Екі сұйықтықтың өзара ерігіштігінің түрлерін ерігіштік диаграммаларын келтіреотырып талдаңыз. Кризистік нүктені анықтау тәсілін көрсетіңіз.
- •18. Балқу диаграммаларының барлық түрлерін келтіріңіз.Инвариантты нүктелердегі еркіндік дәреже санын есептеңіз. Таза компоненттің,қоспалардың және эвтектикалық қоспаның суыну қисықтарын сипаттаңыз.
- •21. Таралу заңы және оның практикалық қолданылуын сипаттаңыз. Экстракция.
- •22.Коноваловтың бірінші және екінші заңдары орындалатын жүйелердің қайнау диаграммаларын талдаңыз. Олардың практикада қолдануын сипаттаңыз
- •26.Күрделі реакциялардың кинетикалық теңдеуін құру үшін қандай принциптер қолданылады?
- •29.Активтену энергиясының физикалық мағынасы.Химиялық реакцияның активтену энергиясын есептеу әдістерін талдаңыз.
- •31.Нолінші, бірінші, екінші және үшінші ретті реакциялар жылдамдық константасының өлшем бірліктерін қорытып көрсетіңіз.
- •33. Ракцияның жалпы ретін және оған қатысатын заттар бойынша дербес реттерін сипаттаңыз. Вант-Гофф әдісі бойынша химиялық реакцияның ретін анықтауды талдаңыз.
- •34.Нолінші, бірінші, екінші және үшінші ретті реакциялар үшін әрекеттесетін заттар концентрациясының уақытқа тәуелділігі қандай координаталарда сызықты болатыны көрсетіңіз.
10. Біркомпонентті жүйелердегі қаныққан бу қысымының температураға тәуелділігін көрсететін теңдеулерді талдаңыз және 1-ші текті фазалық ауысу жылуларын есептеу жолдарын көрсетіңіз.
|
11.Судың күй диаграммасы, оның ерекшілігі. Клапейрон-Клаузиус теңдеуі және Гиббстің фазалар ережесі тұрғысынан талдаңыз. |
16.Екі сұйықтықтың өзара ерігіштігінің түрлерін ерігіштік диаграммаларын келтіре отырып талдаңыз. Кризистік нүктені анықтау тәсілін көрсетіңіз.Екі сұйықтықтың өзара ерігіштігінің түрлерін ерігіштік диаграммаларын келтіре отырып талдаңыз. Кризистік нүктені анықтау тәсілін көрсетіңіз. |
|
17.Үшкомпонентті жүйенің құрамын анықтау әдістерін сипаттаңыз. Үш сұйықтықтың өзара ерігіштігінің түрлерін ерігіштік диаграммаларын келтіре отырып талдаңыз. Кризистік нүктені анықтау тәсілін көрсетіңіз. |
|
18.Балқу диаграммаларының барлық түрлерін келтіріңіз. Инвариантты нүктелердегі еркіндік дәреже санын есептеңіз.Таза компоненттің, қоспалардың және эвтектикалық қоспаның суыну қисықтарын сипаттаңыз. |
|
19.Күшті электролиттер үшін Дебай-Гюккель шекті заңының қолдануын сипаттаңыз. Әр жуықтаудағы өрнектерін келтіріңіз, олар қандай концентрациялы ерітінділер үшін жарамды екенін көрсетіңіз. |
|
20.Ерітіндінің иондық күші дегеніміз не? 0,01 моль/л калий сульфаты, 0,001 моль/л калий хлориды және 0,002 моль/л калий фосфаты электролиттері қоспасының иондық күшін есептеңіздер. |
|
21.Таралу заңы және оның практикалық қолдануын сипаттаңыз. Экстракция. |
|
22.Коноваловтың бірінші және екінші заңдары орындалатын жүйелердің қайнау диаграммаларын талдаңыз. Олардың практикада қолдануын сипаттаңыз. |
|
23.Компоненттері өзара химиялық әрекетке түспейтін және қатты ерітінділер түзбейтін жүйенің балқу диаграммасын сызыңыз және оны жан-жақты талдаңыз: фазалық жазықтықтарға бөліңіз, әр жазықтықтағы фазалар санын анықтаңыз, инвариантты нүктелердегі еркіндік дәреже санын есептеңіз.Таза компоненттің, қоспалардың және эвтектикалық қоспаның суыну қисықтарын сипаттаңыз. |
|
24.Компоненттері өзара химиялық әрекетке түсіп конгруэнтті балқитын қосылыс түзетін жүйенің балқу диаграммасын сызыңыз және оны жан-жақты талдаңыз: фазалық жазықтықтарға бөліңіз, әр жазықтықтағы фазалар санын анықтаңыз, инвариантты нүктелердегі еркіндік дәреже санын есептеңіз.Таза компоненттің, қоспалардың және эвтектикалық қоспаның суыну қисықтарын сипаттаңыз. |
|
25.Компоненттері өзара химиялық әрекетке түсіп инконгруэнтті балқитын қосылыс түзетін жүйенің балқу диаграммасын сызыңыз және оны жан-жақты талдаңыз: фазалық жазықтықтарға бөліңіз, әр жазықтықтағы фазалар санын анықтаңыз, инвариантты нүктелердегі еркіндік дәреже санын есептеңіз.Таза компоненттің, қоспалардың және эвтектикалық қоспаның суыну қисықтарын сипаттаңыз. |
|
26.Күрделі реакциялардың кинетикалық теңдеуін құру үшін қандай принциптер қолданылады? |
|
27.Ерітіндінің иондық күші дегеніміз не? 0,01 моль/л калий сульфаты, 0,001 моль/л калий хлориды және 0,002 моль/л калий фосфаты электролиттері қоспасының иондық күшін есептеңіздер. |
28.Күшті электролиттер үшін Дебай-Гюккель шекті заңының қолдануын сипаттаңыз. Әр жуықтаудағы өрнектерін келтіріңіз, олар қандай концентрациялы ерітінділер үшін жарамды екенін көрсетіңіз. |
29.Аррениус теңдеуі. Активтену энергиясының физикалық мағынасы. Химиялық реакцияның активтену энергиясын есептеу әдістерін талдаңыз. |
30.Әлсіз электролиттің диссоциациялану константасы мен диссоциациялану дәрежесі арасында қандай байланыс бар? .Концентрациясы 0,01 моль/л сірке қышқылы ерітіндісінің рН және эквивалентті электрөткізгішін есептеңіз. Қажет деректерді анықтамалықтан алыңыз. |
31.Нолінші, бірінші, екінші және үшінші ретті реакциялар жылдамдық константасының өлшем бірліктерін қорытып көрсетіңіз. |
32.Нолінші, бірінші, екінші және үшінші ретті реакциялар үшін жартылай ыдырау периодын өрнектейтін теңдеулерді қорытып шығарыңыз. |
33.Ракцияның жалпы ретін және оған қатысатын заттар бойынша дербес реттерін сипаттаңыз. Вант-Гофф әдісі бойынша химиялық реакцияның ретін анықтауды талдаңыз. |
34.Нолінші, бірінші, екінші және үшінші ретті реакциялар үшін әрекеттесетін заттар концентрациясының уақытқа тәуелділігі қандай координаталарда сызықты болатыны көрсетіңіз. |
10. Біркомпонентті жүйелердегі қаныққан бу қысымының температураға тәуелділігін көрсететін теңдеулерді талдаңыз және 1-ші текті фазалық ауысу жылуларын есептеу жолдарын көрсетіңіз.
Бірінші
текті фазалық өзгерістер деп – жүйенің
Гиббс энергиясы (G) үздіксіз өзгеріп, ал
оның температура мен қысымға байланысты
бірінші туындылары секірмелі өзгеруі
арқылы өтетін фазалық өзгерістерді
айтады. Яғни бірінші текті фазалық
өзгерістерде зат бір фазадан екінші
фазаға тепе-теңдік күйде айналғанда
оның энтропиясы (S) мен мольдік көлемі
() секірмелі өзгереді:


Бірінші
текті фазалық өзгеріске таза заттың
өатты күйден сұйық күйге жәе керісінше
айналуы (балқу
 кристалдану), сұйық күйден буға және
керісінше (булану
конденсациялану), қатты күйден буға
және керісінше (булану
сублимациялану) айналуы, сонымен қатар
аллотропиялық түрлену (заттың бір қатты
фазадан екінші қатты фазаға айналуы)
жатады.
кристалдану), сұйық күйден буға және
керісінше (булану
конденсациялану), қатты күйден буға
және керісінше (булану
сублимациялану) айналуы, сонымен қатар
аллотропиялық түрлену (заттың бір қатты
фазадан екінші қатты фазаға айналуы)
жатады.
Клайперон-Клаузиус
теңдеуі. Берілген А заты бір фазадан
екінші бір фазаға айналады дейік :

Әр
фаза үшін Гиббс энергиясының температура
мен қысымға байланысты өзгерістері
мына теңдеулермен өрнектеледі:
𝑑 (3)
(3)

Мндағы
 және
және
 - заттың бірінші және екінші фазадағы
мольдік көлемі;
- заттың бірінші және екінші фазадағы
мольдік көлемі;
 және
және
 – заттың осы фазалардағы мольдік
энтропиясы. Фазалар арасында тепе-теңдік
орнағанда
– заттың осы фазалардағы мольдік
энтропиясы. Фазалар арасында тепе-теңдік
орнағанда

Демек,

Немесе

Осыдан

Фазалық
айналудағы энтропияның өзгерісі:

Мұнда
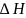 - фазалық айналу кезіндегі энтальпияның
өзгерісі (фазалық айналудың мольдік
жылуы);
- фазалық айналу кезіндегі энтальпияның
өзгерісі (фазалық айналудың мольдік
жылуы);
 - фазалық айналудың температурасы; Егер
(8)-теңдеудегі
- фазалық айналудың температурасы; Егер
(8)-теңдеудегі
 мәнін (7)-теңдеуге қоойсақ:
dP/dT=∆H_балқ/T∆V (9)
мәнін (7)-теңдеуге қоойсақ:
dP/dT=∆H_балқ/T∆V (9)
Алынған
(9)-теңдеу Клапейрон-Клаузиус теңдеуі
деп аталады, ол фазалық айналудың
температурасы мен сыртқы қысымның
арасындағы байланысты көрсетеді. Бұл
теңдеу бірінші текті фазалық айналу
процестеріне қолдаылады. Клапейрон-Клаузиус
теңдеуінің балқу процесіне қолданылуын
қарастырайық. Зат балқыған кезде қатты
сұйық тепе-теңдігі орнайды. Тепе-теңдік
қалыпта өтетін балқу процесі үшін
(9)-теңдеу былай жазылады:

Мұнда
 – балқу кезіндегі жүйе энтальпиясының
өзгерісі (балқу жылуы);
– балқу кезіндегі жүйе энтальпиясының
өзгерісі (балқу жылуы);
 - балқу температурасы;
- балқу температурасы;
 және
және
 -
заттың бір молінің сұйық және қаты
күйіндегі көлемдері.
-
заттың бір молінің сұйық және қаты
күйіндегі көлемдері.
Балқу
процесі эндотермиялық процесс
болатындықтан
 ),
),
 – туындысының таңбасы сұйық және қатты
фазалар көлемдерінің айырмасымен
анықталады. Егер
– туындысының таңбасы сұйық және қатты
фазалар көлемдерінің айырмасымен
анықталады. Егер болса,
болса,
 (немесе
(немесе
 ),
яғни балқыған кезде жүйенің көлемі
ұлғаятын болса сыртқы қысымның өсуімен
балқу температурасы жоғарылайды. Ал
),
яғни балқыған кезде жүйенің көлемі
ұлғаятын болса сыртқы қысымның өсуімен
балқу температурасы жоғарылайды. Ал болғанда
болғанда
 ;
балқу кезінде жүйенің көлемі азайса
сыртқы қысымның артуы балқу температурасын
төмендетеді. Балқу температурасының
қысымға осындай кері тәуелділігі кейбір
заттар үшін ғана байқалады. Ал көп
жағдайларда зат балқығанда оның сұйық
күйіндегі көлемі қатты күйіндегіден
артық.
;
балқу кезінде жүйенің көлемі азайса
сыртқы қысымның артуы балқу температурасын
төмендетеді. Балқу температурасының
қысымға осындай кері тәуелділігі кейбір
заттар үшін ғана байқалады. Ал көп
жағдайларда зат балқығанда оның сұйық
күйіндегі көлемі қатты күйіндегіден
артық.
Енді
Клапейрон-Клаузиус теңдеуін заттың
булануына (яғни сұйық бу тепе-теңдігіне)
қолданайық. Булану процесі үшін
(10)-теңдеу былай жазылады:

Мұнда
 - булану кезіндегі жүйе энтальпиясының
өзгерісі (булану жылуы);
- булану кезіндегі жүйе энтальпиясының
өзгерісі (булану жылуы); - қайнау температурасы;
- қайнау температурасы;
 будың және сұйықтың мольдік көлемдері.
будың және сұйықтың мольдік көлемдері.
Булану
процесінде
 және
және
 болатындықтан
(кризистік күйде ғана
болатындықтан
(кризистік күйде ғана
 )
сыртқы қысымның өсуі қайнау температурасын
жоғарылатады.
)
сыртқы қысымның өсуі қайнау температурасын
жоғарылатады.
Сұйықтықтардың
булану процесіне қолдану үшін Клапейрон
– Клаузиус теңдеуін әрі қарай
түрлендірейік. Кризистік температурадан
өте төмен температураларда бу фазасының
көлемі сұйық фазанікінен әлде қайда
үлкен, сондықтан (11)-теңдеуді былай
жазуға болады:

Егер
қаныққан бу идеал газдардың теңдеуіне
бағынатын болса
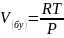
Олай
болса

Немесе

Алынған (13) және (14)-теңдеулер сұйықтықтардың қаныққан бу қысымдарының температураға тәуелділігін бейнелейді.
Қатты
заттардың булануы кезінде де
 болатындықтан ондағы қаныққан бу
қысымының температураға тәуелділігі
жоғарыдағы (14)-теңдеуге ұқсас теңдеумен
өрнектеледі:
болатындықтан ондағы қаныққан бу
қысымының температураға тәуелділігі
жоғарыдағы (14)-теңдеуге ұқсас теңдеумен
өрнектеледі:

Мұнда
 -сублимация
кезіндегі жүйе энтальпиясының өзгерісі
(сублимация жылуы); Тсуб- сублимация
температурасы.
-сублимация
кезіндегі жүйе энтальпиясының өзгерісі
(сублимация жылуы); Тсуб- сублимация
температурасы.
11.Судың күй диаграммасы,оның ерекшелігі.Клапейрон-Клаузиус теңдеуі және Гиббстің фазалар ережесі тұрғысынан талдаңыз.Су күйінің төмен қысымдағы жазық диаграммасы 27-суретте берілген.

Диаграммада
ОА, ОВ және ОС сызықтары судың екі фазалық
күйлерін, О нүктесі үш фазалық күйін
көрсетеді. ОА сызығы мұз бен оның қаныққан
буының тепе-теңдігін көрсететін,
Клапейрон-Клаузиустың (І.35)-теңдеуімен
анықталатын қисық;
 (І.35)
(І.35)
Мұнда
 -сублимация
кезіндегі жүйе энтальпиясының өзгерісі
(сублимация жылуы);
-сублимация
кезіндегі жүйе энтальпиясының өзгерісі
(сублимация жылуы);
 -
сублимация температурасы ол мұздың
қаныққан бу қысымы мен температура
арасындағы тәуелділікті бейнелейді.
ОВ сызығы судың қатты (мұз) және сұйық
күйлерінің тепе-теңдік қисығы; бұл қисық
мұздың балқу температурасының сыртқы
қысымға тәуелді өзгерісін бейнелеп,
Клапейрон-Клаузиус (І.30) –теңдеуімен
анықталады.
-
сублимация температурасы ол мұздың
қаныққан бу қысымы мен температура
арасындағы тәуелділікті бейнелейді.
ОВ сызығы судың қатты (мұз) және сұйық
күйлерінің тепе-теңдік қисығы; бұл қисық
мұздың балқу температурасының сыртқы
қысымға тәуелді өзгерісін бейнелеп,
Клапейрон-Клаузиус (І.30) –теңдеуімен
анықталады.
 (І.30)
(І.30)
Мұнда
 - балқу кезіндегі жүйе энтальпиясының
өзгерісі (балқу жылуы);
- балқу кезіндегі жүйе энтальпиясының
өзгерісі (балқу жылуы);
 -балқу
температурасы;
-балқу
температурасы;
 және
және
 - заттың бір молінің сұйық және қатты
күйіндегі көлемдері. Диаграммадағы ОС
сызығы су және судың қаныққан буының
тепе-теңдік қисығы; ол судың қаныққан
бу қысымы мен қайнау температурасы
арасындағы байланысты көрсетіп,
Клапейрон-Клаузиустың (І.31)-теңдеуімен
анықталады.
- заттың бір молінің сұйық және қатты
күйіндегі көлемдері. Диаграммадағы ОС
сызығы су және судың қаныққан буының
тепе-теңдік қисығы; ол судың қаныққан
бу қысымы мен қайнау температурасы
арасындағы байланысты көрсетіп,
Клапейрон-Клаузиустың (І.31)-теңдеуімен
анықталады.
 Мұнда
Мұнда
 -булану
кезіндегі жүйе энтальпиясының өзгерісі
(булану жылуы);
-булану
кезіндегі жүйе энтальпиясының өзгерісі
(булану жылуы);
 -қайнау
температурасы;
-қайнау
температурасы;
 және
және
 -будың және сұйықтың мольдік көлемдері.
-будың және сұйықтың мольдік көлемдері.
ОА,
ОВ және ОС қисықтары бір-бірімен О
нүктесінде қиылысып тұр. О нүктесін
үштік нүкте деп атайды. Бұл нүктеге
сәйкес келетін қысы мен (Р=610,48 Па)
температурада (Т=273,16 К) су үш түрлі
агрегаттық күйде (мұз, су, бу) болады.
ОА, ОВ, ОС сызықтары диаграмманы үш
бөлікке бөледі. Жазықтықтың әрқайсысы
судың әр күйіне сәйкес температура мен
қысымның мәндерін көрсетеді. Жоғары
қысымдар мен төмен температурада су
мұз күйінде, жоғары қысым мен жоғары
температурада – сұйық, ал төмен қысымдарда
бу күйінде болады. Су диаграммасының
көптеген басқа сұйықтықтардың
диаграммасының ең басты айырмашылығы
ОВ қисығының (балқу қисығы) қысым осіне
(Р-осі) көлбеу жатуында. Оның себебі мұз
балқығанда оның сұйық күйдегі көлемі
мұз күйіндегіден аз
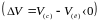 болатындықтан Клапейрон-Клаузиус
теңдеуіндегі туынды
болатындықтан Клапейрон-Клаузиус
теңдеуіндегі туынды
 (қысым жоғарылаған сайын балқу
температурасы төмендейді). Судың фазалық
диаграммасын Гиббстің фазалар ережесі
тұрғысынан қарастырайық. Диаграммадағы
ОА, ОВ және ОС қисықтарында жүйенің
варианттығы бірге тең (моновариантты):
Е=К-Ф+2=1-2+2=1. Бұл қисықтар бойымен
температура (не қысым) өзгергенімен
жүйедегі екі фазалық тепе-теңдік (фазалар
саны) бұзылмайды. Қисықтар бойымен
температураны өзгертсек қысым оған
тәуелді түрде өзінен-өзі өзгереді, ал
егер қысымды өзгертсек, оған тәуелді
түрде температура өзгереді. Сөйтіп
жүйенің екі фазалық күйі әрқашан сақталып
отырады. Бұл кезде тәуелсіз өзгеретін
параметрлердің саны біреу ғана. Мысалы,
ОС қисығындағы а нүктесінде қысымды
немесе температураны өзгертсек, (әрине
белгілі бір щекке дейін ғана) нүкте
қисық бойымен не жоғары, не төмен жылжып,
сұйық су мен будың тепе-теңдігі бұзылмайды.
Диаграмма жазықтықтарында (бір фазалы
бөліктерде) жүйе дивариантты:
Е=К-Ф+2=1-1+2=2. Демек, жүйенің фазалық күйін
сақтай отырып өзгертуге болатын тәуелсіз
параметрлердің саны екіге тең, олар Р
және Т. Мысалы, мұз фазасы жазықтығындағы
b
нүктесі
үшін қысымды да, температураны да
бір-біріне тәуелсіз өзгертсек b
нүктесі кез-келген бағытқа жылжиды. Қай
бағытпен жылжыса да бұл нүкте мұз
жазықтығында жатады, яғни жүйенің
фазалық күйі өзгермейді. Бірақта тәуелсіз
параметрлерді белгілі бір шекке дейін
ғана өзгертуге болады. Мысалы, мұзды
әрі қарай қыздырып қысымын да арттыра
берсек мұз балқып қатты фазамен қатар
сұйық фаза пайда болады (b
нүктесі ОВ қисығының үстіне түсіп жүйе
бір фазалы күйден екі фазалы күйге
айналады). Сол сияқты, сұйық судың немесе
будың қысымы мен температурасын белгілі
бір шектен артық өзгертсек су мұзға, не
буға айналады, бу конденсацияланып суға
н сублимацияланып мұзға айналады.
Диаграмманың үштік нүктесінде (О нүктесі)
жүйе инвариантты: Е=1-3+2=0. Үштік нүктедегі
қысым мен температураның мәндерін
өзгертуге болмайды, олардың өзгерісі
жүйені үш фазалық күйден екі немесе
бір фазалы күйге көшіреді. Тұрақты
қысымда температураның өсуі немесе
тұрақты температурада қысымның төмендеуі
жүйені буға, ал тұрақты температурада
қысымның жоғарылауы сұйық суға
айналдырады. Диаграммадағы ОС қисығын
С нүктесінен әрі қарай созуға болмайды,
өйткені С нүктесінде (кризистік нүкте)
су түгелімен буға айналады. Бұл қисықтың
мұз жазықтығына қарай созындысы (ОД
қисығы) аса суыған судың буымен
тепе-теңдігін көрсетеді. Аса суыған су
метастабильді (тұрақсыз) күйде болады,
себебі оның қаныққан бу қысымы (химиялық
потенциалы, µ1)
мұздың бу қысымынан (химиялық потенциалынан,
µ2)
жоғары, яғни µ1>
µ2,
сондықтан аса суыған су сыртқы жағдайлардың
болымсыз өзгерісінде лезде мұзға айналып
кетеді. ОА қисығын О нүктесінен әрі
қарай созу мүмкін емес (себебі қатты
заттар өзінің балқу температурасында
сұйыққа айналады, яғни олардың қатты
күйін сақтай отырып аса қыздыруға
болмайды).
(қысым жоғарылаған сайын балқу
температурасы төмендейді). Судың фазалық
диаграммасын Гиббстің фазалар ережесі
тұрғысынан қарастырайық. Диаграммадағы
ОА, ОВ және ОС қисықтарында жүйенің
варианттығы бірге тең (моновариантты):
Е=К-Ф+2=1-2+2=1. Бұл қисықтар бойымен
температура (не қысым) өзгергенімен
жүйедегі екі фазалық тепе-теңдік (фазалар
саны) бұзылмайды. Қисықтар бойымен
температураны өзгертсек қысым оған
тәуелді түрде өзінен-өзі өзгереді, ал
егер қысымды өзгертсек, оған тәуелді
түрде температура өзгереді. Сөйтіп
жүйенің екі фазалық күйі әрқашан сақталып
отырады. Бұл кезде тәуелсіз өзгеретін
параметрлердің саны біреу ғана. Мысалы,
ОС қисығындағы а нүктесінде қысымды
немесе температураны өзгертсек, (әрине
белгілі бір щекке дейін ғана) нүкте
қисық бойымен не жоғары, не төмен жылжып,
сұйық су мен будың тепе-теңдігі бұзылмайды.
Диаграмма жазықтықтарында (бір фазалы
бөліктерде) жүйе дивариантты:
Е=К-Ф+2=1-1+2=2. Демек, жүйенің фазалық күйін
сақтай отырып өзгертуге болатын тәуелсіз
параметрлердің саны екіге тең, олар Р
және Т. Мысалы, мұз фазасы жазықтығындағы
b
нүктесі
үшін қысымды да, температураны да
бір-біріне тәуелсіз өзгертсек b
нүктесі кез-келген бағытқа жылжиды. Қай
бағытпен жылжыса да бұл нүкте мұз
жазықтығында жатады, яғни жүйенің
фазалық күйі өзгермейді. Бірақта тәуелсіз
параметрлерді белгілі бір шекке дейін
ғана өзгертуге болады. Мысалы, мұзды
әрі қарай қыздырып қысымын да арттыра
берсек мұз балқып қатты фазамен қатар
сұйық фаза пайда болады (b
нүктесі ОВ қисығының үстіне түсіп жүйе
бір фазалы күйден екі фазалы күйге
айналады). Сол сияқты, сұйық судың немесе
будың қысымы мен температурасын белгілі
бір шектен артық өзгертсек су мұзға, не
буға айналады, бу конденсацияланып суға
н сублимацияланып мұзға айналады.
Диаграмманың үштік нүктесінде (О нүктесі)
жүйе инвариантты: Е=1-3+2=0. Үштік нүктедегі
қысым мен температураның мәндерін
өзгертуге болмайды, олардың өзгерісі
жүйені үш фазалық күйден екі немесе
бір фазалы күйге көшіреді. Тұрақты
қысымда температураның өсуі немесе
тұрақты температурада қысымның төмендеуі
жүйені буға, ал тұрақты температурада
қысымның жоғарылауы сұйық суға
айналдырады. Диаграммадағы ОС қисығын
С нүктесінен әрі қарай созуға болмайды,
өйткені С нүктесінде (кризистік нүкте)
су түгелімен буға айналады. Бұл қисықтың
мұз жазықтығына қарай созындысы (ОД
қисығы) аса суыған судың буымен
тепе-теңдігін көрсетеді. Аса суыған су
метастабильді (тұрақсыз) күйде болады,
себебі оның қаныққан бу қысымы (химиялық
потенциалы, µ1)
мұздың бу қысымынан (химиялық потенциалынан,
µ2)
жоғары, яғни µ1>
µ2,
сондықтан аса суыған су сыртқы жағдайлардың
болымсыз өзгерісінде лезде мұзға айналып
кетеді. ОА қисығын О нүктесінен әрі
қарай созу мүмкін емес (себебі қатты
заттар өзінің балқу температурасында
сұйыққа айналады, яғни олардың қатты
күйін сақтай отырып аса қыздыруға
болмайды).
