
- •I. Изомерия и номенклатура.
- •Названия наиболее часто встречающихся углеводородных радикалов
- •II. Общие свойства и строение алканов.
- •2. Каталитическое гидрирование оксида углерода - синтез Фишера-Тропша (1925 г).
- •IV. Физические свойства.
- •V. Химические свойства алканов.
- •VI. Применение важнейших представителей алканов.
2. Каталитическое гидрирование оксида углерода - синтез Фишера-Тропша (1925 г).

Б. Синтетические методы – для получения индивидуальных алканов.
Гидрирование непредельных углеводородов – алкенов
![]()
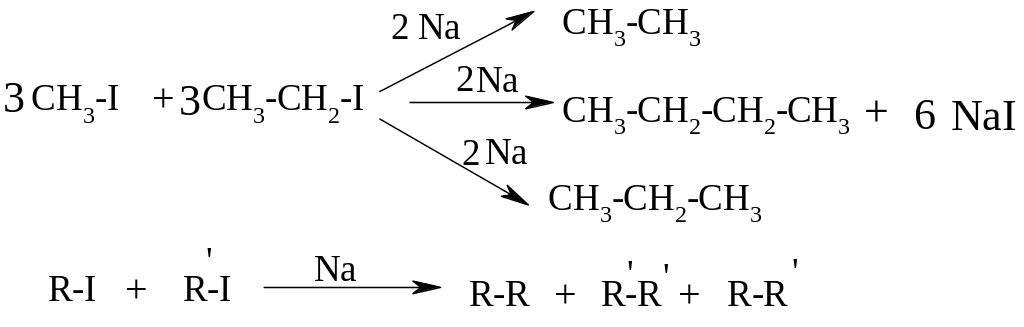
Реакция Вюрца – взаимодействие галогенпроизводных с металлическим натрием.
- из одногогалогенпроизводного
![]()
- из двух галогенпроизводных - образуется смесь 3-х углеводородов
5. Декарбоксилирование (отщепление СО2) солей карбоновых кислот
Образуется углеводород, в котором меньше на один атом углерода, чем в исходной молекуле карбоновой кислоты

IV. Физические свойства.
Углеводороды состава С1-С4 – в обычных условиях газы,
С5-С15 – жидкости,
С16 и выше – твердые вещества.
Увеличение молекулярной массы приводит к повышению температуры кипения и температуры плавления, увеличению плотности вещества. Углеводороды с разветвленной цепью кипят при более низкой температуре, чем соответствующие им соединения нормального строения, а температура плавления у изомеров изостроения в ряде случаев имеет более высокие значения.
V. Химические свойства алканов.
Алканы в обычных условиях химически инертны – не взаимодействуют реагентами (кислоты, щелочи), окислителями, активными металлами.
Разрыв предпочтительнее идет по связи С-Н, что связано с их большей доступностью для атаки химическими реагентами.
Для алканов характерны реакции:
- замещения атомов Н;
- расщепления (крекинга) С-С;
- окисления.
Галогенирование (действие галогенов)
Реакция хлорирования идет или на свету (фотохимической галогенирование) или при нагревании (300 0С; термическое хлорирование)

В разветвленных алканах с большей скоростью замещается Н у третичного атома С.

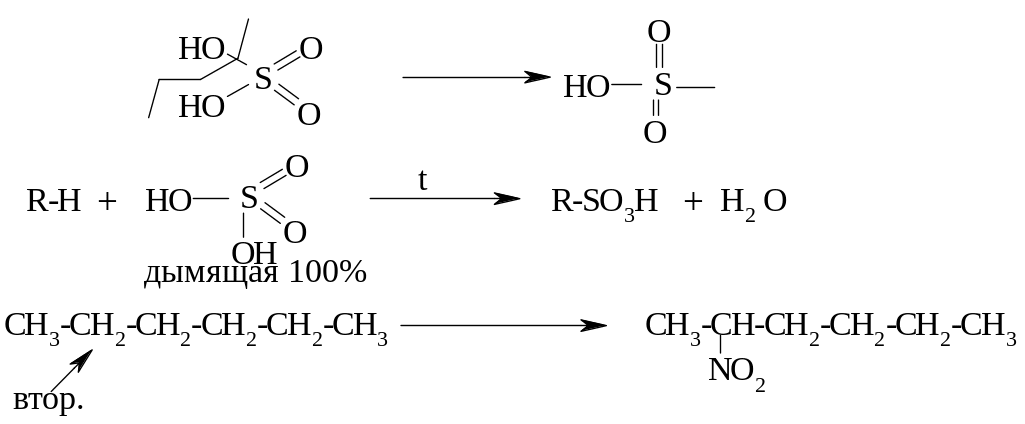
Нитрование – замещение атома Н на NO2-группу (действие HNO3). При обычной температуре алканы с конц. HNO3 не взаимодействуют; при нагревании разбавленная кислота нитрует алкан.

Сульфирование – взаимодействие с H2SO4; замещение атома Н на сульфогруппу –SO3H.
Сульфохлорирование и сульфоокисление (SO2 + Cl2) или (SO2 + O2).

Дегидрирование (отщепление Н2). Реакция протекает с разрывом связи С-Н).
![]()
Окисление
а) при 20 0С устойчивы к действию обычных окислителей KMnO4, K2Cr2O7.
б) при высокой температуре происходит сгорание.

Сгорание 1 кг СН4 дает 57 000 кДж.
в) окисление О2 воздуха при средних температурах 110-130 0С, в присутствии катализатора (MnO2), образуются карбоновые кислоты

Пиролиз алканов.
При сильном нагревании выше 1000 0С без доступа воздуха углеводороды полностью разлагаются на углерод и водород – разрыв С-С и С-Н связей.

Крекинг – реакции разрыва С-С-связи при высоких температурах (термическое разложение алканов)

VI. Применение важнейших представителей алканов.
Метан – не обладает ни цветом, ни запахом, плохо растворяется в воде. Используется как топливо – средняя теплотворная способность 1 м3 природного газа содержащего 95-98% СН4 составляет 46 тыс. кДж, как химическое сырье:
- При пиролизе получают сажу, используемую в резиновой промышленности, а водород в производстве аммиака.
- Конверсией метана получают синтез-газ (СО и Н2) используемый на получение бензина

- Хлорированием CH3Cl, (CH3)2SiCl2 –диметилдихлорсилан из него получают силикон, СHCl3 хлороформ, СCl4 – растворитель, пятновыводитель, CF2Cl2 – фреон 12-хладогент.
- Окисленим метана дает метиловый спирт, дальнейшее окисление формальдегид и затем муравьиную кислоту, используется для получение пластмасс.
Этан, пропан, бутан и пентан используются в технике для получения соответственно этилена, пропилена, дивинила и изопрена. Смесь пропана и бутана – бытовой сжиженный газ.
Жидкие углеводороды используются как моторное топливо. Для двигателей внутреннего сгорания требуется топливо с высоким “октановым числом”. В процессе химической подготовки паровоздушной смеси (топливо и воздуха) в двигателе внутреннего сгорания накапливаются взрывчатые пероксиды, которые могут детонировать раньше, чем наступит необходимый момент для воспламенения смеси, т.е. раньше, чем поршень двигателя дойдет до нужного положения. Детонация снижает мощность двигателя, повышает износ, что вызывает порчу мотора – двигатель стучит. Увеличение степени сжатия паровоздушной смеси в цилиндре двигателя вызывает детонацию. Поэтому от моторного топлива требуется, чтобы оно было максимально устойчиво к детонации. Легко детонируют углеводороды нормального строения. Для того чтобы сравнивать способность к детонации различных горючих материалов, построили специальную шкалу. За нуль в этой шкале принят н-гептан, за 100 –изооктан.
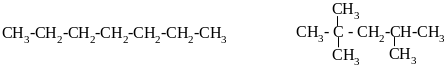
Н-гептан ОЧ=0 изоктан ОЧ=100
Если исследуемое топливо детонирует так же, как смесь 76% изооктана и 24% н-гептана, то топливу присваивают октановое число 76.

Обратная картина у дизельных двигателей - топливо должно быстро загораться, поэтому самым ценным компонентом являются алканы нормального строения. Показатель качества такого топлива называется цетановое число. С16Н34 – гексадекан (цетан) имеет ЦЧ=100, а 1-метилнафталин ЦЧ=0.
Высшие жидкие и твердые парафины используются как топливо (дизельное), смазочный материал, в виде твердого парафина.
