
- •1.Химиялық термодинамика. Негізгі түсініктер.
- •Қоршаған ортамен массасы мен энергиясымен байланысуына қарай
- •Фазалар саны бойынша
- •2.Термодинамиканың бірінші батамасы. Ішкі энергия. Энтальпия
- •Химиялық реакцияның жылу эффектісі. Гесс заңы және одан шығатын салдары. Кирхгофф заңы.
- •4.Термодинамиканың екінші бастамасы. Энтропия.
- •5.Изохоралық-изотермиялық және изобаралық-изотермиялық потенциал. Процесстердің өздігінен жүрудің шарттары.
- •1.Презентация (слайдтар)
- •Гиббстің фазалар ережесі.
- •Клапейрон- Клаузиус теңдеуі және оның булану, балқу мен сублимация процестеріне қолданылуы.
- •Бір компонентті жүйелердің күй диаграммалары. Судың күй диаграммасы.
- •4. Сұйық күйінде компоненттердің өзара шексіз еритін және қатты күйінде компоненттері өзара ерімейтін (изоморфты емес) , химиялық қосылыс түзбейтін жүйелер.
- •5. Физика - химиялық анализ туралы түсінік (н.С.Курнаков). Термиялық анализ.
- •6. Фазалық диаграммалардың фармация үшін маңызы.
- •Ерітінділердің коллигативті қасиеттері. Рауль заңы
- •Рауль заңынан шығатын салдарлар. Криометрия. Эбуллиометрия. Фармацияда қолданылуы.
- •3. Осмос және осмостық қысым. Вант-Гофф заңы.Осмостың организмнің тіршілігіндегі және дәрілік заттардың әсеріндегі рөлі Жартылай өткізгіш мембрана:
- •1.Меншікті электрөткізгіштік және оның түрлі факторларға тәуелділігі. Абсолютті қозғалыс жылдамдылығы және иондардың қозғалғыштығы
- •2. Эквивалентті (молярлық) элетрөткізгіштік. Кольрауш заңы.
- •3. Сусыз ерітінділердің электрөткізгіштігі
- •4. Кондуктометрия.
- •5. Кондуктометрлік титрлеу және оның фармацевтикалық анализде қолданылуы.
- •1. Беттік құбылыстар және адсорбция. Негізгі түсініктері.
- •2. Фазалардың жылжымалы бөліну бетіндегі («сұйықтық -газ», «сұйықтық-сұйықтық») адсорбциясы.
- •3. Жұғу. Ағу. Когезия. Адгезия
- •5. Күшті электролиттердің эквивалентті және талғамды адсорбциясы. Ион алмасу адсорбциясы
- •Презентация (слайдтар)
- •Плакаттар.
- •3. Коллоидты ерітінділердің классификациясы
- •5. Коллоидты ерітінділерді тазарту әдістері.
- •Коллоидты ерітінділердің кинетикалық және агрегативтік тұрақтылығы
- •Зольдердің электролиттермен коагуляциясы. Шульце-Гарди ережесі
- •Коллоидты ерітінділердің тұрақтылық теориялары
- •Коллоидты қорғау. Дәрілік қалыптардың технологиясындағы маңызы
- •Жмз. Негізгі түсініктері. Жмз жіктелуі.
- •Жмз ерітінділерінің тұтқырлығы
- •Полиэлектролиттер. Изоэлектрлік нүкте
- •Жмз ерітінділерінің осмостық қысымы. Доннан мембраналық тепе-теңдігі
- •Гельдер мен сірнелер
- •Балқу нүктесін анықтауға арналған “Apotec” құралын пайдалану бойынша жетекшілік
- •2 Кесте:
- •2 Кесте:
- •I тәжірбие. Мыс(II) және темір (III) иондарын бір-бірінен бағаналық хроматографиямен бөлу
- •2 Тәжірбие. Тағам өнімдеріндегі темір(III) ионын қағаздық хроматография әдісімен анықтау.
1. Беттік құбылыстар және адсорбция. Негізгі түсініктері.
Беттік құбылыстар – фазалардың бөліну бетінде жүретін және беттік (жанасу) қабаттың құрамы мен құрылысының ерекшеліктерімен сабақтасқан процестер.
Фазаның меншікті беттік қабаты (Sмен) – бұл фазаның жанасу бетінің қосынды ауданының (Sсум), оның көлеміне (V) қатынасына тең шама:
Sуд
=

Беттік керілу (σ) - бұл сандық жағынан тұрақты температурада фазалардың бөліну бет бірлігін түзу үшін атқарылатын жұмысқа тең (Дж/м2) (энергетикалық анықтау).
Беттік керілу (σ) - дененің беттік қабатына жанама бойынша әсер ететін және бос беттік қабатына берілгенкөлемде минимумға дейін қысқартуға ұмтылатын күш (Н/м) (күштік анықтау)
Беттік энергия (dGS)
dGS = σ×dS,осындағы
σ - беттік керілу коэффициенті, Дж/ м2
dS - беттік қабаттың ауданының шексіз аз өзгерісі, м2
Беттік активтілік (g) – бұл ерігене заттардың еріткіштің беттік керілуін өзгерте алатын қабілетін сиппатайтын шама (Дж·м/моль н·м2/моль):
g
= -
 немесе g
= -
немесе g
= -

Адсорбция - бұл фазалардың бөліну бетінде еріген заттың концентрациясының өздігінен өзгеретін процесі.
Десорбция – бұл адсорбцияға кері процесс.
Адсорбент - бет қабатында адсорбция процесі жүретін зат.
Оң адсорбция – бұл фазалардың бөліну бетінде еріген заттың концентрациясының өздігінен арта жүретін процесі.
Теріс адсорбция – бұл фазалардың бөліну бетінде еріген заттың концентрациясының өздігінен азая жүретін процесі.
Адсорбциялық (динамикалық) тепе-теңдік – адсорбция жылдамдығы мен десорбция жылдамдығы тең болатын жүйенің күйі (wадс=wдесорб)
Физикалық адсорбция – адсорбтив молекулалары адсорбент беттік қабатымен әлсіз молекулааралық ван-дер-ваальс күштерімен байланысқан адсорбция процесі.
Физикалық адсорбция процесінің сипаттамасы:
қайтымдылығы;
жоғары жылдамдылық;
таңдамалылығы аз;
кішігірім адсорбциялық жылуы (8-40 кДж/моль);
температураны артқан сайын кемуі.
Химиялық адсорбция (хемосорбция) – адсорбтив молекулалары адсорбентпен реакцияға түсіп, адсорбент пен адсорбтив арасында иондық (ковалентті, координациялық) байланыс түзе жүретін процесі.
Хемосорбция процесінің сипаттамасы:
қайтымдылығы;
таңдамалылығы;
жоғары адсорбциялық жылуы (800-1000 кДж/моль);
температураны артқан сайын өсуі;
Капиллярлық конденсация – бұл қатты сорбент кеуектерінде будың қысылу процесі.
Адсорбцияға әсер ететін факторлар:
адсорбент табиғаты;
адсорбтив табиғаты;
температура;
қысым;
Адсорбтив (адсорбат) – адсорбент бетінде адсорбцияланатын зат.
адсорбтив концентрациясы.
Адсорбенттерге мысалдар:
активтендірілген көмір;
алюминий оксиді Al2O3;
силикагель;
жоғары дисперсті металдар.
2. Фазалардың жылжымалы бөліну бетіндегі («сұйықтық -газ», «сұйықтық-сұйықтық») адсорбциясы.
Беттік керілу изотермасы – бұл тұрақты температурада еріген заттың беттік керілуінің тепе-теңдік концентрацияға графикалық тәуелділігі.
Беттік-активті емес заттар (БАЕЗ) – бұл еріткіштің беттік керілуі шамасын өзгертпейтін немесе кішігірім жоғарылататын заттар.
БАЕЗ-ға мысалдар:
бейорганикалық тұздар, негіздер, қышқылдар (NaCl, KOH, H2SO4)
кейбір органикалық заттар (гомологтық алғашқы қатары: аминсірке қышқылы NH2CH2COOH, құмырсқа қышқылы HCOOH, формальдегид).
БАЕЗ сипаттамалары:
суда жақсы ерігіштігі (және тағы басқа еріткіштерде);
еріткішпен салыстырғанда беттік керілу шамасының үлкен болуы (σБАЕЗ>σсу )
еріткіш пен еріген заттар молекулаларының арасындағы өзара әрекеттесудің еріткіш молекулаларының арасындағы өзара әрекеттесуге қарағанда артық болуы;
ерітіндінің бүкіл көлемінде біркелкі таралуы.
Беттік активті заттар (БАЗ) – бұл еріткіштіңбеттік керілуі шамасын азайтатын заттар.
Баз-ға мысалдар:
майлы қышқылдар (CH3COOH және т.б)
белоктар
спирттер және т.б.
Дифильді молекулалар – бір уақытта полярлы топтар мен көмірсутекті радикалы бар молекулалар.
 БАЗ
молекулаларының схемалық бейнеленуі:
БАЗ
молекулаларының схемалық бейнеленуі:
 CH3-CH2-COOH
CH3-CH2-COOH
БАЗ сипаттамалары:
суда және т.б. еріткіштерде нашар ерігіштігі;
ерткішпен салыстырғанда беттік керілу шамасының төмен болуы ....;
еріткіш пен еріген заттар молекулаларының арасындағы өзара әрекеттесудің еріткіш молекулаларының арасындағы өзара әрекеттесуге қарағанда кем болуы;
БАЗ молекулалары беттік қабатта белгілі бір бағытта орналасқан.
Дюкло-Траубе ережесі:
Дюкло-Траубе ережесіне сәйкес көмірсутек тізбегі бір –СН2- топқа ұзарған сайын заттың беттік активтілігі орташа 3-3,5 есе артады.
Дюкло-Траубе ережесінің қолданылуы:
Органикалық қосылыстардың гомологтық қатарлары;
Тек сұйықтылған ерітінділер;
Бөлме температурасына жақын температура;
Шекті адсорбция (Г) – бұл адсорбент қабатының бірлік ауданына келетін адсорбтив мөлшерімен (моль) өлшенетін шама (моль/м2).
Гиббс теңдеуі:
Г
= -
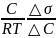 , осындағы
, осындағы
Г- адсорбцияланған зат мөлшері, моль/м2;
С- еріген заттың молярлық концентрациясы, моль/м2;
R- универсальді газ тұрақтысы, 8,314 Дж/(моль К);
-(dσ/dC) – беттік активтілік, (Дж*м)/моль.
Адсорбции изотермасы – бұл тұрақты температурада еріген заттың адсорбция шамасының концентрацияға графикалық тәелділігі.
