
- •1)Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
- •2)Основные классы неорганических соединений:
- •О ксиды
- •6) Периодическая система Менделеева. Периодические изменения свойств химических элементов в соответствии с электронной структурой атома. Семейство s,p.D.F - элементов.
- •7)Период, группы, подгруппы.
- •13)Ряд активности металлов. Химические свойства металлов. Отношения металлов к кислотам hCl, h2so4, hno3.Пассивация металлов. Взаимодействие металлов с царской водкой.
- •24)Химический эквивалент элемента. Эквивалент оксида, соли основания, кислоты. Закон эквивалентов.
- •FЭ (формульная единица вещества) ≡эквивалент
- •Эквивалент оксида, основания, кислоты и соли:
- •25)Коррозия металлов. Классификация коррозийных процессов.
- •26)Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов.
- •27)Защитные покрытия(катодные, анодные, металлические, неметаллические, химические).
- •28)Воздействие на среду с целью снижения ее коррозийной активности.
- •29)Изменение состава или структуры металла, ведущие к повышению их коррозийной стойкости.
- •30)Электрохимическая защита: протекторная, катодная, анодная, электродренажная.
- •31)Энергетика химических процессов. Что изучает термодинамика? Гомогенные и гетерогенные системы. Состояния системы. Параметры состояния.
- •32)Процессы: обратимые и необратимые. Изотермический, изобарный, изохорный, адиабатический процессы.
- •33)Первое начало термодинамики. Внутренняя энергия. Энтальпия. Тепловой эффект.
- •34)Термохимические расчеты. Закон Гесса. Следствие закона Гесса.
- •Следствия из закона Гесса:
- •36)Энтропия. Ее изменение при химических процессах. Второе начало термодинамики.
31)Энергетика химических процессов. Что изучает термодинамика? Гомогенные и гетерогенные системы. Состояния системы. Параметры состояния.
Энергетика химических процессов - химические реакции чаще всего сопровождаются тепловыми явлениями, которые изучаются в особенном разделе химии - термохимии. В этом разделе используют термохимические уравнения, в которых отмечен тепловой эффект реакции. Тепловой эффект реакции - это количество теплоты, которая выделяется или поглощается в реакции при постоянном давлении или объеме, причем продукты реакции имеют такую же температуру, что и исходные вещества.Термохимические расчеты выполняют по закону Гесса: тепловой эффект химической реакции при постоянном давлении и объеме не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ. Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц —термодинамические системы. Процессы, происходящие в таких системах, описываются макроскопическими величинами, такими как давление или температура, которые не применимы к отдельным молекулам и атомам.
Фаза – часть системы, однородная по составу и строению и отделенная от других частей системы (других фаз) границей раздела (межфазной границей). Гомогенная система – система, состоящая из одной фазы. Гетерогенная система – система, состоящая из двух или большего числа фаз.
Горючесть — свойство вещества, определяющее его способность к самостоятельному горению и зависящее от параметров состояния системы вещество — окислительная среда (температуры, давления, объема), а также от агрегатного состояния вещества (степени измельчения) и окислительной среды. По горючести вещества подразделяются на три группы негорючие — вещества, неспособные к горению в воздухе нормального состава (негорючие вещества могут быть пожароопасными) трудно-горючие — вещества, способные загораться под действием источника.Взаимосвязь параметров, описывающих состояния системы, называется функцией состояния. Например объем газовой системы есть функция давления и температуры. Энергия— также функция состояния. Одним из основных свойств любой функции состояния является независимость ее изменения.Внутренняя энергия системы, будучи функцией состояния, является функцией независимых переменных (параметров состояния) системы. Состояние системы (вещества или совокупности веществ) описывают с помощью ряда параметров — температуры, давления, объема, массы. Для характеристики состояния системы и происходящих в ней изменений важно знать также изменение таких свойств системы, как ее внутренняя энергия и, энтальпия Н, энтропия 5, энергия Гиббса С. По изменению этих свойств системы можно судить, в частности, об энергетике процессов.
32)Процессы: обратимые и необратимые. Изотермический, изобарный, изохорный, адиабатический процессы.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая — способ его проведения.Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам. В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции! Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом. Законы необратимых процессов могут быть обоснованы с помощью методов электрокинетической теории тепла.
Изобарный
процесс —
процесс изменения состояния
термодинамической системы при постоянном
давлении ( )
)
 .Изохорный
процесс — процесс изменения состояния
термодинамической системы при постоянном
объёме (V=const). Для идеальных газов
изохорический процесс описывается
законом Шарля: для данной массы газа
при постоянном объёме, давление прямо
пропорционально температуре:
.Изохорный
процесс — процесс изменения состояния
термодинамической системы при постоянном
объёме (V=const). Для идеальных газов
изохорический процесс описывается
законом Шарля: для данной массы газа
при постоянном объёме, давление прямо
пропорционально температуре:
 .
Изотермический
процесс — процесс изменения состояния
термодинамической системы при постоянной
температуре (T=const)(PV=const). Изотермический
процесс описывается законом Бойля —
Мариотта:
.
Изотермический
процесс — процесс изменения состояния
термодинамической системы при постоянной
температуре (T=const)(PV=const). Изотермический
процесс описывается законом Бойля —
Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Адиабати́ческий, или адиаба́тный проце́сс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
Если
термодинамический процесс в общем
случае являет собой три процесса —
теплообмен, совершение системой (или
над системой) работы и изменение её
внутренней энергии, то адиабатический
процесс в силу отсутствия теплообмена
( )
системы со средой сводится только к
последним двум процессам. Поэтому, первое
начало термодинамики в
этом случае приобретает вид
)
системы со средой сводится только к
последним двум процессам. Поэтому, первое
начало термодинамики в
этом случае приобретает вид

где 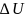 —
изменение внутренней
энергии тела, A — работа,
совершаемая системой.
—
изменение внутренней
энергии тела, A — работа,
совершаемая системой.
