
- •1)Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
- •2)Основные классы неорганических соединений:
- •О ксиды
- •6) Периодическая система Менделеева. Периодические изменения свойств химических элементов в соответствии с электронной структурой атома. Семейство s,p.D.F - элементов.
- •7)Период, группы, подгруппы.
- •13)Ряд активности металлов. Химические свойства металлов. Отношения металлов к кислотам hCl, h2so4, hno3.Пассивация металлов. Взаимодействие металлов с царской водкой.
- •24)Химический эквивалент элемента. Эквивалент оксида, соли основания, кислоты. Закон эквивалентов.
- •FЭ (формульная единица вещества) ≡эквивалент
- •Эквивалент оксида, основания, кислоты и соли:
- •25)Коррозия металлов. Классификация коррозийных процессов.
- •26)Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов.
- •27)Защитные покрытия(катодные, анодные, металлические, неметаллические, химические).
- •28)Воздействие на среду с целью снижения ее коррозийной активности.
- •29)Изменение состава или структуры металла, ведущие к повышению их коррозийной стойкости.
- •30)Электрохимическая защита: протекторная, катодная, анодная, электродренажная.
- •31)Энергетика химических процессов. Что изучает термодинамика? Гомогенные и гетерогенные системы. Состояния системы. Параметры состояния.
- •32)Процессы: обратимые и необратимые. Изотермический, изобарный, изохорный, адиабатический процессы.
- •33)Первое начало термодинамики. Внутренняя энергия. Энтальпия. Тепловой эффект.
- •34)Термохимические расчеты. Закон Гесса. Следствие закона Гесса.
- •Следствия из закона Гесса:
- •36)Энтропия. Ее изменение при химических процессах. Второе начало термодинамики.
13)Ряд активности металлов. Химические свойства металлов. Отношения металлов к кислотам hCl, h2so4, hno3.Пассивация металлов. Взаимодействие металлов с царской водкой.
Металлы от Li до Al активные, после Al до H средней активности, после Н малоактивные. Чем выше металл тем химически активнее. Все металлы стоящие до водорода вытесняют водород из без кислородных кислот HCl и H2SO4(р). Более активные металлы вытесняют менее активные металлы из растворов их солей.
Хим.св.: Все металлы являются восстановителями т.е. они отдают электроны.
Взаимодействие
с HCl:
металлы стоящие до водорода вытесняют
водород из HCl(р,к).

Взаимодействие
с H2SO4(р):
металлы стоящие до водорода вытесняют
водород из H2SO4(р)

Взаимодействие
с H2SO4(к):
металл+ H2SO4(к)→металл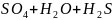 (активный
металл); +S(металл
средней активности); +
SO2(малоактивные
металл после H).
(активный
металл); +S(металл
средней активности); +
SO2(малоактивные
металл после H).
Взаимодействие
с HNO3(к):
металл+ HNO3(к)→ (щелочные);
+NO2(тяжелые
металлы) HNO3(к)
не действует на Fe,
Al,
Pt,
Jr,
Ta.
(щелочные);
+NO2(тяжелые
металлы) HNO3(к)
не действует на Fe,
Al,
Pt,
Jr,
Ta.
Взаимодействие
с HNO3(р):металл+
HNO3(р)→ (металлы щелочные и щелочноземельные
+ Sn,Fe)
(металлы щелочные и щелочноземельные
+ Sn,Fe)
+NO(тяжелые металлы)
Взаимодействие с царской водкой 3HCl(к)+HNO3(к) царская водка растворяет благородные металлы(Au,Pt,Os,Ro)

Некоторые кислоты при взаимодействии с металлом образуют на поверхности прочную и трудно растворимую пленку, которая препятствует взаимодействию металлов с кислотой, этот процесс называется пассивацией металлов. Пассивация металлов имеет место при взаимодействии H2SO4(к) при низких температурах с Al,Cr,Fe.
14)Взаимодействие металлов с щелочами. Взаимодействие металлов с водой.
Со щелочами реагируют те металлы оксиды и гидроксиды которых обладают амфотерными свойствами (Al,Zn,Sn,Cr,Pb,Be,.... .)

С водой взаимодействую металлы оксиды и гидроксиды которых растворимы в воде.(щелочные и щелочноземельные металлы)

15)Понятие об электродных потенциалах. Стандартные электродные потенциалы. Двойной электрический слой. Стандартный водородный электрод.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
16)Ряд напряжений. Формула Нернста.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
В ряду напряжений восстановительные свойства металлов сверху вниз ослабевают, а окислительные усиливаются. Каждый металл способен вытеснять из растворов солей те металлы которые имеют большее значение электрического потенциала.
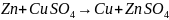 ;
;

Металлы имеющие отрицательные значения E0 т.е. стоят до Н могут вытеснять Н из растворов кислот HCl и H2SO4(р)
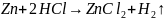 ;
;

Ур-е Нернста: при условиях отличных от стандартных
 E0
- стандартный электронный потенциал;
E0
- стандартный электронный потенциал;


17)Гальванический элемент Даниэля-Якоби.. Электродвижущая сила гальванического элемента.
Гальванический
элемент это прибор для превращения
химической энергии в электрическую.
При замкнутой цепи в гальваническом
элементе протекаю следующие процессы:
1. Реакция окисления цинка:
 .
Процесс окисления называется анодным,
а электрод анодом и заряжен отрицательно.
2.Реакция восстановления катионов меди:
.
Процесс окисления называется анодным,
а электрод анодом и заряжен отрицательно.
2.Реакция восстановления катионов меди:
 Процесс восстановления называют
катодным, а электрод катодом и заряжен
положительно. 3. Движение электронов по
внешнему проводнику. 4.Движение ионов
в растворе: анионов к аноду и катионов
к катоду.
Процесс восстановления называют
катодным, а электрод катодом и заряжен
положительно. 3. Движение электронов по
внешнему проводнику. 4.Движение ионов
в растворе: анионов к аноду и катионов
к катоду.
Схема г\эл:
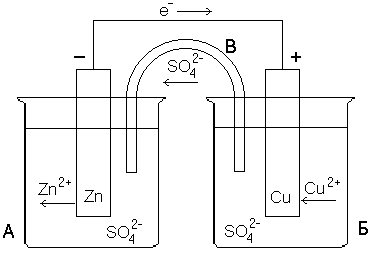
ЭДС г\эл: ЭДС=Ек-Еа. Катод это электрод с большим значением электрического потенциала. Анод это электрод с меньшим значением электрического потенциала.
18)Концентрационный гальванический элемент.
Это элемент построенный из электродов одного и того же металла, погруженных в растворы собственных солей с разной концентрацией катионов металла.
Cu/Cu
CuSO4 CuSO4

19)Гальванический элемент с одним электролитом.

_____________________________________
20)Электролиз. Электролиз расплавов.
Электролиз - это окислительно-восстановительный процесс протекающий при прохождении электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза называется электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления(катод) подключен к отрицательному катоду источника тогда, катод заряжен отрицательно. Электрод на котором протекает реакция окисления(анод) подключен к положительному источнику тока.
Электролиз расплавов.
NaCl 800̊ C

(+)A;
 |1
|1
|2
__________________________

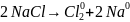
Эта реакция протекает несамопроизвольно для нее энергия поступает от внешнего источника тока.
Расплав KOH:
_________________________________


21)Электролиз водных растворов электролитов. Последовательность восстановительных процессов на катоде. Последовательность окислительных процессов на аноде.
Электролиз водных растворов электролитов: под действием электрического тока электролизу подвергаются молекулы воды и электролита.
1
____________________________________
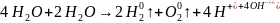

Последовательность восстановительных процессов на катоде:
1. Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, расположены в ряду напряжений после него: Cu2+, Hg22+, Ag+, Pt2+, ..., до Pt4+. При электролизе они почти полностью восстанавливаются на катоде и выделяются в виде металла.2. Катионы металлов с малой величиной стандартного электродного потенциала (металлы начала ряда напряжений Li+, Na+, K+, Rb+, ..., до Al3+ включительно). При электролизе на катоде они не восстанавливаются, вместо них восстанавливаются молекулы воды.
3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у водорода, но большим, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, ..., до H). При электролизе эти катионы, характеризующиеся средними величинами электроноакцепторной способности, на катоде восстанавливаются одновременно с молекулами воды.На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например, из смеси катионов Cu2+, Ag+ и Zn2+ при достаточном напряжении на клеммах электролизера вначале восстанавливаются ионы серебра (E0=+0,79 В), затем меди (E0=+0,337 В) и, наконец, цинка (E0=–0,76 В).
Последовательность окислительных процессов на аноде:
На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих анионы F-, SО42- , NO3-, РO43-, ОН- выделяется кислород;
б) при окислении галогенид-ионов выделяются свободные галогены ;
в) при окислении анионов органических кислот происходит процесс:
2RCOO- - 2е → R-R + 2СО2.
2. При электролизе растворов солей , содержащих ионы , расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен правее водорода, то выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные между Аl3+ и Н+ на катоде могут протекать конкурирующие процессы как восстановления катионов, так ивыделения водорода.
22)Электролиз с нерастворимыми (инертнами) и растворимыми анодами.
Анодные процессы зависят от природы электролита и материала, из которого сделан анод.
В зависимости от природы анода различают растворимые (активные) инерастворимые (инертные) аноды. В случае электролиза с растворимым анодом происходит окисление анода с образованием соответствующих ионов металла. Анод изготовлен из того металла, ионы которого присутствуют в растворе. Например, если проводить электролиз раствора сульфата меди (II) с медными электродами, то на катоде будет идти восстановление ионов Cu2+ из раствора: Cu2+ + 2e →Cu0, а анод будет окисляться, посылая ионы Cu2+ в раствор: Cu0 - 2e→Cu2+.
В результате происходит перенос ионов Cu2+ с анода на катод. Электролиз с растворимым анодом применяется для очистки металлов.
Если анод изготовлен из инертного материала (графита, угля, платины и др.), то на его поверхности происходит окисление либо кислотных остатков, либо молекул воды. При электролизе водных растворов солей бескислородных кислот, а также растворов щелочей на аноде происходит окисление кислотных остатков (Cl–, Br–, J–, S2–, OH–):
2Сl– - 2e→Cl2
4OH– - 4e → 2H2O + O2
При электролизе водных растворов солей кислородсодержащих кислот и HF анионы (SO42– , NO3–, PO43– , F– и др.) не окисляются, а на аноде происходит окисление молекул воды с образованием кислорода:
2Н2О - 4e→ О2 + 4Н+
23)Закон Фарадея. Выход по току. Применение электролиза.
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
 где:
m
— масса осаждённого на электроде
вещества в граммах; Q
— полный электрический заряд, прошедший
через вещество; F
= 96 485,33(83) Кл·моль−1 — постоянная Фарадея;
M
— молярная масса вещества (Например,
молярная масса воды H2O
= 18 г/моль); z
— валентное число ионов вещества (число
электронов на один ион).
где:
m
— масса осаждённого на электроде
вещества в граммах; Q
— полный электрический заряд, прошедший
через вещество; F
= 96 485,33(83) Кл·моль−1 — постоянная Фарадея;
M
— молярная масса вещества (Например,
молярная масса воды H2O
= 18 г/моль); z
— валентное число ионов вещества (число
электронов на один ион).
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества фактически пропущенного через электролит заряда Qf к теоретически необходимому Qt для осуществления фактически наблюдаемого массопереноса mf.
![]()
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по 1-му закону Фарадея:
![]()
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
