
- •1)Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
- •2)Основные классы неорганических соединений:
- •О ксиды
- •6) Периодическая система Менделеева. Периодические изменения свойств химических элементов в соответствии с электронной структурой атома. Семейство s,p.D.F - элементов.
- •7)Период, группы, подгруппы.
- •13)Ряд активности металлов. Химические свойства металлов. Отношения металлов к кислотам hCl, h2so4, hno3.Пассивация металлов. Взаимодействие металлов с царской водкой.
- •24)Химический эквивалент элемента. Эквивалент оксида, соли основания, кислоты. Закон эквивалентов.
- •FЭ (формульная единица вещества) ≡эквивалент
- •Эквивалент оксида, основания, кислоты и соли:
- •25)Коррозия металлов. Классификация коррозийных процессов.
- •26)Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов.
- •27)Защитные покрытия(катодные, анодные, металлические, неметаллические, химические).
- •28)Воздействие на среду с целью снижения ее коррозийной активности.
- •29)Изменение состава или структуры металла, ведущие к повышению их коррозийной стойкости.
- •30)Электрохимическая защита: протекторная, катодная, анодная, электродренажная.
- •31)Энергетика химических процессов. Что изучает термодинамика? Гомогенные и гетерогенные системы. Состояния системы. Параметры состояния.
- •32)Процессы: обратимые и необратимые. Изотермический, изобарный, изохорный, адиабатический процессы.
- •33)Первое начало термодинамики. Внутренняя энергия. Энтальпия. Тепловой эффект.
- •34)Термохимические расчеты. Закон Гесса. Следствие закона Гесса.
- •Следствия из закона Гесса:
- •36)Энтропия. Ее изменение при химических процессах. Второе начало термодинамики.
1)Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Степень диссоциации:
![]() n-число
молекул распавшихся на ионы.
n-число
молекул распавшихся на ионы.
N-общее число молекул
α-показывает какая часть растворенного электролита продиссоциировало на ионы .
α < 5% - слабые электролиты
} эти электролиты частично диссоциируют на ионы, поэтому их на ионы не расписывают:
α= от 5 до 30%- средние электрлиты
H2CO3, H2S, HCN, HNO2, H2SO3, H2PO4,.....; основания которые не растворимы в воде Be(OH)2, AL(OH)3, NH4OH, H2O.
α>30%- сильные электролиты, полностью диссоциируют на ионы: это все соли, NaOH, KOH.
Закон Оствальда:
Для слабых электролитов существует и другая хар-ка диссоциации это const(K) диссоциации- это отношение произведения концентраций ионов в растворе к концентрации не диссоциированых молекул


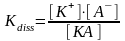 [
]- концентрация
[
]- концентрация
Чем
выше Kdiss,
тем больше концентрация ионов в растворе.
Kdiss
зависит
от природы электролита, расторителя,
температуры и независит от концентрации
раствора. Для слабых электролитов связь
Kdiss
и α
выражается уравнение Оствальда
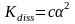 ,
где c-молярная
концентрация электролита.
,
где c-молярная
концентрация электролита.
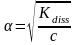 ,
видно что α возрастает с разбавлением
раствора.
,
видно что α возрастает с разбавлением
раствора.
2)Основные классы неорганических соединений:
Оксиды-это соединения из двух элементов одним их которых является кислород. В степени окисления -2.
Степень окисления- это формальный или условный заряд вычисленный в предположении что связи в молекуле ионные.
ЭxOy
Al2O3;CO
О ксиды


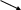 несолеобразующие
солеобразующие
амфотерные
несолеобразующие
солеобразующие
амфотерные
(CO;SiO;SiO2) (Al, Zn, Cr, Sn, Be, Pb)
основные кислотные
(NaO;K2O;MgO) (SO2;SO3)
Амфотерность-это способность электрона проявлять, как кислотные так и основные свойства.
ZnO + 2HCl →ZnCl2+H2O
ZnO+2NaOH→Na2ZnO2+H2O
Оксиды на ионы не диссоциируют.
Основания - это элемент диссоциирующий на катион металла и гидроксоанион.
NaOH↔Na++OH- - однокислотные основания (NaOH; KOH; LiOH)
Число OH групп в молекуле основания определяет ее кислотность.(2-x Ba(OH)2: 3-x Al(OH)3
Бывают
растворимые в воде щелочи: NaOH,
KOH,
LiOH;
Нерастворимые в воде: Fe(OH)2,
Fe(OH)3
Амфотерные
основания: Al(OH)3;Zn(OH)2
;
 ,
,
,
,
 .
.
Кислоты- это электролиты диссоциирующие на катион водорода и анионы кислотного остатка.
HCl↔H++Cl-
H 2SO4↔2H++SO2-4
Число
атомов в молекуле кислоты определяет
ее основность.(1-HCl;
2-H2SO4;
3-H3PO4)Безкислородные
кислоты: HCl,
HF,
HBr,
H2S;
Кислосодержащие кислоты:
2SO4↔2H++SO2-4
Число
атомов в молекуле кислоты определяет
ее основность.(1-HCl;
2-H2SO4;
3-H3PO4)Безкислородные
кислоты: HCl,
HF,
HBr,
H2S;
Кислосодержащие кислоты:
 HNO3
Удельная
кислота H2CO3→CO2↑
HNO3
Удельная
кислота H2CO3→CO2↑
H2O
Соли - это электролиты диссоциирующие на катионты металла и аонион кислотного остатка.
 Соль→кислота
+ основание
Соль→кислота
+ основание
При полном замещении атомов H в многоосновных кислотах атомами металла образуется нормальная или средняя соль, при неполном замещении - кислая соль.


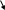

средняя или кислая соль кислая соль
В молекулах многокислотных основаниях замещение может быть полным и не понлным.
 ;
;
3)Ионно-обменные реакции. Обратимые и необратимые реакции. Признаки необратимых реакций.
ИОР-это реакции между ионами без изменения степени окисления. Обратимые ИОР- протекают в двух взаимопротивоположных направлениях и не доходят до конца.
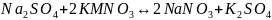
 ;
Необратимые ИОР идут одном направлении
доходят до конца.
;
Необратимые ИОР идут одном направлении
доходят до конца.
Признаки: 1)выпадает осадок;2)выделяется газ;3)образуются слабые электролиты


4)Строение атома
Атом имеет сложное строение. Согласно одной из первых моделей строения атома Томпсона 1897г.б положительно заряженный заряд равномерно расположен по всему объему атома с вкрапленными по нему электронами. Другая модель ядерная планетарная предложенная Резерфордом 1911г, согласно которой в центре атома расположен положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Однако эта модель столкнулась с 2-мя трудностями:
1)Излучение испускаемое атомами, должно иметь непрерывный спектр, тогда как наблюдаемые спектры линейные.2)Атомы по Резерфорду не стабильны так как электроны двигаясь по замкнутой траектории теряют энергию и радис орбиты уменьшается и электрон должен упасть на ядро.
След.модель была предложена Бором в 1913г., согласно которой электрон двигается по круговым орбитам.
Постулаты Бора:
1)В атому существует стационарные орбиты вращаясь по которым электрон не излучает, т.е. обладает энергией
2)электрон
в атоме может переходить с одной
стационарной орбиты на другую, при этом
испускается или поглащается энергия в
виде кванта
 Модель Бора объясняет строение атома
H
у которого один электрон. Квантово-механическая
модель-эксперементально установлено,
что электрон имеет двойственную природу:
он обладает свойствами частицы и волны.
Модель Бора объясняет строение атома
H
у которого один электрон. Квантово-механическая
модель-эксперементально установлено,
что электрон имеет двойственную природу:
он обладает свойствами частицы и волны.
Гейзенберг в 1927г. сформулировал принцип неопределенности, согласно которому электрон не имеет определенной траектории движения, можно установить только вероятность нахождения электрона в пространстве. Пространство вокруг ядра в котором наиболее вероятно нахождение электрона, называется атомной орбиталью. Каждый электрон в атоме заполняет определенную орбиталь.
5)Квантомеханическая модель атома: квантовые числа. Принцип Паули. Правило Гунда. Правила Клечковского.
Состояние электрона в атоме описывают четырьмя квантовыми числами. (n, l, m, s)
1. Главное квантовое число n, определяет энергию электрона и объем области пространства в котором наиболее вероятно нахождение электрона. n=1,2,3,4,5,6,7....∞ Обозначения: K,L,M,N,O,P,Q. Состояние электрона характеризуется определенным значением n и называют энергетическим слоем. При n=1 электрон находится на 1-ом эн.уровне → ) , при n=3 на 3-ем → ))).
2.Орбитальное квантовое число (l) характеризует форму орбитали (эн.подуровня) и принимает значения l=0,1,2,3....,n-1. Об-я: S,P,d,f.
Число подуровней равно номеру эн.уровня или значению n. n=1→ l=0→ S; n=2 l=0,1 S,P; n=3 l=0,1,2 S,P,d; n=4 l=0,1,2,3 S,P,d,f
Орбитали для которых l=0 имеют форму шара и называют эту орбиталь S-орбиталь, S-электроны l=1(P) l=2(d) l=3(f)
3. Магнитное квантовое число m, определяет ориентацию орбитали в пространстве и принимает значения от -l до +l, включая 0. Магнитное квантовое число m, определяет число орбиталей на подуровне m=2l+1. Пример: d(l=2) -2,-1,0,1,2 → 5 орбиталей.
4.Спиновое
квантовое число s,
характерезует спиновое состояние
электрона, связанное с собственным
магнитным моментом и принимает значение
 .
Эти значения
отвечают двум возможным проекциям
собственного момента спина и обозначается
.
Эти значения
отвечают двум возможным проекциям
собственного момента спина и обозначается
 ю
ю
Принцип Паули: все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон)
Правило Гунда: определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Правило Клечковского: При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа ~n и побочного (орбитального) квантового числа ~l, т.е. ~n+l, имеет меньшее значение.
