
- •1.2.1. Применение ионной флотации для извлечения тяжёлых металлов из техногенных вод
- •1.2.2. Обзор современных методов рационального подбора реагентов-собирателей для ионной флотации
- •2.5. Методы проведения расчётов квантово-химических параметров субстратов, реагентов-собирателей и систем «субстрат-реагент»
- •4.5. Квантово-химические исследования параметров реакционной способности субстратов меди, цинка, железа и марганца и установление их эффективных извлекаемых форм
- •Выводы по главе 4
- •5.1. Квантово-химический метод выбора реагентов-собирателей для флотационного извлечения катионов меди (II) и цинка из техногенных вод горных предприятий
- •5.1.1. Исследование квантово-химических прс молекул известных реагентов-собирателей, применяемых для флотационного извлечения катионов тяжелых и цветных металлов из техногенных вод
5.1.1. Исследование квантово-химических прс молекул известных реагентов-собирателей, применяемых для флотационного извлечения катионов тяжелых и цветных металлов из техногенных вод
Результаты проведенных квантово-химических расчётов ПРС молекул известных реагентов-собирателей, применяемых в настоящее время в практике флотационного извлечения катионов тяжелых и цветных металлов из техногенных вод, представлены в табл. 5.1. Можно отметить, что у приведённых реагентов наибольшая жёсткость проявляется у 1,2–диацилгидразина С2Н5 (η=10,321 эВ), n–додецилбензолсульфоната натрия (η=9,746 эВ) и натриевого мыла предельной карбоновой кислоты с R = C16H31 – гексанодеканоата (η=8,380 эВ), благодаря наличию в их составе типичных «жестких» групп (табл. 1.9, раздел 1.2.2). Определённая «мягкость» присуща этилксантогенату калия (0,128 эВ) и диэтилдитиокарбамату натрия (0,127 эВ) из-за присутствия «мягких» структур RSH, RS -.
Таблица 5.1
Рассчитанные параметры реакционной способности молекул известных
реагентов-собирателей
Соединение |
ЕНОМО |
ELUМО |
η, эВ |
χ,эВ |
Ѕ, эВ- |
IN, эВ- |
n-додецилбензолсульфонат натрия |
-9,789 |
-0,043 |
9,746 |
4,916 |
0,103 |
0,807 |
гексанодеканоат натрия |
-8,660 |
-0,280 |
8,380 |
4,470 |
0,119 |
0,839 |
этилксантогенат калия |
-8,533 |
-0,691 |
7,842 |
4,612 |
0,128 |
0,737 |
диэтилдитиокарбамат натрия |
-8,264 |
-0,365 |
7,899 |
4,315 |
0,127 |
0,848 |
1,2 - диацилгидразин |
-9,864 |
0,457 |
10,321 |
4,704 |
0,097 |
0,933 |
Структуры этилксантогената калия и диэтилдитиокарбамата натрия характеризуются примерно одинаковыми значениями абсолютной жёсткости (около 8 эВ). Наибольшие значения химического потенциала выявлены у n–додецилбензолсульфоната натрия (χ = 4,916 эВ) и 1,2 – диацилгидразина С2Н5 (χ = 4,704 эВ). Реагенты этилксантогенат калия (IN = 0,737 эВ-1), n-додецилбензолсульфонат натрия (IN = 0,807 эВ-1) в представленом ряду характеризуются более низкими значениями глобальной нуклеофильности по сравнению с 1,2–диацилгидразином (IN = 0,933 эВ-1).
Для оценки прочности образующихся при флотации систем «субстрат-реагент» были использованы следующие параметры: степень переноса заряда ΔN, энергия комплексообразования ∆Екомп и количество внутримолекулярных водородных связей. Наличие водородных связей вносит значительный вклад в общую энергетику образования металлокомплексов и способствует процессу самоорганизации (самосборки) [174, 180] систем «субстрат-реагент» (металлоорганических супрамолекулярных структур) в процессе флотации.
Для определения положения центров хемосорбции в молекулах реагентов (областей с наибольшей концентрацией отрицательного заряда) рассчитан такой важнейший показатель как молекулярный электростатический потенциал MEP, представляемый в виде проекционных карт. Проекционные карты MEP позволяют не только определять положение реакционных центров, но также прогнозировать возможность самосборки флотационных систем «субстрат-реагент». Ниже приведены результаты квантово-химических расчётов для реагентов, применяемых при флотационном извлечении катионов меди (II) и цинка n-додецилбензолсульфоната натрия [39], этилксантогената калия, диэтилдитиокарбамата натрия [336] в сравнении с перспективным реагентом 1,2 – диацилгидразином, разработанным в институте технической химии УрО РАН (г. Пермь) [268, 271].
Таблица 5.2
Малликеновские заряды на атомах молекулы n-додецилбензолсульфоната натрия С12Н25С6H4SO3Na
С12Н25С6H4SO3Na |
-C(CH3) |
-O- |
-S- |
(I) O=(S) |
(II) O=(S) |
Заряд на атоме, qе |
-0,110 |
-0,911 |
2,300 |
-0,843 |
-0,911 |

а)

б)
Рис. 5.1. Структура молекулы n-додецилбензолсульфоната натрия с указанием а) - длины связей (Å), б) - зарядов на атомах

Проекция ВЗМО (HOMO)

Проекция НСМО (LUMO)
Рис. 5.2. Графическое представление орбитальной и электронной плотностей молекулярных орбиталей n-додецилбензолсульфоната натрия

Рис. 5.3. Проекции молекулярного электростатического потенциала n-додецилбензолсульфоната натрия (зеленый – положительный заряд, красный – отрицательный заряд)
Малликеновские заряды на атомах молекулы n-додецилбензолсульфо-ната натрия С12Н25С6H4SO3Na приведены в табл. 5.2. Структура молекулы С12Н25С6H4SO3Na с указанием длины связей и зарядов на атомах показана на рис. 5.1, графическое представление орбитальной и электронной плотностей молекулярных орбиталей С12Н25С6H4SO3Na дано на рис. 5.2, проекции молекулярного электростатического потенциала – на рис. 5.3.
Согласно рис. 5.1 и 5.3, отрицательный заряд молекулы С12Н25С6H4SO3Na сконцентрирован на атомах кислорода сульфоновой группы. В сульфогруппе атомы кислорода обладают большей электроотрицательностью по сравнению с атомом серы и смещают электронную плотность на себя по индуктивному эффекту, при этом атом серы приобретает положительный заряд +2,3. Кроме того, электронная плотность смещается от атома кислорода связи O-S через серу к атомам кислорода, связанным двойными связями с серой, по мезомерному эффекту. Как следствие, атом кислорода, связанный одинарной связью с атомом серы, приобретает заряд -0,911, а атомы кислорода, связанные двойными связями, - заряды -0,843 и -0,911, следовательно, это активные центры хемосорбции.
Рис. 5.2 показывает, что амфифильная молекула n-додецилбензол-сульфоната натрия имеет короткую гидрофильную часть SO32- и длинную гидрофобную зигзагообразную углеводородную цепочку. Благодаря такому строению С12Н25С6H4SO3Na образует с субстратами (например, с катионами меди (II) и цинка) малорастворимые соединения, в центре которых находятся субстраты, прореагировавшие с гидрофильными частями молекул реагента, длинные гидрофобные части молекул реагента обращены наружу [149].
Малликеновские заряды на атомах молекулы этилксантогената калия C2H5OC(S)SK приведены в табл. 5.3. Структура молекулы C2H5OC(S)SK с указанием длины связей и зарядов на атомах показана на рис. 5.4, графическое представление орбитальной и электронной плотностей молекулярных орбиталей C2H5OC(S)SK дано на рис. 5.5, проекции молекулярного электростатического потенциала – на рис. 5.6. Аналогичные данные для диэтилдитиокарбомата натрия (C2H5)2NC(S)SNa приведены в табл. 5.4 и на рис. 5.7 – 5.9.
Таблица 5.3
Малликеновские заряды на атомах молекулы этилксантогената калия
C2H5OC(S)SK |
-C(CH3) |
-C(CH2) |
-O-(C) |
S=(C) |
-S- |
заряд на атоме, qе |
-0,122 |
0,019 |
-0,112 |
-0,475 |
-0,427 |

а)

б)
Рис. 5.4. Структура молекулы этилксантогената калия C2H5OC(S)SK с указанием а) - длины связей (Å), б) - зарядов на атомах

Проекция ВЗМО (HOMO)

Проекция НСМО (LUMO)
Рис. 5.5. Графическое представление орбитальной и электронной плотностей молекулярных орбиталей этилксантогената калия

Рис. 5.6. Проекции молекулярного электростатического потенциала этилксантогената калия (зеленый – положительный, красный – отрицательный заряд)
Таблица 5.4
Малликеновские заряды на атомах молекулы диэтилдитиокарбамата натрия (C2H5)2NC(S)SNa
(C2H5)2NC(S)SNa |
-C(CH3) |
-C(CH2) |
=N-(C)- |
S=(C) |
-S-(Na) |
заряд на атоме |
-0,122 |
-0,139 |
-0,233 |
-0,476 |
-0,426 |

а)

б)
Рис. 5.7. Структура молекулы диэтилдитиокарбамата натрия с указанием
а) - длины связей (Å), б) - зарядов на атомах

Проекция ВЗМО (HOMO)

Проекция НСМО (LUMO)
Рис. 5.8. Графическое представление орбитальной и электронной плотностей молекулярных орбиталей диэтилдитиокарбамата натрия
Анализ проекций МЕР (рис. 5.6 и 5.9) и данные табл. 5.3 и 5.4 показали, что активными центрами хемосорбции сульфгидрильных реагентов C2H5OC(S)SK и (C2H5)2NC(S)SNa являются атомы серы, на которых концентрируется значительный отрицательный заряд (-0,475 и -0,476, соответственно). Как известно, чем выше заряд на атоме серы, тем больше электростатическая составляющая молекулы, и, следовательно, выше реакционная способность флотореагента. Реакционная способность сульфгидрильных реагентов-собирателей обусловлена не только высокими значениями локальной нуклеофильности (табл. 5.1), но и значительными отрицательными зарядами, сконцентрированными на атомах серы за счет смещения электронной плотности в различных фрагментах молекул.

Рис. 5.9. Проекции молекулярного электростатического потенциала диэтилдитиокарбомата натрия (зеленый – положительный заряд, красный – отрицательный)
Структура ксантогенатной группы плоская, в ней содержатся группировки -O-C, C-S и C=S. Атом кислорода оттягивает электронную плотность на себя по индуктивному эффекту от атомов углерода с обеих сторон, однако он входит в сопряженную систему O-C(S)-S (рис.5.5), проявляет положительный мезомерный эффект (смещение электронной плотности в сторону группы –C=S), за счет чего на атоме кислорода возникает незначительный отрицательный заряд -0,112. Атомы серы оттягивают на себя электронную плотность по индуктивному эффекту. Атом серы, связанный с атомом углерода двойной связью, оттягивает по мезомерному эффекту электронную плотность на себя (отрицательный мезомерный эффект), поэтому данный атом серы заряжен отрицательно (-0,475). Атом серы группы C-S-К проявляет положительный мезомерный эффект, отрицательный заряд на нем меньше (-0,427), чем на атоме серы, связанном с атомом углерода двойной связью.
Ксантогенат-ионы в водных растворах образуют труднорастворимые соединения с катионами тяжелых металлов. Двухвалентная медь окисляет ксантогенат. При взаимодействии ксантогената с медью (II) в водном растворе образуется коричневый осадок соли двухвалентной меди, который быстро переходит в желтый осадок соли одновалентной меди (C2H5O—CS2)2Cu2.
В дитиокарбоматной группе содержатся группировки –N-C; C-S; C=S. Атом азота оттягивает электронную плотность на себя по индуктивному эффекту от атомов углерода с обеих сторон, однако неподеленная электронная пара азота входит в сопряженную систему N-C(S)-S (рис.5.7), электронная плотность смещается по мезомерному эффекту в сторону группы –C=S, за счет чего заряд на атоме азота составляет только -0,233. Атом серы, связанный двойной связью с атомом углерода, оттягивает электронную плотность на себя по индуктивному и мезомерному эффектам и приобретает заряд -0,476 (рис. 5.8). Атом серы группы -C-S-Na проявляет отрицательный индуктивный, но положительный мезомерный эффекты. Отрицательный заряд на нем ниже (-0,426).
Ионы диэтилдитиокарбомата в водных растворах также образуют труднорастворимые соединения с катионами тяжелых металлов.
Для молекулы 1,2-диацилгидразина C2H5-CO-NH-NH-CO-C2H5 обнаружены три ротамерные формы (вращательные изомеры), приведенные на рис. 5.10 в порядке понижения устойчивости.



Рис. 5.10. Ротамерные формы 1,2-диацилгидразина
Малликеновские заряды на атомах наиболее устойчивого конформера 1,2-диацилгидразина C2H5-CO-NH-NH-CO-C2H5 приведены в табл. 5.5.
Таблица 5.5
Малликеновские заряды на атомах наиболее устойчивого конформера 1,2-диацилгидразина C2H5-CO-NH-NH-CO-C2H5
C2H5-CO-NH-NH-CO-C2H5 |
-C(CH3) |
-C(CH2) |
O=(C) |
-N(H)- |
заряд на атоме |
-0,108 |
-0,119 |
-0,359 |
-0,046 |
Структура молекулы C2H5-CO-NH-NH-CO-C2H5 с указанием длины связей и зарядов на атомах показана на рис. 5.11, графическое представление орбитальной и электронной плотностей молекулярных орбиталей 1,2-диацилгидразина дано на рис. 5.12, проекции молекулярного электростатического потенциала – на рис. 5.13.

а)

б)
Рис. 5.11. Структура наиболее устойчивого конформера молекулы 1,2-диацилгидразина с указанием: а) - длины связей (Å), б) - зарядов на атомах

Проекции ВЗМО (HOMO) для диацилгидразина

Проекции НСМО (LUMO) для диацилгидразина
Рис. 5.12. Графическое представление орбитальной и электронной плотностей молекулярных орбиталей 1,2-диацилгидразина
Симметричная молекула 1,2-диацилгидразина содержит группы N-N и N-C=O. В сопряженной системе -N-C=O происходит перераспределение электронной плотности по индуктивному и мезомерному эффектам. Атом азота оттягивает на себя электронную плотность по индуктивному эффекту от атома углерода и одновременно проявляет положительный мезомерный эффект, направленный к атому кислорода, через углеродный атом, поэтому отрицательный заряд на атоме азота незначителен (-0,046). Атом кислорода в этой сопряженной системе, связанный двойной связью с атомом углерода, заряжен отрицательно (-0,359) за счет проявляемых отрицательных индуктивного и мезомерного эффектов. Атом углерода имеет частичный положительный заряд +0,238.

а)

б)
Рис. 5.13. Проекции молекулярного электростатического потенциала на плоскости (а) и в проекции 3d образов (б) устойчивого конформера 1,2-диацилгидразина
(зеленый – положительный, красный (а), синий (б) – отрицательный заряд)
Согласно проекциям МЕР (рис. 5.13), активные нуклеофильные центры хемосорбции молекулы 1,2-диацилгидразина сосредоточены на атомах кислорода карбонильных групп с эффективным зарядом qе(О) = -0,359. Однако следует учитывать, что в молекуле 1,2-диацилгидразина находится четыре донорных центра: два жестких - на атомах кислорода и два менее жестких - на атомах азота. Кроме того, наличие трёх ротамерных (вращательных изомеров) молекулы 1,2-диацилгидразина предполагает существование во флотационных системах нескольких комплексов «цинк-диацилгидразин» и «медь - диацилгидразин».
5.1.2. Квантово-химическая оценка возможности образования наиболее устойчивых систем «субстрат-реагент», способных к самосборке комплексов цинка и меди (II) на примере взаимодействия с 1,2 – диацилгидразином
Квантово-химический расчет возможных структур комплекса [Zn(H2O)5(DAH)]n+, где DAH - комплексообразующий фрагмент 1,2-диацил-гидразина показал, что для такого состава существуют две координационно-насыщенные структуры, в которых ион цинка проявляет координационное число 6. Первый комплекс [Zn(H2O)5(DAH)]2+, в котором лиганд присоединяется через одну карбонильную группу, характеризуется низким значением ∆N=0,385. Его пространственная структура и проекция 3d-образа МЕР представлены на рис. 5.14. Наблюдается образование одной водородной связи.

Н-связь

Рис. 5.14. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Zn(H2O)5(DAH)]2+ с указанием длины связей (Å) (зеленый цвет – положительный заряд)
Рассчитанное значение энергии комплексообразования составляет -16,88 ккал/моль. Образование комплекса происходит по схеме:
 .
.
Согласно проекции МЕР, для структуры [Zn(H2O)5(DAH)]2+, в которой лиганд присоединяется через одну карбонильную группу, во флотационной системе возможность самосборки в более крупные комплексные ассоциаты не наблюдается из-за отсутствия электростатического взаимодействия между образованными структурами, наличия всего одной внутримолекулярной водородной связи и низкого значения ∆Eкомп , равного -16,88 ккал/моль.
Второй комплекс [Zn(H2O)5(DAH)]+, в котором лиганд присоединяется через один из атомов азота гидразидной группы, характеризуется значением ∆N=0,503. Его пространственная структура и проекция 3d-образа МЕР представлены на рис. 5.15.

Н-связь
Н-связь
Н-связь

Рис. 5.15. Фрагмент пространственной структуры и проекция 3d-образа МЕР второго комплекса [Zn(H2O)5(DAH)]+ с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)
Рассчитанное значение энергии комплексообразования составляет -86,63 ккал/моль. Образование комплекса происходит по схеме:
 .
.
Согласно проекции МЕР, такая структура второго комплекса [Zn(H2O)5(DAH)]+ во флотационных системах характеризуется большей конформационной и термодинамической стабильностью во флотационной системе, благодаря высоким значениям ∆N, наличию трех водородных связей и ΔG<0. Возможность самосборки [Zn(H2O)5(DAH)]+ в более крупные полиассоциаты за счет электростатического взаимодействия между отдельными фрагментами структуры прослеживается, так как на проекция 3d-образа МЕР имеются положительно (фиолетовый цвет) и отрицательно (зелёный цвет) заряженные участки.
Расчет возможных структур комплекса [Zn(H2O)4(DAH)]n+ показал, что для такого состава существуют четыре координационно-насыщенные структуры, в которых ион цинка проявляет координационное число 6. Пространственная структура и проекция 3d-образа МЕР первого комплекса [Zn(H2O)4(DAH)]+, в котором лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, характеризующегося значением ∆N=0,403, представлены на рис. 5.16. Наблюдается наличие одной внутримолекулярной водородной связи.

Н-связь

Рис. 5.16. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Zn(H2O)4(DAH)]+ с указанием длины связей (Å) (зеленый цвет – положительный заряд)
Согласно проекции МЕР, первая структура комплекса [Zn(H2O)4(DAH)]+, в которой лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, во флотационной системе не имеет возможности для самосборки в супрамолекулярные комплексы из-за отсутствия электростатического взаимодействия между ассоциациями комплексов [Zn(H2O)4(DAH)]+, что наглядно видно на проекция 3d-образа МЕР (имеются только положительные участки - зелёный цвет). Рассчитанное значение энергии комплексообразования составляет -40,65 ккал/моль. Образование комплекса происходит по схеме:
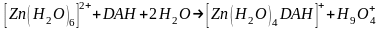 .
.
Пространственная структура и проекция 3d-образа МЕР второго комплекса [Zn(H2O)4(DAH)], в котором лиганд присоединяется через оба атома азота гидразидной группы, характеризующегося ∆N=0,425, представлены на рис. 5.17.
Согласно проекции МЕР, вторая структура комплекса [Zn(H2O)4(DAH)] во флотационных системах существовать может (ΔG<0), но вероятность самосборки [Zn(H2O)4(DAH)] в более крупные ассоциаты не прослеживается. Рассчитанное значение энергии комплексообразования составляет -50,74 ккал/моль. Образование комплекса происходит по схеме:
 .
.

Н-связь

Рис. 5.17. Фрагмент пространственной структуры и проекция 3d-образа МЕР второго комплекса [Zn(H2O)4(DAH)] с указанием длины связей (Å) (зелёный цвет – положительный заряд)
Расчет возможных структур комплекса [Zn(H2O)n(DAH)2] показал, что для такого состава существуют две координационно-насыщенные структуры. Пространственная структура и проекция МЕР комплекса [Zn(H2O)3(DAH)2], характеризующегося значением ∆N=0,545, в котором один лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, а второй - только через один из атомов азота гидразидной группы, представлены на рис. 5.18.
Комплексы [Zn(H2O)3(DAH)2] можно охарактеризовать как наиболее прочные и склонные к самосборке в супрамолекулярные полиассоциаты, благодаря возможности как электростатического взаимодействия (на проекции 3d-образа МЕР имеются как отрицательные, так и положительные участки) между образованными структурами, так и за счет образования 5 межмолекулярных водородных связей. Образование комплекса [Zn(H2O)3(DAH)2] конформационно и термодинамически обосновано (ΔG<<0).
Рассчитанное значение энергии комплексообразования составляет -99,31 ккал/моль. Образование комплекса происходит по схеме
 .
.

Н-связь
2 Н-связи

2 Н-связи


Рис. 5.18. Фрагмент пространственной структуры и проекция 3d-образа МЕР комплекса [Zn(H2O)3(DAH)2] с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)

Н-связь
Н-связь
Н-связь

Рис. 5.19. Фрагмент пространственной структуры и проекция 3d-образа МЕР комплекса [Zn(H2O)2(DAH)2] с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)
Пространственная структура и проекция МЕР комплекса [Zn(H2O)2(DAH)2], в котором оба лиганда присоединяются через одну карбонильную группу и один из атомов азота гидразидной группы, представлена на рис. 5.19. Комплекс [Zn(H2O)2(DAH)2] характеризуется наличием трёх водородных связей и может существовать во флотационных системах. Образование данной структуры во флотационной системе возможно (ΔG<0), наблюдается и определённая возможность самосборки [Zn(H2O)2(DAH)2] в супрамолекулярные комплексы. Однако более низкие значения ∆N [Zn(H2O)2(DAH)2], равное 0,460, в сравнении с ∆N [Zn(H2O)3(DAH)2] равным 0,545 не позволяют отнести данную структуру к наиболее стабильной.
Рассчитанное значение энергии комплексообразования составляет -69,33 ккал/моль. Образование комплекса происходит по схеме
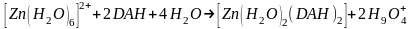 .
.
Расчет возможных структур комплекса [Zn(H2O)n(DAH)3] показал, что для такого состава возможна одна структура с n=0, в которой ион цинка проявляет координационное число 4. Пространственная структура и проекция МЕР комплекса [Zn(DAH)3], в котором один лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, а два других лиганда − через атомы азота гидразидной группы, изображена на рис. 5.20 при условии образования комплекса рН>11.


Рис. 5.20. Фрагмент пространственной структуры и проекция 3d-образа МЕР комплекса [Zn(DAH)3] с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)
Образование комплекса происходит по схеме
 .
.
Рассчитанное значение энергии комплексообразования составляет +4,53 ккал/моль. Такое значение энергии комплексообразования свидетельствует о невозможности самопроизвольного протекания данной реакции во флотационных системах в кислой среде. Однако при рН>11 депротонирование диацилгидразина будет протекать в большей степени, что приведёт к смещению равновесия в сторону образования комплекса.
Расчет возможных структур комплекса [Cu(H2O)5(DAH)]n+ показал, что для такого состава существуют две координационно-насыщенные структуры, в которых ион меди проявляет координационное число 6. Пространственная структура и проекция МЕР первого комплекса [Cu(H2O)5(DAH)]2+, в котором лиганд присоединяется через одну карбонильную группу, представлены на рис. 5.21.

Н-связь
Н-связь

Рис. 5.21. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Cu(H2O)5(DAH)]2+с указанием длины связей (Å) (зеленый – положительный заряд)
Образованную
структуру [Cu(H2O)5(DAH)]2+
можно охарактеризовать как не способную
к самосборке во флотационной системе
из-за отсутствия электростатического
взаимодействия между фрагментами
структуры, согласно проекции МЕР на
рис. 5.21, и незначительной энергетической
выгоде при образовании данной структуры:
рассчитанное значение энергии
комплексообразования составляет
-24,74
ккал/моль.
Образование комплекса происходит по
схеме: .
.
Пространственная структура и проекция МЕР второго комплекса состава [Cu(H2O)5(DAH)]+, характеризующегося степенью переноса заряда ΔN=0,547, в котором лиганд присоединяется через один из атомов азота гидразидной группировки, представлены на рис. 5.22.
Наличие пяти водородных связей вносит существенный вклад в общую энергетику образования металлокомплекса и обеспечивает устойчивость комплекса во флотационной системе, рассчитанная энергия комплексообразования составляет -92,18 ккал/моль.

Н-связь
Н-связь
2 Н-связи
Н-связь


Рис. 5.22. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Cu(H2O)5(DAH)]+с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)
Структура комплекса [Cu(H2O)5(DAH)]+ характеризуется хорошей способностью для самосборки в супермолекулы во флотационной системе, благодаря электростатическому взаимодействию между фрагментами структуры, наличием 5 водородных связей, ΔN=0,547 и ΔG<<0. Схема процесса комплексообразования:
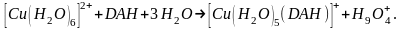
Расчет возможных структур комплекса [Cu(H2O)4(DAH)]n+ показал, что для такого состава существуют две координационно-насыщенные структуры, в которых ион меди также проявляет координационное число 6. Пространственная структура и 3d-проекции МЕР первого комплекса [Cu(H2O)4(DAH)]2+, характеризующегося значением ΔN=0,465, в котором лиганд присоединяется через обе карбонильные группы, представлены на рис. 5.23.

Н-связь
Н-связь

Рис. 5.23. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Cu(H2O)4(DAH)]2+ с указанием длины связей (Å) (зеленый цвет – положительный заряд)
Согласно проекции МЕР, структура [Cu(H2O)4(DAH)]2+ во флотационных системах может существовать (ΔG<0), но вероятность самосборки комплекса [Cu(H2O)4(DAH)]2+ в более крупные ассоциаты не прослеживается из-за отсутствия электростатического взаимодействия между фрагментами структуры и невысокого значения энергии комплексообразования, равного
-11,24 ккал/моль.
Схема процесса комплексообразования:

Пространственная структура и проекция МЕР второго комплекса [Cu(H2O)4(DAH)], характеризующегося ΔN=0,476, в котором лиганд присоединяется через оба атома азота гидразидной группировки, представлены на рис. 5.24.
Структура второго комплекса характеризуется несколько большей стабильностью в сравнении с первым комплексом, т.к. энергия комплексообразования выше и составляет в данном случае -59,63 ккал/моль.
Схема процесса комплексообразования:


Н-связь
Н-связь

Рис. 5.24. Фрагмент пространственной структуры и проекция 3d-образа МЕР второго комплекса [Cu(H2O)4(DAH)] с указанием длины связей (Å)
(зеленый цвет – положительный заряд)

2 Н-связи
3 Н-связи



Рис. 5.25. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Cu(H2O)3(DAH)2] с указанием длины связей (Å) (зеленый – положительный, синий – отрицательный заряд)
Во флотационных системах обнаружено существование двух видов комплекса [Cu(H2O)3(DAH)2], в котором один лиганд присоединяется через карбонильную группу и атом азота, а второй - только через атом азота. Пространственная структура и проекция МЕР первого комплекса [Cu(H2O)3(DAH)2], характеризующегося ΔN=0,686, представлены на рис. 5.25.
На проекции 3d-образа МЕР просматривается возможность самосборки комплексов в супрамолекулярные структуры благодаря электростати-ческому взаимодействию (имеются как отрицательные, так и положительные участки); кроме того, образование данной структуры термодинамически выгодно (ΔG<<0). Прочность комплекса обусловлена наличием пяти водородных связей и высокими значениями ΔN. Рассчитанное значение энергии комплексообразования составляет -123,30 ккал/моль. Схема процесса комплексообразования:

Пространственная структура второго комплекса состава [Cu(H2O)3(DAH)2]-, в котором один лиганд присоединяется через оба атома азота, а второй - только через один атом азота гидразидной группы, представлена на рис. 5.26 при условии образования комплекса рН>11.

Н-связь

Рис. 5.26. Фрагмент пространственной структуры и проекция 3d-образа МЕР второго комплекса [Cu(H2O)3(DAH)2]- с указанием длины связей (Å)
(зеленый – положительный, синий – отрицательный заряд)
Схема процесса комплексообразования:

Согласно расчётам, ΔG>0, следовательно, такая структура комплекса [Cu(H2O)3(DAH)2]- самопроизвольно во флотационных системах существовать не может. Рассчитанное значение энергии комплексообразования составляет +49,66 ккал/моль.
Образование комплекса [Cu(H2O)3(DAH)2]- по вышеприведенной схеме возможно только при рН>11, когда депротонирование диацилгидразина значительно и равновесие смещено в сторону образования комплекса.
Расчет возможных структур комплекса [Cu(H2O)2(DAH)2] привел к двум координационно-насыщенным структурам, в которых ион меди проявляет координационное число 6. Пространственная структура и проекция МЕР первого комплекса [Cu(H2O)2(DAH)2], характеризующегося ΔN=0,447, в котором оба лиганда присоединяются через карбонильную группу и атом азота, представлены на рис. 5.27.

3 Н-связи


Рис. 5.27. Фрагмент пространственной структуры и проекция 3d-образа МЕР первого комплекса [Cu(H2O)2(DAH)2] с указанием длины связей (Å) (зеленый – положительный заряд)
Образованная структура [Cu(H2O)2(DAH)2] во флотационной системе может существовать, но характеризуется небольшой энергией комплексообразования, составляющей -40,82 ккал/моль.
Схема процесса комплексообразования:

Пространственная структура и проекция МЕР комплекса [Cu(H2O)2(DAH)2]2-, в котором оба лиганда присоединяются через два атома азота, представлена на рис. 5.28. Величина рассчитанной энергии комплексообразования структуры [Cu(H2O)2(DAH)2]2- равна +239,8 ккал/моль, ΔG >> 0, образование его во флотационной системе невозможно.

Н-связь

Рис. 5.28. Фрагмент пространственной структуры и проекция 3d-образа МЕР второго комплекса [Cu(H2O)2(DAH)2]2- с указанием длины связей (Å)
Анализ представленных результатов квантово-химических исследований позволяет сделать заключение, что с наибольшей вероятностью во флотационных системах «цинк - реагент DAН» и «медь - реагент DAН» находятся наиболее конформационно устойчивые и энергетически выгодные структуры, способные к самосборке DAН с Zn2+и Cu2+:
- комплекс [Zn(H2O)3(DAH)2], в котором один лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, а второй - только через один из атомов азота гидразидной группы, характеризующийся ∆Eкомп=-99,31 ккал/моль, ΔN=0,545 и наличием пяти водородных связей;
- комплекс [Zn(H2O)5(DAH)]+, в котором лиганд присоединяется через один из атомов азота гидразидной группы, ∆Eкомп=-86,63 ккал/моль, ΔN=0,503 и три водородные связи.
- комплекс [Cu(H2O)3(DAH)2], в котором один лиганд присоединяется через карбонильную группу и атом азота, а второй - только через атом азота гидразидной группы, характеризующийся ∆Eкомп=-123,30 ккал/моль, ΔN=0,686 и наличием пяти водородных связей.
- комплекс [Cu(H2O)5(DAH)]+, в котором лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы - ∆Eкомп=-92,18 ккал/моль, ΔN=0,547, пять водородных связей.
Следовательно, квантово-химические расчёты МЕР, ∆N, ∆Eкомп, число водородных связей и моделирование флотационных систем «субстрат-реагент» позволяют выявлять наиболее энергетически выгодные и конформационно устойчивые структуры с учётом возможности самосборки в супрамолекулярные комплексы (полиассоциаты) и являются важными компонентами прогнозирования свойств реагентов.
