
- •Химическая связь
- •Сущность химической связи
- •Методы описания связи
- •Характеристика ковалентной связи
- •Насыщаемость связи
- •Общие правила определения числа валентных электронов
- •Составление формул химических соединений на основании степени окисления
- •Полярность – поляризуемость связи
- •Направленность связи. Строение молекул
- •Химическая связь в твердых веществах и жидкостях
- •4.5. Межмолекулярное взаимодействие
Химическая связь
Сущность химической связи
Многообразие химических соединений, их свойства зависят от состава и строения вещества. Поэтому учение о химической связи – центральная проблема современной химии.
В образовании химической связи участвуют атомные ядра и электроны. Взаимодействие между ними носит в основном электрический характер. Согласно квантово-механическим представлениям можно говорить только о вероятном нахождении электронов в поле атомных ядер. Данному пространственному расположению атомных ядер отвечает определенное расположение электронной плотности. Чтобы описать химическую связь, необходимо выяснить, как распределяется электронная плотность в системе атомов, образующих молекулу.
Современные методы исследования позволяют точно описать химическую связь в молекуле водорода. Для систем с большим числом ядер и электронов даются приближенные расчеты. Точность таких расчетов оценивается экспериментальными данными о свойствах данного вещества.
Химическая связь едина, т.к. образуется путем перекрывания электронных облаков.
В зависимости от распределения электронной плотности в веществе различают ковалентную, металлическую, водородную и ионную типы связи. В чистом виде они существуют редко.
Современная наука рассматривает образование связи как процесс, при котором общая энергия системы взаимодействующих атомов уменьшается. Энергия, которая выделяется при образовании молекул, называется энергией связи. Эта энергия требуется для разрыва связей в молекуле.
Например, энергия связи в молекуле водорода равна 435 кДж/моль, энергия связи в молекуле азота – 940 кДж/моль. Следовательно, для разрыва связей в молекуле азота N2 требуется больше энергии и поэтому данная молекула более прочная.
Методы описания связи
Для описания связей используют различные методы. Наиболее распространены метод молекулярных орбиталей (МО) и метод валентных связей (ВС).
Метод молекулярных орбиталей. При перекрывании АО образуется молекулярная орбиталь. МО – орбитали, на которых располагаются электроны в молекуле. Они описываются также с помощью квантовых чисел.
Молекулярные орбитали отличаются от атомных орбиталей формой, размерами. МО охватывают пространство нескольких ядер.
Пример образования молекулы водорода:
МО
А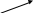
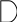
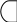 О АО разрыхляющая
1sразр.
О АО разрыхляющая
1sразр.
 +
+
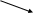

1s1 1s1 связующая 1sсв.
-
Метод валентных связей. В основе данного метода лежит предположение, что каждая пара атомов в молекуле удерживается одной или несколькими парами электронов. При этом происходит перекрывание атомных орбиталей (А.О.) взаимодействующих атомов.
Прочность связи зависит от степени перекрывания А.О. Поэтому связь образуется в том направлении, в котором это перекрывание максимально.
По теории валентных связей химическая связь локализована и может обозначаться черточками, парами электронов в виде точек и перекрыванием А.О.
Пример. Структурная формула молекулы водорода Н – Н.
Электронная формула Н : Н.
Перекрывание А.О.

s s s p p p
