
- •Физическая и коллоидная химия
- •Выбор варианта задач для решения
- •Физическая химия
- •Тема 1. Агрегатное состояние вещества.
- •Вопросы для самопроверки
- •Тема 2. Химическая термодинамика и термохимия
- •Задание 2 к контрольной работе
- •Тема 3. Химическая кинетика и катализ
- •Задание 3 к контрольной работе
- •Тема 4. Химическое равновесие
- •Задание 4 для контрольной работы
- •Тема 5. Растворы неэлектролитов
- •Вопросы для самоконтроля
- •Концентрация растворов
- •Задание 5 к контрольной работе
- •Тема 6. Растворы электролитов
- •Задание 6 для контрольной работы
- •Тема 7. Электрохимия Основные вопросы по теме
- •Вопросы для cамоконтроля
- •Задание 7 к контрольной работе
- •Тема 8. Поверхностные явления в дисперсных системах
- •Задание 8 к контрольной работе
- •Тема 9. Дисперсные системы
- •Задание 9 к контрольным работам
- •Тема 10 микрогетерогенные системы. Высокомолекулярные соединения Основные вопросы по теме
- •Вопросы для самоконтроля
- •Набухание и растворение высокомолекулярных веществ
- •Задание 10 к контрольной1 работе
- •Некоторые физические постоянные
- •& Основная литература
- •¨ Дополнительная литература
- •Примерные затраты учебного времени при самостоятельной работе по темам и на выполнение контрольной работы в часах:
- •Часть 1. Физическая химия
- •Часть 2. Коллоидная химия
- •Физическая и коллоидная химия
Тема 3. Химическая кинетика и катализ
Основные вопросы по теме
1.Скорость и константа скорости химической реакции.
2. Зависимость скорости реакции от концентрации.
3. Кинетические уравнения для реакций первого и второго порядка.
4. Период полураспада.
5. Зависимость скорости реакции от температуры.
6. Правило Вант – Гоффа.
7. Уравнение Аррениуса.
8. Энергия активации.
9. Понятие о катализе. Виды катализа.
Зависимость скорости реакции от концентрации и температуры
Зависимость скорости реакции от концентрации выражается законом действия масс (см. тему 3).
Зависимость скорости реакции от
температуры (правило Вант – Гоффа):
V2 =
V1 ![]()
где V1 – скорость
реакции при t1![]() ;
;
V2 – скорость реакции при t2 ;
γ – температурный коэффициент реакции.
Более точно и в более широком интервале температур (уравнение Аррениуса):
V2 = V1
![]()
где V1 – скорость реакции при температуре Т1, в градусах К.
Вопросы для самоконтроля
1. Как изменяется концентрация реагирующих веществ во времени?
Приведите графическую зависимость.
2. Как скорость химической реакции зависит от концентрации
реагирующих веществ?
3. Каков физический смысл константы скорости химической реакции?
4. Рассмотрите зависимость скорости реакции от температуры
(уравнение Аррениуса). Поясните смысл величин, определяющих
эту зависимость.
5. Дайте определение молекулярности и порядка реакции.
6. Что такое «энергия активации»?
7. Как влияет катализатор на энергию активации?
8. Недостатки теории Аррениуса?
9. Какие типы химических реакций вы знаете?
Примеры решения задач
Задача 1
Как изменится скорость прямой и обратной реакции
3Н2 + N2
![]() 2NH3
2NH3
a) приувеличении давленияв 4 раза;
б) при уменьшении давленияв 2 раза?
Решение:
а) записываем закон действия масс для прямой и обратной реакции при исходных условиях:
V1
= k1
⋅
![]()
![]() , V2=
k2
⋅
, V2=
k2
⋅
![]()
При увеличении давленияв 4 раза:
![]() = k1
(
= k1
(![]() )3
(
)3
(![]() ),
),
![]() =
k2
(
=
k2
(![]() ),
),
Найдем отношение ![]() и
и ![]() :
:
=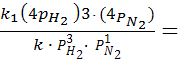
 =256;
=256;
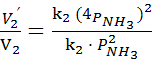 =
= 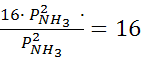
Ответ. При увеличении давленияв 4 раза скорость прямой реакции увеличится в 256 раз, обратной в 16 раз.
б) V1 = k1 ⋅ , V2= k2 ⋅
При уменьшении давления
![]()
![]() =
= ![]() .
.
Найдем отношение ![]() и
и ![]() :
:
= 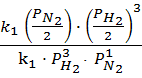 =
= 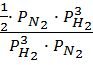 =
= ![]() ;
;
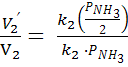 =
= 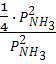 =
= ![]() .
.
Ответ. При уменьшении давленияв 2 раза скорость прямой реакции уменьшитсяв 16 раз, а обратной – в 4 раза.
Задача 2
Во сколько раз изменится скорость реакции:
а) при увеличении температуры на 400С;
б) при уменьшении температуры на 200С, если температурный коэффициент реакции γ = 2?
Решение
Запишем правило Вант – Гоффа: V2
= V1 ![]()
Найдем отношение ![]() ,
,
![]() =
=
![]()
а) ∆t = + 400 , γ = 2:
![]() = 16
= 16
Ответ. При увеличении температуры на 40 С скорость реакции
увеличилась в 16 раз;
б) ∆t =
![]() 200 , γ = 2:
200 , γ = 2:
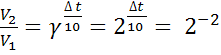 =
= ![]() =
= ![]() .
.
Ответ. При уменьшении температуры на 200С скорость реакции
уменьшилась в 4 раза.
При сжатии системы в n раз давление увеличивается в n раз.
При увеличении объема в n раз давление уменьшается в n раз.
