
- •Физическая и коллоидная химия
- •Выбор варианта задач для решения
- •Физическая химия
- •Тема 1. Агрегатное состояние вещества.
- •Вопросы для самопроверки
- •Тема 2. Химическая термодинамика и термохимия
- •Задание 2 к контрольной работе
- •Тема 3. Химическая кинетика и катализ
- •Задание 3 к контрольной работе
- •Тема 4. Химическое равновесие
- •Задание 4 для контрольной работы
- •Тема 5. Растворы неэлектролитов
- •Вопросы для самоконтроля
- •Концентрация растворов
- •Задание 5 к контрольной работе
- •Тема 6. Растворы электролитов
- •Задание 6 для контрольной работы
- •Тема 7. Электрохимия Основные вопросы по теме
- •Вопросы для cамоконтроля
- •Задание 7 к контрольной работе
- •Тема 8. Поверхностные явления в дисперсных системах
- •Задание 8 к контрольной работе
- •Тема 9. Дисперсные системы
- •Задание 9 к контрольным работам
- •Тема 10 микрогетерогенные системы. Высокомолекулярные соединения Основные вопросы по теме
- •Вопросы для самоконтроля
- •Набухание и растворение высокомолекулярных веществ
- •Задание 10 к контрольной1 работе
- •Некоторые физические постоянные
- •& Основная литература
- •¨ Дополнительная литература
- •Примерные затраты учебного времени при самостоятельной работе по темам и на выполнение контрольной работы в часах:
- •Часть 1. Физическая химия
- •Часть 2. Коллоидная химия
- •Физическая и коллоидная химия
Тема 2. Химическая термодинамика и термохимия
Основные понятия термодинамики
Предмет термодинамики. Окружающий нас мир представляет собой различные формы движущейся материи. Мерой движения материи является энергия, проявляющаяся в различных ее видах. Взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы, изучает термодинамика. Применение термодинамики к химическим процессам составляет предмет химической термодинамики, которая изучает превращение различных видов энергии при химических реакциях, процессах растворения, испарения, кристаллизации и др.
Зная законы химической термодинамики, можно предсказать, возможна ли данная реакция при данных условиях или нет, и при каких условиях она станет возможной, каков будет выход продуктов реакции, т. е. какова степень превращения исходных веществ в конечные, каким тепловым эффектом она будет сопровождаться. Энергетическая сторона химических процессов имеет важное значение, так как выделяющееся при этом тепло позволяет использовать реакции горения газообразного, жидкого и твердого топлива в качестве источника тепловой энергии. Кроме того, данные об энергетических эффектах реакций используются для определения прочности межатомных и межмолекулярных связей, для выяснения строения и реакционной способности химических соединений и т. д.
Термодинамические системы. Системой называется тело или группа тел, выделенных фактически или мысленно из окружающей среды. Системой может быть газ в баллоне, стакан чая, кристалл сахара и т. п. Особенность систем, рассматриваемых в термодинамике, заключается в том, что они состоит из большого числа частиц — молекул или атомов. К отдельным молекулам, атомам или элементарным частицам законы термодинамики не применимы.
Фазой называется совокупность всех однородных частей системы, обладающих одинаковыми свойствами и отделенных от остальных частей системы поверхностью раздела. Например, жидкая вода представляет собой одну фазу, а система «жидкая вода — лед» содержит две фазы, которые хотя и обладают одинаковым химическим составом, но различаются по свойствам (по внутреннему строению, плотности и др.) и имеют поверхность раздела.
Все термодинамические системы можно разделить на две большие группы — гомогенные и гетерогенные. Гомогенными (однофазными) называются системы, состоящие только из одной фазы, например воздух — смесь газов, раствор поваренной соли и сахара в воде. Здесь между составными частями систем отсутствует поверхность раздела.
Системы, содержащие две или большее число фаз, называются гетерогенными (разнофазными, неоднородными). Например, лед, вода и находящийся над ними пар образуют гетерогенную систему, состоящую из трех фаз: твердой (лед), жидкой (вода) и газообразной (водяной пар); нерастворившиеся кристаллы поваренной соли в воде образуют гетерогенную систему из двух фаз и т. д. В гетерогенной системе составные ее части— фазы — разделены поверхностью раздела.
Термодинамическая система может быть открытой, закрытой и изолированной. Система, которая может обмениваться веществом с окружающей средой, называется открытой, например сосуд с кипящей водой. Для закрытой системы невозможен обмен веществом с окружающей средой, например газ, находящийся в баллоне. Пели, наконец, невозможен обмен ни веществом; ни энергией, такая система называется изолированной. Примером может служить запаянная ампула, полностью полированная от внешней среды.
Параметры и процессы. Физические величины, позволяющие определить состояние системы, называются параметрами состояния. В химии чаще используются следующие параметры: объем, давление, температура и концентрация. Параметры состояния, поддающиеся непосредственному изменению, принято считать основными. К ним относят температуру Т, давление р, молярный объем V, концентрацию С. Другие параметры, зависящие от основных, являются функциями основных параметров и называются функциями состояния.
Совокупность параметров определяет состояние системы. Математическое выражение, показывающее взаимозависимость основных параметров данной системы, называется уравнением состояния. Примером может служить уравнение состояния идеального газа: pV=RT.
Энергия, теплота, работа. Важнейшими взаимосвязанными понятиями в термодинамике являются энергия, теплота и работа. Энергия — это мера способности тела совершать работу. Из различных форм энергии для характеристики процессов особенно важное значение имеет внутренняя энергия системы. Любая система, независимо от того, в каком состоянии она находится, всегда обладает определенным запасом энергии. Внутренняя энергия системы представляет собой ее полную энергию, которая складывается из энергии движения молекул, атомов, ядер и электронов в молекулах и атомах, внутриядерной энергии, энергии межмолекулярного взаимодействия и т. п.
Внутренняя энергия системы зависит от природы составляющих ее веществ, их массы и внешних условий. Абсолютное значение внутренней энергии в какой-либо системе измерить невозможно, однако опытным путем удается определить изменение внутренней энергии системы при переходе ее из одного состояния в другое. Изменение внутренней энергии U системы при любом процессе не зависит от пути этого процесса, а зависит лишь от начального и конечного состояния системы. Следовательно, внутренняя энергия является функцией состояния системы. В отличие от внутренней энергии теплота и работа не являются функциями состояния, так как они представляют собой разные формы передачи энергии. Поэтому теплота и работа могут быть отнесены только к процессу, а не к состоянию. Работа А, совершаемая системой, обусловлена взаимодействием между системой и внешней средой, в результате чего преодолеваются внешние силы, нарушившие равновесие в системе. Например, газ, расширяясь и цилиндре с поршнем, может сжимать пружину и таким образом передавать ей часть энергии. Следовательно, работа является макрофизической формой передачи энергии от системы к системе.
Другой формой передачи энергии является теплота Q, в этом случае энергия непосредственно передается молекулами одного тела молекулам другого при их контакте. Такой обмен происходит между телами, имеющими различную температуру.
Поскольку теплота и работа в количественном отношении являются мерой передаваемой энергии, то количество их измеряется в тех же единицах, что и энергия, — в джоулях (Дж).
Часто говорят, что теплота (или работа) подводится к системе или отводится от нее. Однако это не совсем строгое выражение, и, употребляя его, не следует забывать, что подводится и отводится не теплота или работа, а энергия в форме теплоты или работы. Если система обменивается энергией с окружающей средой, то в какой бы форме это ни происходило, количество энергии, полученное системой, обозначается знаком. «+», а количество энергии, отданное системой, знаком «—». Например, если система получила энергию в форме теплоты, то это можно обозначить + Q, а если система отдала теплоту, то — Q.
Работа расширения А идеального газа описывается уравнением
А =
![]() ,
( 1.1
)
,
( 1.1
)
Р – давление, V1 – начальный объем, V2 –конечныйобъем.
Изучая зависимость объема V данной массы газа от давления р, Бойль (Англия) и Мариотт (Франция) независимо друг от друга открыли следующий закон: объем данной массы газа при постоянной температуре обратно пропорционален давлению, под которым газ находится,
что можно записать уравнением
p1V1 = p2V2 = k ( 1.2 )
где k — постоянная величина.
Таким образом, из закона Бойля — Мариотта вытекает, что произведение объема газа на давление при данной температуре есть величина постоянная.
Зависимость объема газа от температуры. Как и все тела, газы при нагревании расширяются, причем весьма заметно даже при незначительном нагревании. Исследуя тепловое расширение газов, французский ученый Гей-Люссак установил, что для данной массы идеального газа объем при постоянном давлении прямо пропорционален абсолютной температуре. Этот закон получил название закона Гей-Люссака:
V=kT (1.3 )
где V — объем газа; Т — абсолютная температура, К (К —градусы в шкале Кельвина, 1К=273 + °С); k — константа.
Нормальными называют условия, когда температура равна 0° С (273 К) и давление составляет 1 атм, или 760 мм рт. ст. (101 325 Па). При этих условиях, как следует из закона Авогадро, 1 моль газа занимает объем 22,4 л (а 1 кмоль — 22,4 м3). Число молекул, содержащихся в 1 моле, называется постоянной Авогадро: NA = 6,02ּ1023 (в СИ 6,02ּ1026)
Зависимость давления газа от температуры. Нагревая газ в закрытом сосуде, по манометру можно заметить, что давление газа увеличивается. Зависимость давления газа от температуры при постоянном объеме выражается следующим законом: для данной массы идеального газа давление при постоянном объеме прямо пропорционально абсолютной температуре:
p = кТ, (1.4 )
где р — давление газа; Т — абсолютная температура; k — константа.
Этот закон по имени французского ученого, открывшего его, называется законом Шарля.
Объединенное уравнение состояния идеального газа. Мы рассмотрели состояния газов, когда одна из трех величин, характеризующих эти состояния (объем, давление или температура), не меняется. Например, если не меняется температура, то давление и объем газа связаны друг с другом законом Бойля — Мариотта. При постоянном давлении объем газа меняется с изменением температуры по закону Гей-Люссака и, наконец, при постоянном объеме давление газа меняется с изменением температуры по закону Шарля.
Однако нередки процессы, когда одновременно меняются все три параметра, характеризующих состояние газа. Соотношение, которое одновременно связывает между собой значения давления, объема и температуры (р, V и T), называется уравнением состояния идеальных газов:
PV = ![]() RT (1.5)
RT (1.5)
Уравнение ( ) называется уравнением Клапейрона— Менделеева.
Уравнением Клапейрона — Менделеева пользуются при расчетах различных параметров, характеризующих газ или его состояние: давления р, объема V, температуры T, массы т или молекулярной массы М.
Чтобы пользоваться уравнением Клапейрона — Менделеева, необходимо найти значение универсальной газовой постоянной R.
В Международной системе единиц (СИ) R = 8,313 103 Дж/(град-моль).
В зависимости от условий уравнение (1.1) принимает различный вид:
Р – const, изобарное расширение:
A = p (V2 – V1) (1.6)
Т – const, изотермическое расширение:
А = , находим p из уравнения; в
p
= ![]()
![]() и подставляем
( 1.1 )
и подставляем
( 1.1 )
А
= ![]()
![]() RT ln
RT ln![]() (1.7)
(1.7)
При Т – const P1V1 = RT = P2V2 (закон Бойля-Мариотта), т.е.
![]() =
= ![]() ,
подставим в (1.7):
,
подставим в (1.7):
А =
RT ln![]() (1.8)
(1.8)
Количество теплоты Q, необходимое для нагрева тела, зависит от
условий:
V – const,
QV = CV (T2 −T1 ) (1.9)
где СV – изохорная теплоемкость (количество теплоты, которое надо затратить для нагревания одного моля вещества на один градус при постоянном объеме).
2. P – const:
QP = CP (T2 −T1 ) (1.10)
где Cp – изобарная теплоемкость (количество теплоты, которое необходимо затратить на нагревание одного моля вещества на один градус при постоянном давлении).
Для одноатомного газа
С = ![]() и СP - CV
= R (1.11)
и СP - CV
= R (1.11)
Для молекул, состощих из двух атомов СV
= ![]() ;
;
Для молекул, состощих из трех атомов СV = 3R.
Если при нагревании (или охлаждении) происходит фазовый переход
(замерзание, плавление, испарение, конденсация), то это необходимо учитывать,
Qф.п
=![]() λ,
(1.12)
λ,
(1.12)
где λ – теплота фазового перехода;
Qф.п – теплота фазового перехода.
Основные положения термодинамики даются в форме трех ее законов (начал). Первый закон (первое начало) термодинамики вытекает из закона сохранения энергии. Согласно этому закону энергия не исчезает бесследно и не возникает из ничего, а лишь переходит из одной формы в другую в строго эквивалентных количествах.
Первое начало термодинамики устанавливает соотношение между теплотой Q и работой А при изменении общего запаса энергии системы. Изменение внутренней энергии системы может происходить при поглощении или выделении теплоты или при совершении работы системой или над системой. При поглощении системой некоторого количества теплоты внутренняя энергия системы увеличивается, если же в результате этого изменяется объем системы, то совершается работа по изменению объема.
Имеется несколько формулировок первого закона термодинамики, однако все они отражают неуничтожимость и эквивалентность энергии при переходе различных видов ее друг в друга:
1. В изолированной системе сумма всех видов энергии есть величина постоянная.
2. Невозможно создать вечный двигатель первого рода, так как невозможно создать машину, которая производит работу без подведения энергии извне.
Первое начало термодинамики имеет огромное философское значение, ибо, утверждая неуничтожимость энергии, оно тем самым обосновывает и неуничтожимость материи, поскольку энергия без материи существовать не может.
Первое начало термодинамики выражается уравнением
Q = ΔU + A , (1.13 )
где ∆U – изменение внутренней энергии.
1. p-const ∆U = Q - A;
2. V-const ∆U = Q.
Для растворов концентрация С:
C = ![]() или V =
или V = ![]() , ( 1.14)
, ( 1.14)
где V – объем.
Долгое время было принято считать
тепловые эффекты реакций, проходящих
с выделением теплоты, положительными,
а с поглощением теплоты — отрицательными,
обозначая их соответственно + Q и – Q.
В настоящее время в термохимии для
единообразия с термодинамикой тепловые
эффекты реакции обозначают через
![]() подчеркивая
этим, что тепловой эффект вызван
изменением параметров системы. Поэтому
и говорят обычно не о тепловом эффекте,
а об изменении энтальпии . Разумеется,
если в ходе реакции теплота выделяется
(+Q), то энтальпия при этом уменьшается
(-), и наоборот, если в ходе процесса
теплота поглощается (—Q), то энтальпия
системы увеличивается. Таким образом,
энтальпия связана с тепловым эффектом
реакции зависимостью: Qp
=
подчеркивая
этим, что тепловой эффект вызван
изменением параметров системы. Поэтому
и говорят обычно не о тепловом эффекте,
а об изменении энтальпии . Разумеется,
если в ходе реакции теплота выделяется
(+Q), то энтальпия при этом уменьшается
(-), и наоборот, если в ходе процесса
теплота поглощается (—Q), то энтальпия
системы увеличивается. Таким образом,
энтальпия связана с тепловым эффектом
реакции зависимостью: Qp
= ![]() .
Разумеется, если в ходе реакции теплота
выделяется (+Q), то энтальпия при этом
уменьшается (-), и наоборот, если в ходе
процесса теплота поглощается (—Q), то
энтальпия системы увеличивается. Таким
образом, энтальпия
.
Разумеется, если в ходе реакции теплота
выделяется (+Q), то энтальпия при этом
уменьшается (-), и наоборот, если в ходе
процесса теплота поглощается (—Q), то
энтальпия системы увеличивается. Таким
образом, энтальпия
тепловому эффекту реакции с обратным знаком.
Энтальпия по определению
H= U + pV. (1.15 )
Примеры решения задач
Задача 1
Найти работу расширения 10 г азота от объема 6 м3 до 40 м3 при постоянной температуре, равной 250С.
Решение:
Используем соотношение ( 1.7), так как T – const и изменяется объем:
A=
![]() RT
ln
RT
ln
![]()
Обязательно все данные задачи должны быть в одной системе единиц, (как правило, используйте СИ). Для перевода используем таблицу из приложения (см. с. 63).
m N 2 = 1·10-2 кг, М= 2,8 · 10-2 кг/кмоль, Т= 273 + 25 = 298К,
где М – масса одного моля.
Моль – количество вещества, выраженное в граммах и численно равное атомной или молекулярной массе.
Для азота (N2) атомная масса А = 14, следовательно, М = 2 ·14 г = 28 г,
так как молекула азота состоит из двух атомов. В системе СИ m – в кг,
поэтому М в кг/кмоль и R = 8,31 · 103 Дж/ кмоль · град.
2,303 lgA = ln A – соотношение между натуральным и десятичным
логарифмом числа:
A
= ![]() ln
ln
![]() = 24763,8 ⋅
2,303 ⋅
lg
6,67 = 46993,6 = 4,710
4
= 24763,8 ⋅
2,303 ⋅
lg
6,67 = 46993,6 = 4,710
4
Размерность A =
![]()
Задача 2
Какая работа будет совершена 5 кг метана при повышении температуры на 500С и постоянном давлении.
Решение
Из условия задачи P – const, поэтому используем уравнение:
A = p (V2 − V1 ) = p V2 − p V1
Из уравнения: РV2 =
![]() RТ2, РV1 =
RТ1
RТ2, РV1 =
RТ1
A= R (T2 − T1) ;
m = 5 кг, М=16 кг/кмоль (см. задачу 1.)
Т – Т = ∆ Т = 50 К (величины К и °С одинаковы, поэтому ∆Т в К = ∆ °С);
A
= ![]() = 1,3
10 5
= 1,3
10 5
Размерность A
= 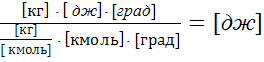
Задача 3
Найти работу изобарического расширения аргона от 2 л до 3 л под давлением 30 Па.
Решение
Из условия задачи p – const . Поэтому используем формулу (1.3):
A = p (V2 – V1 ) .
Переводим данные задачи в систему СИ:
2 л = 2 · 10-3 м, 3 л = 3 · 10-3 м3, 1 ПА = Н/м2, 30 ПА = 30 Н/м2.
А = 30 (3·10-3 - 2·10-3) = 30 · 10-3 = 0,03.
Размерность [Н · м--2 ] · [м3] = [Н] · [м] = [дж].
Задача 4
Найти работу, полученную при изотермическом расширении 100 г
азота при изменении давления от 3·105 Па до 2·105 Па при температуре 70 °С.
Решение
Из условия задачи T – const и меняется давление, поэтому используем формулу 1.5:
A=
RT
ln
![]()
m = 0,1 кг, М= 28 кг/кмоль, T = 273 + 70 °С = 343,
R = 8,31·103 Дж/кмоль·град,
р1 = 3·105 Па = 3 ·105 Н/м2, p2 = 2 · 105 Па (Н/м2),
A
= ![]() lg
lg
![]() = 4126
= 4126
Размерность A =
Задача 5
10 л кислорода, взятого при нормальных условиях, нагревают до
2000С при постоянном объеме. Определить количество теплоты, затраченное на нагревание.
Решение
По условию V = const, поэтому используем формулу (1.6):
QV
=
CV (T2
−T1 ), Сv
= ![]() R, так как молекула
кислорода двухатомная.
R, так как молекула
кислорода двухатомная.
Следствие из закона Авогадро. Один моль любого газа при нормальных условиях (00С или 273 К, р = 1 атм или 760 мм. рт. ст. или 1,013·105 Н/м2) занимает объем, равный 22,4 л.
Поэтому ![]() =
= 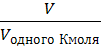 ;
;
T1 = 273 K; T2 = 473 K; Сv = R; 10 л = 1 · 10-2 м3; 1 кмоль = 22,4 м3.
Q =
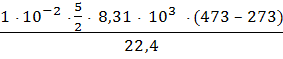 = 1855.
= 1855.
Размерность Q =
Задача 6
3 кг неона нагреваются при постоянном давлении. Найти изменение энтальпии, если температура повысилась на 1000С:
ΔH = Q p = Cp (T2 −T1 ) из формулы (1.7),
из формулы (1.8): Cp = CV
+ R = ![]() R, так как неон подчиняется
законам
R, так как неон подчиняется
законам
идеального газа: Т2 – Т1 = ∆Т = ∆0С = 100 К,
ΔH =
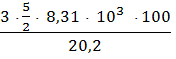 =
3,085
105
=
3,085
105
Размерность ΔH = .
Задача 7
Найти изменение внутренней энергии при испарении 10 г ртути и
давлении 1,013·105 Па. Температура кипения ртути – 3570 С. Теплота паро
образования – 1,29·105 Дж/кмоль.
Решение
По условию p – const . Из формулы (1.12) H = U+ pV , ∆U = ∆H – p∆V,
ΔH = Qфп = λ парообразования .
Пренебрегая объемом жидкой ртути по сравнению с объемом газообразной, получаем
∆V = V
газ- V жид ≈ V
газ, V = ![]() ;
;
∆U =
λп
− ![]() =
(λ
− RT );
=
(λ
− RT );
m = 1⋅10
−2 кг, М = 107
![]() , р = 1,013 ⋅ 105
, р = 1,013 ⋅ 105
![]() ;
;
R = 8,31 · 103 Дж/ кмоль · град .
Т = 273 + 357 С = 630К,
ΔU = ![]() (1,29 ⋅ 10 − 8,31⋅103
⋅ 630) = − 477 Дж.
(1,29 ⋅ 10 − 8,31⋅103
⋅ 630) = − 477 Дж.
Размерность ΔU = 
Расчет термодинамических потенциалов ΔG и ΔH производится с использованием имеющихся в справочниках и приведенных к стандартным условиям значений ΔS0298K; ΔG0298K и ΔН0298K для простых веществ и химических соединений.
Пример 1. Рассчитать ΔG0298K и определить возможность протекания следующей реакции при стандартных условиях:
С2Н2 (г) + 5/2 O2 (г) = 2СO2 (г) + Н2O + ΔGр-ции , если значение ΔG0298K = 209 (для ацетилена), для углекислого газа ΔG0298K = -393,3, а для жидкой воды ΔG0298K = -237 кДж/моль (для кислорода ΔG0298K = 0).
Решение: ΔGр-ции = 2 ΔG°298K (СO2 (г) ) + ΔG0298K (Н2O (ж) ) - - ΔG0298K (С2Н2 (г)) = 2(-393,3) + (-237) - 209 = -786,6 - 237 - 209 = = -1232,6 кДж/моль. Поскольку полученное значение ΔGр-ции < 0, реакция может идти в прямом направлении.
Пример 2. Вычислить изменения энтропии образования (ΔS0обр) этанола из элементов, если (ΔS0298К) при стандартных условиях для С(Т) графит = 5,21; Н2(г)= 130,52; O2(л) = 205,18; С2Н5ОН(ж)= 160,78 кДж/моль
Решение: ΔS0образ = ΣΔS298K (продуктов) - ΣΔS298K (реагентов). Уравнение образования этанола из элементов: 2С + 3Н2 + 1/2O2 = С2Н5ОН. Подставляя величины ΔS0образ = 160,78 - (2×5,21 + 3×130,52 + 1/2( 2×205,18) = = -343,79 кДж/моль.
Вопросы для самопроверки
1. Что такое энергия? Перечислите известные вам ее виды, сформулируйте закон сохранения энергии.
2. Что понимается под внутренней энергией термодинамической системы? Что такое энтальпия? Какова связь между внутренней энергией и энтальпией?
3. Сформулируйте первое начало термодинамики. Приведите его математическое выражение. В чем особенности тепловой энергии?
4. Сформулируйте закон Гесса. Укажите условия его применения. Как рассчитывают тепловые эффекты реакций, которые могут быть найдены экспериментально? Какие данные для этого необходимы?
5. Укажите связь закона Гесса с первым законом термодинамики.
6. Как определяют теплоты реакций из энтальпий образования веществ?
7. Что такое параметр состояния? Какие параметры состояния термодинамической системы являются интенсивными, экстенсивными? перечислите термодинамические параметры, применяющиеся для описания систем, в которых протекает химическая реакция (в том числе и биологических).
