
- •В) Визначення запаху води.
- •Г) Визначення смаку води.
- •Д) Визначення прозорості води.
- •Е) Визначення каламутності води.
- •Визначення карбонатів та гідрокарбонатів.
- •Хід визначення:
- •Робота №5. Визначення хпк стічної рідини.
- •Робота №6. Біохімічна потреба у кисні.
- •Робота №8. Визначення показника хлоруємості.
Робота №1. Визначення фізичних показників якості води.
Точність аналізу води в більшості випадків залежить від правильного відбору проб. Відбирають проби у склянки з гумовими або притертими корками, які заздалегідь ополоскують досліджуваною водою.
Оцінюючи якість води, в першу чергу враховують такі важливі фізичні показники, як температуру, кольоровість, запах, вкус, прозорість, каламутність.
а) Визначення температури води.
У
водопровідних та насосних установках
температуру визначають, занурюючи
термометр у струмінь стікаючої води.
Відлік ведуть не виймаючи термометр з
води. При окремих визначеннях вміщують
на 3-5 хвилин у великий сосуд з
водою.Температурні межі питної води
7-12![]() .
.
б) Визначення кольоровості води.
Кольоровість
природних вод зумовлена наявністю
насамперед гуматів заліза (залізних
солей гумінових кислот). Підвищену
кольоровість має вода рік, які мають
болотний тип живлення. Оцінюють
кольоровість у градусах платиново-кобальтової
або біхромат-кобальтової шкали. Згідно
з ГОСТ 2874-73 господарчо-питної води,
кольоровість води повинна бути не більше
20
.
Біхромат-кобальтова шкала готується
так: у невеликому об‘ємі дистильованої
води розчиняють в окремій посуді 0,0875 г
біхромату калію
![]() та 2,0 г сульфату кобальту
та 2,0 г сульфату кобальту
![]() .
Розчини солей змішують, додають 1 мл
концентрованої сірчаної кислоти (
.
Розчини солей змішують, додають 1 мл
концентрованої сірчаної кислоти (![]() )
та доводять дистильованою водою до 1 л.
1 мл основного розчину відповідає 5
)
та доводять дистильованою водою до 1 л.
1 мл основного розчину відповідає 5![]() .
Для приготування шкали змішують основний
розчин з розчином, який містить 1 мл
сірчаної кислоти (
.
Для приготування шкали змішують основний
розчин з розчином, який містить 1 мл
сірчаної кислоти (![]() )
в 1 л, доводячи загальний об‘єм розчину
до 100 мл. Наприклад, для приготування
розчину, який має кольоровість 20
,
потрібно змішати 4 мл основного розчину
з 96 мл розчину сірчаної кислоти. Для
визначення застосовують безкольорові
циліндри діаметром 30 мм та висотою 350
мм. Каламутну воду спочатку фільтрують.
)
в 1 л, доводячи загальний об‘єм розчину
до 100 мл. Наприклад, для приготування
розчину, який має кольоровість 20
,
потрібно змішати 4 мл основного розчину
з 96 мл розчину сірчаної кислоти. Для
визначення застосовують безкольорові
циліндри діаметром 30 мм та висотою 350
мм. Каламутну воду спочатку фільтрують.
Хід роботи: Кількісно кольоровість води визначають колориметрично. 100 мл досліджуваної води налити у циліндр. Порівняти її колір з кольором розчинів шкали на білому фоні при розгляданні зверху. Якісну оцінку кольоровості проводять, порівнюючи з дистільованою водою. Для цього у склянку з безколірного скла налити окремо дистильовану та досліджувану воду. На фоні білого листа паперу при денному освітленні воду розглянути згори та збоку. На основі цього оцінити кольоровість, тобто вказати колір (слабо-жовтий, бурий і т.п.). При відсутності забарвлення вода вважається безколірною.
В) Визначення запаху води.
Запахи води за характером поділяються на запахи природного та штучного походження.
Запахи штучного походження зумовлені деякими домішками стічних вод, які потрапляють у водоймища. Ці запахи називають за речовинами зі схожим запахом: фенольний, хлорфенольний, нафтовий, смоляний і т.п. Запахи води визначають органолептично та оцінюють за п‘ятибальною шкалою (від 0 до 5) (табл.1).
Таблиця 1.
Інтенсивність |
Характеристика |
0 |
запаху(cмаку) немає |
1 |
дуже слабкий |
2 |
слабкий |
3 |
помітний |
4 |
виразний |
5 |
дуже сильний |
За ГОСТ 2874-73 запах питної води не повинен перевищувати 2 балів.
Хід
роботи:
Широкогорлу колбу ємкістю 300 мл на 2/3
заповнити досліджуваною водою, накрити
годинниковим склом, струсити обертальним
рухом, зняти годинникове скло та втягнути
носом повітря з колби. Дослід проводити
при температурі 20![]() .
Визначити якісну характеристику запаху
та встановити його інтенсивність по
шкалі.
.
Визначити якісну характеристику запаху
та встановити його інтенсивність по
шкалі.
Г) Визначення смаку води.
Розрізняють чотири види смаку води: солоний, гіркий, кислий, солодкий. Інші смакові відчуття називаються присмаками (наприклад, лужний, металічний, рибний і т.п.).
Смак води обумовлений наявністю речовин природного походження або речовин, які потрапляють у неї зі стічними водами. Так, солоний смак води звичайно викликаний присутністю хлориду натрію, гіркий - сульфату магнію. Кислим смаком підземна вода частіше всього зобов‘язана присутності розчиненого вуглекислого газу.
За ГОСТ 2874-73, "Вода питна" смак води не повинен перевищувати 2 балів.
Хід роботи: смак води визначають органолептично. 10-15 мл води декілька секунд тримають в роті не ковтаючи, даючи якісну характеристику смаку та оцінку його інтенсивності.
Д) Визначення прозорості води.
Наявність у природній воді грубодисперсних домішок обумовлює її каламутність. Часто в якості непрямого показника використовують характеристику, протилежну каламутності, - прозорість. Існує два методи визначення прозорості води: 1) по хресту, 2) по шрифту.
Визначення прозорості по шрифту засновано на знаходженні максимальної висоти стовпа води, через який можливо прочитати стандартний шрифт. Визначають у безкольорових циліндрах діаметром 3,0-3,5 см та висотою 60 см з поділками через кожний сантиметр. Стандартний шрифт підкладають під циліндр на відстань 4 см від дна. Досліджувану воду наливають у циліндр та, змінюючи кількість води, визначають граничну висоту стовпа (см), при якій можливо прочитати шрифт. Згідно з ГОСТ 2874-73, прозорість питної води по шрифту повинна бути не меншою, ніж 30 см.
Е) Визначення каламутності води.
Згідно з ГОСТ 2874-73 для питної води допускається каламутність не більше 1,5 мг/л. Визначити каламутність можна ваговим методом, візуальним каламутномером, фотоелектронним тиндалеметром та фотоелектричним колориметром.
Ваговий метод: Пробу води 500-1000 мл фільтрують через щільний фільтр (синя стрічка) діаметром 9-11 см. Попередньо філтр доводять до постійної ваги у сушильній шафі при температурі 105 С, зважуючи у закритому бюксі на аналітичних вагах. Фільтр з осадом висушують у бюксі при температурі 105 С на протязі 2 годин, охолоджують в ексикаторі, зважують у бюксі з закритою пробкою, потім розраховують кількість зважених речовин, мг/л:
![]()

де
![]() вага бюксу з фільтром та осадом на ньому
(після
вага бюксу з фільтром та осадом на ньому
(після
просушування;
![]() вага
бюксу з фільтром (після просушування);
вага
бюксу з фільтром (після просушування);
![]() -
об‘єм
профільтрованої
води, мл.
-
об‘єм
профільтрованої
води, мл.
Робота №2. Визначення загальної та вільної кислотності,
загальної та вільної лужності води.
Кислотністю
води називають місткість у воді речовин,
які вступають у реакцію з сильними
лугами (їдким натром, їдким калієм).
Об‘єм 0,1 н. розчину лугу, який пішов на
титрування таких речовин, відповідає
загальній кислотності води p,
мг-екв![]() л
л![]() .
.
У природних водах кислотність в більшості випадків залежить лише від вмісту вільної розчиненої вуглекислоти:
![]() .
.
Частина кислотності, обумовлена наявністю гумінових кислот та інших слабких органічних кислот, розчинених у воді, називається природною кислотністю води; pH такої води звичайно не буває нижчою за 4,5.
Промислові стічні води можуть вміщувати сильні кислоти або солі сильних кислот та слабких основ (найчастіше заліза та алюмінію), які підлягають гідролізу, внаслідок якого кислотність зростає. pH води в цих випадках зазвичай знижується нижче за 4,5.
Та
частина загальної кислотності, при якій
знижується pH
води до 4,5 і нижче, називається вільною
кислотністю води m,
мг-екв![]()
![]() .
.
Кислотність води визначається титруванням розчином сильної основи. Кількість 0,1 н. розчину сильної основи, при витраті якого pH розчину сягає значення 4,5, відповдає вільній кислотності m, а при витраті якого pH розчину сягає значення 8,3 - відповідає загальній кислотності p.Якщо pH досліджуваної води більше, ніж 8,3, її кислотність дорівнює 0.
Хід роботи: Попередньо визначають вільну кислоту за метиловим-оранжевим (кисла реакція) або, замірюючи pH (<4,5). Якщо попереднє визначення показало наявність вільної кислоти, то проводять кількісне визначення вільної та загальної кислотності.
Визначення вільної кислотності m.
До 100 мл досліджуваної води додають 2 краплі розчину метилового-оранжевого та титрують до появи жовтого забарвлення.
Визначення загальної кислотності p.
До 100 мл досліджуваної води додають 3 краплі розчину фенолфталеїну та титрують 0,1 н. розчином їдкого натру до появи рожевого забарвлення. Вільну кислотність m та загальну кислотність p обчислюють за формулами:
![]() ;
; ![]()
де
![]() об‘єм 0,1 н. (або 0,01н.) розчину
об‘єм 0,1 н. (або 0,01н.) розчину
![]() ,
витрачений на
,
витрачений на
титрування за метиловим оранжевим, мл;
![]() об‘єм
0,1 н. (або 0,01 н.) розчину NaOH,
витраченого на титрування за фенолфталеїном,
мл;
об‘єм
0,1 н. (або 0,01 н.) розчину NaOH,
витраченого на титрування за фенолфталеїном,
мл;
H -- нормальність розчину NaOH;
V -- об‘єм досліджуваної води, узятої для титрувння, мл.
Визначення лужності.
Під лужністю розуміють здатність води реагувати з кислотпми.
Лужність
води обумовлена іонами OH![]() ,
а також
,
а також
![]() ,
,
![]() ,
солі яких , підлягаючи гідролізу,
утворюють гідроксид-іони. В природних
водах лужність зазвичай характеризується
концентрацією гідрокарбонатів
(гідрокарбонатна), у лужних водах -
карбонатів (карбонатна). Лужність,
зумовлена розчинними гідроксидами,
називається гідратною.
,
солі яких , підлягаючи гідролізу,
утворюють гідроксид-іони. В природних
водах лужність зазвичай характеризується
концентрацією гідрокарбонатів
(гідрокарбонатна), у лужних водах -
карбонатів (карбонатна). Лужність,
зумовлена розчинними гідроксидами,
називається гідратною.
Визначається лужність води кількістю мілілітрів кислоти, необхідною для нейтралізації 1 л води. Виражається вона в мг-екв.
Хід
роботи:
В конічну колбу на 250 мл відміряти
піпеткою 100 мл води, додати 2-3 краплини
метилоранжу та титрувати 0,1 н. робочим
розчином HCl![]() до
переходу жовтого забарвлення до
оранжевого.
до
переходу жовтого забарвлення до
оранжевого.
![]()
де
![]() загальна лужність води, мг-екв
загальна лужність води, мг-екв![]() ;
;
об‘єм 0,1 н. HCl, яка пішла на титрування, мл;
H - нормальність робочого розчину кислоти;
V - об‘єм води, яку взято для дослідження, мл.
Робота №3. Визначення агресивної вугільної кислоти у воді.
Визначення зв‘язаних форм вугільної кислоти у лужній воді.
Вугільна
кислота та її солі - постійні компоненти
природних вод. Вміст вільної вугільної
кислоти залежить від концентрації
розчиненого двоокису вуглецю. Тому що
у формі вугільної кислоти знаходиться
лише незначна частина розчиненого
двоокису кисню (біля 1%), вміст вільної
вуглекислоти у воді характеризується
сумою:
![]() .
При цьому розрахунок ведуть не на
кислоту, а на
.
При цьому розрахунок ведуть не на
кислоту, а на
![]() .
Вугільна кислота дисоціює у водному
розчині:
.
Вугільна кислота дисоціює у водному
розчині:
![]() ;
; ![]() .
.
Константи диссоціації для 1 та 2 ступеню:
 ;
; 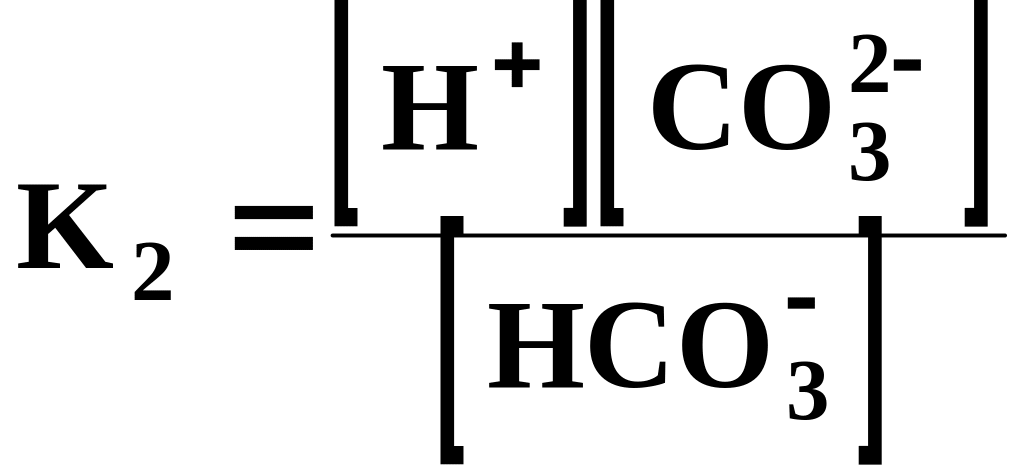 .
.
З
рівнянь випливає, що концентрація
вільної вугільної кислоти знаходиться
у прямій залежності від водневих іонів,
а концентрація карбонат-іонів - у
зворотній. При pH
<4,5 у природних водоймищах міститься
лише вільна вуглекислота. Поява у воді
гідрокарбонат-іонів підвищує рівень
pH.
Від 4,2 до 8,3 у воді присутні вільна
вуглекислота та іони
![]() ,
до того ж, з ростом pH
зростає концентрація
-іонів
та знижується концентрація вільної
вуглекислоти. При pH=8,4
у воді присутні практично лише
гідрокарбонати (99.7%). При подальшому
зростанні pH
у воді поряд з
-іонами
з‘являються
,
до того ж, з ростом pH
зростає концентрація
-іонів
та знижується концентрація вільної
вуглекислоти. При pH=8,4
у воді присутні практично лише
гідрокарбонати (99.7%). При подальшому
зростанні pH
у воді поряд з
-іонами
з‘являються
![]() -іони,
які при pH>10
стають переважаючими.
-іони,
які при pH>10
стають переважаючими.
Зв‘язаною вважають вуглекислоту у формі карбонатів. У формі гідрокарбонатів вона складається зі зв‘язаної та напівзв‘язаної кислоти (порівну), тому що при кип‘ятінні половина гідрокарбонатів переходить у вільну вуглекислоту:
![]() .
.
Якщо
у воді знаходиться вільна вуглекислота
та
-іони,
кількість зв‘язаної кислоти дорівнює
кількості напівзв‘язаної. При pH>8,4
кількість зв‘язаної кислоти (![]() )
буде більшою, ніж зв‘язаної (
)
буде більшою, ніж зв‘язаної (![]() ).
).
