
- •Кафедра общей химии химия
- •Содержание:
- •Введение
- •1 Инструкция по работе с учебно-методическим пособием
- •2 Программа дисциплины
- •Ен.Ф.04. Химия. 100
- •Содержание курса
- •Тема 1. Периодический закон и система элементов д.И. Менделеева.
- •Тема 2. Химическая связь и строение молекул.
- •Тема 3. Энергетика химических процессов.
- •Тема 4. Химическая кинетика, катализ и химическое равновесие.
- •Тема 5. Истинные растворы и способы выражения концентраций.
- •Тема 6. Физические свойства растворов.
- •Тема 7. Реакции обменного разложения в растворах электролитов.
- •Тема 8. Гетерогенные химические системы и поверхностные явления в них.
- •Тема 9. Окислительно-восстановительные реакции и их использование в химическом анализе.
- •Тема 10. Электрохимические системы.
- •Тема 10. Органические соединения и полимеры.
- •3 Контрольные работы
- •5 Задания на контрольную работу
- •Задания 1-20 (таблица 2) Тема 1. Периодические закон и система элементов д.И. Менделеева
- •Контрольные задания.
- •Тема 2. Химическая связь и строение молекул Задания 21-40 (таблица 3)
- •Контрольные задания
- •Тема 3. Энергетика химических процессов Задания 41-60 (таблица 4)
- •Контрольные задания.
- •Тема 4. Химическая кинетика, катализ и химическое равновесие Задания 61 – 80 (таблица 5)
- •Контрольные задания
- •Тема 5. Истинные растворы и способы выражения концентраций растворов Задания 81 – 100 (таблица 6) Контрольные задания
- •Тема 6. Физические свойства растворов Задания 101 – 120 (таблица 7)
- •Тема 7.2. Гидролиз солей Задание 141 – 160 (таблица 9)
- •Контрольные задания
- •Тема 8. Гетерогенные химические системы и поверхностные явления в них Задания 161а – 180а, 161б – 180б (таблица 10)
- •Контрольные задания (а)
- •Контрольные задания (б)
- •Тема 9. Окислительно-восстановительные реакции и их использование в химическом анализе Тема 9.1. Овр с участием сложных веществ Задания 181 – 200 (таблица 11)
- •Контрольные задания.
- •Тема 9.2. Овр с участием металлов Задания 201 – 220 (таблица 22)
- •Контрольные задания
- •Тема 10. Электрохимические системы Тема 10.1. Электродные потенциалы и гальванические элементы Задания 221 – 240 (таблица 13)
- •Контрольные задания.
- •Тема 10.2. Коррозия металлов Задания 241 – 260
- •Контрольные задания
- •Тема 10.3. Электролиз Задания 261 – 280
- •Контрольные задания
- •Тема 11. Органические соединения и полимеры Задания 281 – 300 (таблица 14) Контрольные задания
- •5. Темы лабораторных работ
- •6. Темы практических занятий
- •7. Вопросы для подготовки к экзамену (зачету) экзаменационный билет № -----
- •Вопрос 1. Для данных реакций:
- •Вопрос 2. (ориентирован на будущую спецальность, дается из любого раздела образовательного стандарта по дисциплине «Химия»).
- •8. Список рекомендуемой литературы
Тема 2. Химическая связь и строение молекул Задания 21-40 (таблица 3)
Пример:
Определите тип химических связей в молекулах Br2, HBr, KBr. Приведите схемы перекрывания электронных орбиталей при образовании ковалентных связей в указанных молекулах.
Решение:
Br2: молекула брома образована из атомов одного элемента. Электроотрицательность брома равна 2,8 (таблица 18), поэтому Δ электроотрицательности = 2,8 – 2,8 = 0, следовательно, связь в молекуле брома Br2 –ковалентная неполярная, (Br- Br).
HBr: Δ электроотрицательности = 2,8 - 2,1 = 0,7, т.е. <0,7 => ковалентная полярная связь, связующая электронная пара смещена в сторону атома брома (Hδ+→Brδ-). Поэтому атом водорода приобретает эффективный положительный заряд, а брома – эффективный отрицательный.
KBr : Δ электроотрицательности = 2,8 - 0,91 = 1,89, т.е.>1,7 => связь преимущественно ионная, (K-Br).
У атома брома валентными являются электроны четвертого энергетического уровня: …4s24p5,
s p
4 |
↑↓ |
|
↑↓ |
↑↓ |
↑ |
неспаренный электрон находится на р-орбитали, электронная орбиталь имеет форму гантели.
Образование химической связи в молекуле Br2 можно отобразить схемой:
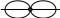

 + →
+ →
Br Br Br — Br
У атома водорода валентными является 1s-электрон, его электронная орбиталь имеет сферическую форму.
Схема образования химической связи в молекуле HBr.


+
 →
→
H Br H — Br
Контрольные задания
Определите тип химических связей в молекулах, указанных в таблице 3. Изобразите схемы перекрывания валентных орбиталей при образовании ковалентных связей в выделенных молекулах. (При необходимости используйте таблицы 15 – 19).
Таблица 3
№ |
Соединения |
Поясните, |
21 |
РСl3; HCl |
в чем сущность образования ковалентной связи? Какая из следующих связей полярна: а) Р–Cl; б) Н–Сl? |
22 |
CsF, CaH2 |
что называется полярностью химической связи. Ответ поясните, исходя из теории строения атома. |
23 |
РН3, Н2 |
в чем сущность механизма образования ковалентной неполярной связи? |
24 |
KCl, NH3 |
в чем сущность донорно-акцепторного механизма образования ковалентной связи? |
25 |
F2, H2O |
в чем сущность образования ковалентной связи? Какая из следующих связей полярна: а) F–F; б) O–H? |
26 |
KCl, КI |
что называется длиной химической связи? Как изменяется длина связи в указанных молекулах? |
27 |
СН4, АlCl3 |
что такое гибридизация? Определите типы гибридизации в указанных молекулах |
28 |
Аl(OH)3, С2Н4 |
что такое направленность ковалентной связи? Механизм образования π- связи. |
29 |
NaCl, H2 |
что такое направленность ковалентной связи? Механизм образования σ- связи. |
30 |
HCOH, CCl4 |
сколько σ- и π-связей образует атом углерода в выделенной молекуле? Какова его степень окисления? |
31 |
CH3COOH, CH4 |
сколько σ- и π-связей образует атом углерода в выделенной молекуле? Какова его степень окисления? |
32 |
C2H5OH, СНСl3 |
сколько σ- связей образует атом углерода в выделенной молекуле? Каковы его валентность и степень окисления? |
33 |
NCl3, MgCl2 |
что такое SP – гибридизация. Укажите молекулу с этим типом гибридизации. |
34 |
H2S , H2Se |
в какой из указанных молекул значение дипольного момента больше? Ответ поясните. |
35 |
СН3ОН, Н2О |
какую химическую связь называют водородной? В каких случаях она осуществляется? |
36 |
SiCl4, MgCl2 |
что такое SP3 – гибридизация. Укажите молекулу с этим типом гибридизации. |
37 |
АlCl3 , SiCl4 |
что такое SP2 – гибридизация. Укажите молекулу с этим типом гибридизации. |
38 |
H2O , H2S |
в какой молекуле связь более полярна? Укажите направление дипольных моментов в этих молекулах. |
39 |
KF, К2S |
какую химическую связь называют ионной? Покажите механизм ее образования. По каким свойствам ионная связь отличается от ковалентной? |
40 |
NaAlO2, CH3Cl |
сколько σ- и π-связей образует атом алюминия в выделенной молекуле? Какова его степень окисления? |
