
- •Москва 2015
- •Выписка из инструкции по технике безопасности основные правила работы в лабораторном практикуме
- •Задание 1. Приготовление буферных растворов.
- •Результаты определения буферного действия растворов
- •Влияние разбавления на рН буферных растворов
- •Результаты определения буферной емкости номерного раствора
- •Лабораторная работа № 3 Потенциометрическое титрование
- •Задание 1. Определение концентрации, основности и силы кислот титрованием NaOh
- •Предварительное титрование
- •Предварительное титрование
- •2. Точное титрование
- •Точное титрование
- •Лабораторная работа № 4 Электрическая проводимость и ее использование для анализа растворов электролитов
- •Вычисления:
- •Лабораторная работа № 5 кондуктометрическое титрование
- •Результаты кондуктометрического титрования
- •Задание 1. Определение постоянной калориметра
- •Результаты вычислений
- •Лабораторная работа 7 изучение адсорбции уксусной кислоты почвой
- •Результаты титрования растворов уксусной кислоты до и после адсорбции
- •Результаты обработки опытных данных
- •Результаты обработки данных по уравнению Фрейндлиха
- •Результаты расчета констант уравнения Ленгмюра
- •Лабораторная работа № 8 адсорбция и поверхностные явления
- •Методы определения поверхностного натяжения
- •Поверхностное натяжение спиртов
- •Измерения проводят по методике, описанной в задании 1. Результаты заносят в таблицу 17.
- •Зависимость поверхностного натяжения изобутилового спирта от концентрации раствора
- •Строят график зависимости поверхностного натяжения от концентрации раствора (по оси абсцисс концентрация раствора, а по оси ординат поверхностное натяжение).
- •Результаты вычислений к и адсорбционных характеристик пав
- •Лабораторная работа № 9 коллоиды, их образование и свойства
- •Результаты определение ζ – потенциала
- •Лабораторная работа № 10 коагуляция коллоидов
- •Результаты расчета коагулирующей силы испытуемого золя
- •Результаты коагуляции гидрофильных и гидрофобных золей и определение их обратимости
- •Лабораторная работа № 11. Определение иэт гидрофильного золя желатины визкозиметрическим методом
- •Результаты измерений
- •Оказание первой медицинской помощи в лабораторном практикуме кафедры физической и органической химии ргау-мсха имени к.А. Тимирязева
- •127550, Москва, Тимирязевская ул., 44
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ –
МСХА имени К.А. ТИМИРЯЗЕВА
Факультет почвоведения, агрохимии и экологии
Кафедра физической и органической химии
ЛАБОРАТОРНО-ПРАКТИЧЕСКИЕ ЗАНЯТИЯ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
Рабочая тетрадь
Москва 2015
Лабораторно-практические занятия по физической и коллоидной химии: Рабочая тетрадь / С.Л. Белопухов, С.Э. Старых, Т.В. Шнее, В.Т. Семко, И.Б. Немировская, Т.А. Федорова, А.В. Моргунов. М.: Изд-во РГАУ – МСХА имени К.А. Тимирязева, 2015, 68 с.
Рабочая тетрадь составлена в соответствии с программой дисциплины «Физическая и коллоидная химия». При составлении рабочей тетради использовалось учебное пособие «Лабораторный практикум по физической и коллоидной химии» 2012 года издания.
Рекомендовано к изданию методической комиссией факультета почвоведения, агрохимии и экологии (протокол № 31 от 17 июня 2013 г.)
|
© Белопухов С.Л., Старых С.Э., Шнее Т.В., Семко В.Т., Немировская И.Б., Федорова Т.А., составители, 2015 |
|
© ФБГОУ ВО РГАУ – МСХА имени К.А. Тимирязева, 2015 |
ОГЛАВЛЕНИЕ
Основные правила работы в лабораторном практикуме |
4
|
Лабораторная работа № 1. Определение электродных потенциалов и концентрации ионов в растворе методом измерения электродвижущих сил.
|
6 |
Лабораторная работа № 2. Буферные системы. Изучение свойств буферных и небуферных систем. Определение буферной емкости раствора. Определение рН потенциометрическим методом в биологических объектах.
|
11 |
Лабораторная работа № 3. Потенциометрическое титрование.
|
17 |
Лабораторная работа № 4. Электрическая проводимость и её использование для анализа растворов электролитов.
|
23 |
Лабораторная работа № 5. Кондуктометрическое титрование.
|
26 |
Лабораторная работа № 6. Термохимия. Закон Гесса. Определение тепловых эффектов химических реакций. Определение энтропии реакции.
|
31 |
Лабораторная работа № 7. Изучение адсорбции уксусной кислоты почвой.
|
39 |
Лабораторная работа № 8. Адсорбция и поверхностные явления.
|
46 |
Лабораторная работа № 9. Коллоиды, их образование и свойства.
|
53 |
Лабораторная работа № 10. Коагуляция коллоидов.
|
57 |
Лабораторная работа № 11. Определение ИЭТ гидрофильного золя желатины визкозиметрическим методом.
|
61 |
Оказание первой медицинской помощи |
66 |
Выписка из инструкции по технике безопасности основные правила работы в лабораторном практикуме
1. К учебным занятиям в химической лаборатории практикума физической и коллоидной химии допускаются лица, прошедшие инструктаж по технике безопасности при выполнении работ лабораторного практикума.
2. Студенты и другие обучаемые лица перед началом занятий размещаются в учебных лабораториях. Нахождение их в других помещениях кафедры без разрешения преподавателя или без сопровождения сотрудником кафедры не допускается.
3. До начала занятий не разрешается приступать к выполнению лабораторных работ, брать и переставлять реактивы и химическую посуду на столах, включать приборы и оборудование. К работе приступать только после начала занятий и с разрешения преподавателя или лаборанта. Не приступайте к работе без уяснения всех требований техники безопасности.
4. В ходе учебных занятий строго придерживайтесь порядка и метода выполнения работы, согласно имеющихся требований. Пользуйтесь реактивами и посудой, предназначенными только для выполнения данной работы. Не берите реактивы и химическую посуду с других столов. При отсутствии требуемого реактива обращайтесь к лаборанту или преподавателю.
5. Категорически запрещается проводить в лаборатории какие-либо работы, не связанные с выполнением полученного от преподавателя задания.
6. Во время занятий в лаборатории необходимо соблюдать чистоту, тишину, выполнять требования техники безопасности, указания преподавателя или старшего лаборанта. Запрещается посторонним лицам посещать студентов, работающих в лаборатории и отвлекать их.
7. При работе не пробуйте на вкус и не нюхайте никаких реактивов и растворов. Не пейте в лаборатории воду и не принимайте пищу.
8. Соблюдайте осторожность при выполнении работ. Не допускайте попадания реактивов на слизистые оболочки рта, носа и глаз. При попадании реактивов на слизистые оболочки немедленно сообщите об этом преподавателю.
9. Экономьте газ, электричество, воду, реактивы. Не превышайте установленных норм расхода реактивов.
10. Растворы солей серебра сливайте в специальную посуду. Почвенные растворы собирайте в специальные емкости.
11. При неисправности электропроводки, газовой или водопроводной сети, лабораторной посуды, приборов и оборудования немедленно сообщите об этом лаборанту или преподавателю.
12. Бережно обращайтесь с посудой и оборудованием.
13. По окончании работы уберите рабочее место и сдайте его лаборанту.
14. Лица, нарушающие правила техники безопасности при проведении работ лабораторного практикума, отстраняются от занятий и вновь допускаются только после повторного инструктажа.
Лабораторная работа № 1
Определение электродных потенциалов и концентрации ионов в растворе методом измерения электродвижущих сил
Краткий конспект:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: овладение навыками работы на ионометре при измерении электродвижущей силы гальванических цепей с помощью электродов первого и второго рода. Расчет электродных потенциалов и концентрации ионов в растворах.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
Потенциометр «Ионометр универсальный ЭВ -74»;
Набор электродов первого рода, электрода сравнения, окислительно-восстановительного электрода;
Подставка для электродов с измерительным стаканчиком;
Растворы электролитов: 1М соли CuSO4 , ZnSO4 , 0,01 М CuSO4, КС1 (насыщенный раствор), 0,1 М растворы К3[Fe(CN)6] и К4[Fe(CN)6], почва №1 и №2.
Задание 1. Измерение ЭДС медно-цинкового гальванического элемента (элемента Даниеля – Якоби).
Схематическая запись элемента:
Сu|CuSO4| KCl | ZnSO4|Zn
E = eCu - eZn
Задание 2. Измерение электродвижущей силы хлорсеребряно-цинкового гальванического элемента и вычисление потенциала цинкового электрода.
Схематическая запись элемента:
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
Вычисляют потенциал цинкового электрода, используя уравнение:
Еоп = eхс - eZn, откуда eZn = eхс - Еоп
Задание 3. Измерение ЭДС медно-хлорсеребряного гальванического элемента и вычисление потенциала медного электрода.
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
Затем вычисляют потенциал медного электрода, используя уравнение
Еоп = eCu - eхс, откуда eCu = Еоп + eхс.
Задание 4. Измерение ЭДС медного концентрационного гальванического элемента
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01 M)|Cu
Задания 5 и 6. Измерение ЭДС окислительно-восстановительной цепи и вычисление окислительно-восстановительного потенциала.
Контрольные растворы для выполнения заданий 5 и 6 получают у преподавателя.
Задание 5.
Схематическая запись элемента:
Pt|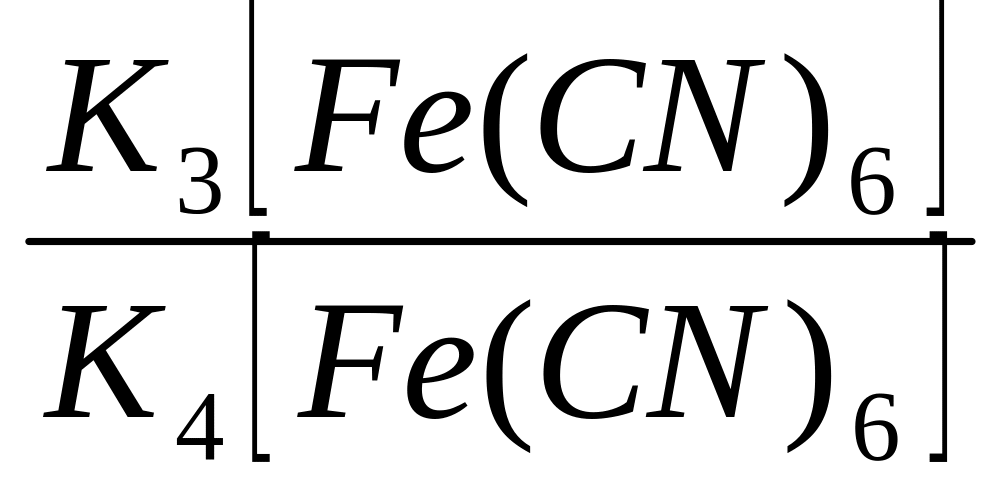 |
|KCl,
AgCl|Ag
|
|KCl,
AgCl|Ag
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Задание 6.
Схематическая запись элемента:
Pt| почва| | KCl, AgCl|Ag
Таблица 1
Результаты определения ЭДС гальванических элементов и
потенциалов отдельных электродов
Гальванические цепи |
Еоп, В |
Етеор, В |
eоп, В |
Cu|CuSO4(1 M)| KCl |ZnSO4(1 M)|Zn
|
|
|
- |
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
|
|
- |
eZn = |
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
|
|
- |
eCu = |
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01М)|Cu
|
|
|
- |
Pt| | |KCl, AgCl|Ag
|
|
- |
eов = |
Pt| почва| | KCl, AgCl|Ag
|
|
- |
eов = |
Расчет ЭДС гальванических цепей и электродных потенциалов электродов, используемых в лабораторной работе.
1. Вычислить ЭДС гальванического элемента Даниеля-Якоби теоретически (Етеор):
E = eCu - eZn
Для вычисления потенциалов используют уравнение Нернста, учитывая, что в 1 М растворе сульфатов меди и цинка fa,CuSO4 = fa,ZnSO4.
Нормальный потенциал медного электрода e0Cu = 0,34 В.
Нормальный потенциал цинкового электрода e0Zn = ‒ 0,76 В.
Поскольку fa,CuSO4 = fa,ZnSO4, теоретическая ЭДС элемента Даниеля-Якоби будет равна
Етеор = e0Cu - e0Zn
Вычисленную теоретическую величину ЭДС записывают в соответствующую графу табл. 1 и сравнивают её с ЭДС, найденной опытным путем. Эти величины должны отличаться не более, чем на 0,05 В.
2. Проверить правильность найденных значений электродных потенциалов медного и цинкового электродов, используя их опытные значения при вычислении ЭДС медно-цинкового гальванического элемента по уравнению
E = eCu - eZn
Сравнивают полученную величину с найденной величиной ЭДС опытным путем в первом задании. Если эти величины отличаются не более чем на 0,01 В, работа выполнена правильно.
3. Проверить правильность измерения ЭДС концентрационной цепи, вычислив теоретически ЭДС медного концентрационного элемента по уравнению
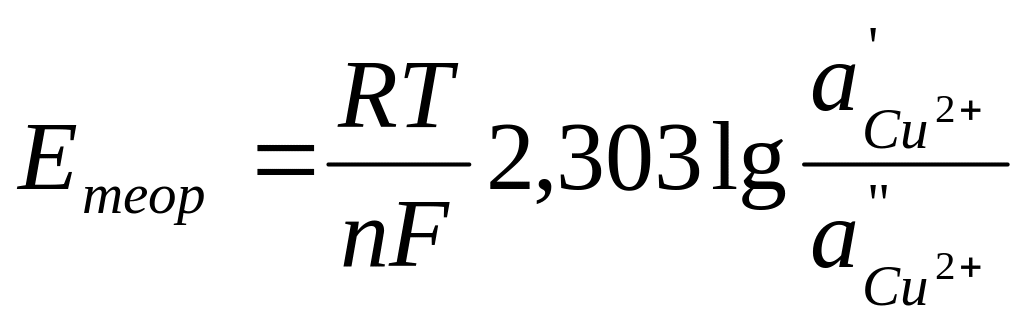
где
– 2,303
![]() =
0,0577 + 0,0002(t
–18) для любой температуры t,
n
– валентность ионов Cu2+;
a’-
активность ионов меди в 1 М растворе
сульфата меди; f’-
коэффициент активности ионов меди 1 М
растворе сульфата меди, равный 0,041; a’’
– активность ионов меди в 0,01 М растворе
сульфата меди; f’’
– коэффициент активности ионов меди в
0,01 М растворе сульфата меди, равный
0,41.
=
0,0577 + 0,0002(t
–18) для любой температуры t,
n
– валентность ионов Cu2+;
a’-
активность ионов меди в 1 М растворе
сульфата меди; f’-
коэффициент активности ионов меди 1 М
растворе сульфата меди, равный 0,041; a’’
– активность ионов меди в 0,01 М растворе
сульфата меди; f’’
– коэффициент активности ионов меди в
0,01 М растворе сульфата меди, равный
0,41.
Вычисленную величину Етеор сравнивают с найденной опытным путем Еоп и, если они отличаются не более чем на 0,01 В, записывают результаты в табл. 1.
4. Рассчитать активность окисленной формы Fe, если известна величина окислительно-восстановительного потенциала (из задания 5 или 6 по указанию преподавателя), активность восстановленной формы Fe равна 0,1; нормальный окислительно-восстановительный потенциал e0ов для данных окислителя и восстановителя равен + 0,771 В.
ВЫЧИСЛЕНИЯ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
Что такое электрод? Примеры.
Электроды первого рода. Уравнение Нернста для электродов первого рода.
Электроды второго рода. Уравнение Нернста для электродов второго рода.
Окислительно-восстановительные электроды и цепи. Уравнение Нернста-Петерса.
Гальванические элементы (цепи). Концентрационные цепи (примеры).
ЛАБОРАТОРНАЯ РАБОТА № 2
БУФЕРНЫЕ СИСТЕМЫ. ИЗУЧЕНИЕ СВОЙСТВ БУФЕРНЫХ И НЕБУФЕРНЫХ СИСТЕМ. ОПРЕДЕЛЕНИЕ БУФЕРНОЙ ЕМКОСТИ РАСТВОРА. ОПРЕДЕЛЕНИЕ рН ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ В БИОЛОГИЧЕСКИХ ОБЪЕКТАХ
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: овладение навыками измерения рН на ионометре “ЭКОТЕСТ – 2000” с использованием стеклянно-хлорсеребряной гальванической цепи различных водных растворов, суспензий и буферных систем. Составление ацетатной и фосфатной буферных систем и измерение их буферной ёмкости. Определение концентрации ионов водородов в природных жидкостях по известным значениям рН.
РЕАКТИВЫ И ОБОРУДОВАНИЕ:
Ионометр “ЭКОТЕСТ-2000”.
Стеклянный и хлорсеребряный электроды.
Подставка для электродов с измерительными стаканчиками.
Измерительные пипетки, бюретки и цилиндры.
Конические колбы для приготовления буферных растворов и почвенных вытяжек.
0,1 М растворы уксусной кислоты и уксуснокислого натрия.
1/15 М растворы гидрофосфата натрия и дигидрофосфата калия.
0,1 М растворы соляной кислоты и едкого натра.
Почвы № 1 и № 2.
