
- •Учебная тетрадь для работы с лекционным материалом по курсу «химия»
- •Тема 1 Электронное строение атома
- •1. Главное квантовое число n:
- •2. Орбитальное квантовое число l:
- •3. Магнитное квантовое число ml :
- •Распределение электронов в атоме
- •3. Правило Хунда: ____________________________________________
- •Способы составления схем распределения электронов в атоме:
- •Периодическая система элементов д.И. Менделеева
- •Тема 2 химическая связь
- •Основные типы химической связи
- •Параметры химической связи
- •Свойства ковалентной связи
- •Молекула оксида углерода (II) со
- •3. Полярность ковалентной связи
- •Полярность молекул
- •Гибридизация атомных орбиталей
- •Типы гибридизации атомных орбиталей
- •Ионная химическая связь
- •Взаимодействие между молекулами
- •Водородная связь
- •Комплексные соединения
- •Структура комплексных соединений
- •Внутренняя сфера (комплекс)
- •Химическая связь в комплексных соединениях
- •Энергетическая диаграмма расщепления (n – 1) d-подуровня комплексообразователя в полях лигандов
- •Координационное число 6
- •Октаэдрическое расщепление (n – 1) d-орбиталей
- •Распределение электронов на (n – 1)d-орбиталях (зависит от силы поля лиганда)
- •Энергетическая диаграмма расщепления d-подуровня
- •Энергетическая диаграмма
- •Координационное число 4
- •Энергетическая диаграмма
- •Энергетическая диаграмма
- •Окраска комплексов
- •Реакционная способность
3. Магнитное квантовое число ml :
определяет —_______________________________________________
показывает —_______________________________________________
принимает значения — ______________________________________
Любому значению l соответствует (2l + 1) значений ml, т.е. (2l + 1) возможных расположений электронного облака данного типа в пространстве – число орбиталей.
s-состояние (l = 0) — одна орбиталь (2·0 + 1 = 1) — ml = 0
p -состояние
(l = 1) — три орбитали
(2·1 + 1 = 3)
-состояние
(l = 1) — три орбитали
(2·1 + 1 = 3)
ml: + 1 0 –1

Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются _______________________________________
Вывод — АО характеризуется определенным набором n, l, ml, т.е. определенными размерами, формой и ориентацией в пространстве.
4. Спиновое квантовое число ms :
определяет —_______________________________________________
принимает значения — ______________________________________
Распределение электронов в атоме
1. В многоэлектронном атоме состояние электрона определяется принципом Паули: ____________________________________________
_______________________________________________________________
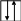
Следствия из принципа Паули:
1) на одной орбитали могут находиться не более двух электронов, отличающихся спинами;
2) максимальное число электронов на энергетическом уровне: 2n2 ;
3) максимальное число электронов на энергетическом подуровне: 2(2l + 1).
Электроны в атоме (основное состояние) распределяются в соответствии с принципом минимальной энергии.
2. Принцип минимальной энергии (Ауфбау принцип):
____________________________________________________________
Правило Клечковского – частный случай принципа минимальной энергии:
- электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел (n + l).
- при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа n.
3. Правило Хунда: ____________________________________________
_
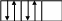 ______________________________________________________
______________________________________________________
Способы составления схем распределения электронов в атоме:
1) в виде формул электронных конфигураций
19К
26Fe
2) в виде графических формул атомной орбитали
к ислород
8О
ислород
8О
2s 2p
1s
Периодическая система элементов д.И. Менделеева
Периодический закон:
формулировка Д.И. Менделеева (1869):
свойства простых тел, а также свойства и формы соединений элементов находятся в периодической зависимости от величины атомных весов элементов;
современная формулировка:
свойства химических элементов, а также свойства и формы образуемых ими соединений находятся в периодической зависимости от величины заряда их ядер.
Элементы располагаются в периодической системе в порядке возрастания заряда их ядер.
Физический смысл периодического закона: вследствие периодически повторяющейся конфигурации электронных оболочек атомов происходит периодическое повторение химических свойств их элементов.
Периодическая таблица состоит из 7 периодов; 8 групп:

Элементы-аналоги — элементы, имеющие одинаковое строение внешних электронных оболочек и расположенные в одной подгруппе.
Пример: ____________________________________________________
Формирующий электрон – последний заполняемый в атоме электрон.
В зависимости от того, на каком энергетическом подуровне находится формирующий электрон, различают четыре типа элементов: s-, p-,d-, f- элементы.
1) s-элементы расположены в 1А, 2А подгруппах и Н, Не.
Краткая электронная формула:
где n — номер периода, (1—2) — номер группы;
Пример: Mg – находится в 3-м периоде n = 3, во второй группе главной подгруппе 2А.
Краткая электронная формула - …3s2
2) р-элементы, расположены в 3А — 8А подгруппах.
Краткая электронная формула
Пример: кислород O находится во втором периоде n = 2, в шестой группе главной подгруппе 6А, x = 6-2 = 4
Краткая электронная формула - …2s22p4
3) d-элементы расположены в Б подгруппах.
Краткая электронная формула
(1) — «проскок электронов»: Cu, Ag, Au, Pt, Pd, Rh, Ru, Cr, Mo, Nb;
4) f-элементы — лантаниды и актиниды.
Краткая электронная формула
Валентность — способность атома присоединять или замещать определенное число других атомов с образованием химических связей.
Количественная мера валентности — число неспаренных электронов в основном или возбужденном состоянии атома.

Кислород (O) 2s22p4 В = ________
Возбужденное состояние: _____________________________________
______________________________________________________________________________________________________________________________
Пример. Mg 3s2 Mg* 3s 3p

Кислород и фтор — возбужденного состояния не имеют, т.к. второй, последний, энергетический уровень не имеет свободных орбиталей, куда бы могли распариваться электроны
O — 2s2p4 F — 2s2p5

Хлор Cl — аналог фтора — валентность: 1, 3, 5, 7
3s 3p 3s 3p 3d

Кобальт Cо: 3d 74s2 – находится в 4-м периоде n = 4, в 8-й группе побочной подгруппе – d-элемент.
В алентность
Co
в основном состоянии 3d 74s2
В =
алентность
Co
в основном состоянии 3d 74s2
В =
Валентность Cо в возбужденном состоянии В*=

Периодические свойства элементов:
радиус атома;
энергия ионизации;
сродство к электрону;
электроотрицательность.
